СТРУКТУРА ВОДЫ НА ТВЕРДЫХ ПОВЕРХНОСТЯХ
А.М.Сыркин, Н.Е.Максимова, Л.Г.Сергеева
ХИМИЯ ВОДЫ
Уфа 2007
УДК 796.016
ББК 75.565
С 95
Утверждено Редакционно-издательским советом УГНТУ
в качестве учебного пособия
Рецензенты:
Заведующий кафедрой "Общая химия" Башкирского государственного медицинского университета, доктор хим. наук, профессор Е.В.Пастушенко
Заведующий кафедрой "Химия" Уфимской государственной академии экономики и сервиса, канд. хим. наук, доцент И.П.Журкина
Сыркин А.М., Максимова Н.Е., Сергеева Л.Г.
С 95 Химия воды: Учебное пособие.- Уфа: Изд-во УГНТУ, 2007.- 95
ISBN 5-7831-0760-3
В данном учебном пособии изложена химия воды:физические и химические свойства природных вод, химический состав природных и пластовых вод, показатели качества и химический анализ воды, методы её очистки. Большое внимание уделено водам нефтяных и газовых месторождений и роли воды в нефтяной промышленности.
Учебное пособие предназначено для студентов нефтяных вузов по специальностям направления "Нефтегазовое дело".
УДК 976.016
ББК 75.565
ISBN 5-7831-0760-3 ©Уфимский государственный
нефтяной технический университет, 2007
© Сыркин А.М., Максимова Н.Е., Сергеева Л.Г, 2007
ВОДА В ПРИРОДЕ
Вода – самое распространенное вещество на Земле. Ею покрыто 71% земной поверхности, её общая масса в гидросфере составляет 1018 тонн. Общее количество её на Земле составляет примерно 1500 млн км3.
Вода в природе встречается в трех состояниях: парообразном, жидком и твёрдом. В атмосфере вода содержится в виде пара, капельно-жидком (в виде облаков и тумана) и твердом состоянии (ледяные кристаллы, град, снег). Всего в атмосфере содержится 13-15 тыс. км3 воды.
На поверхности земли вода в жидком состоянии скапливается в океанах, морях, озерах, реках, водоемах, а также находится в виде ледников и снега, образуя гидросферу. Основную массу воды гидросферы составляет Мировой океан – около 1370 млн км3. В его водах в растворенном состоянии в огромных количествах находятся почти все элементы периодической таблицы Д.И. Менделеева (например, золота около 10 млрд т, молибдена около 300 млрд т, тяжелой воды – источника ядерной энергии – 2,10 т).
В земной коре – литосфере – вода содержится в парообразном, жидком, твердом, в физически и химически связанном состоянии. В связанном состоянии она входит в состав многих минералов и горных пород (гипс, гидросиликаты, глины и др.). Общее содержание воды в литосфере, по разным оценкам, составляет от I до 1,3 млн км3.
Вода, находящаяся во всех живых организмах и растениях, образует воду биосферы.
В природе вода находится в постоянном круговороте. За год только на сушу выпадает 1,25∙1014 тонн осадков в виде дождей и снега. Три четверти этой воды (9∙1013 тонн) испаряется, одна четверть (3∙1013 тонн) воды в год образует речной сток в моря и океаны. Потоки воды переносят огромные массы неорганических и органических веществ. Атмосферные осадки, особенно обильные сезонные осадки и паводки, уносят продукты эрозии почвы, удобрения, органические вещества почвы. Грунтовые и подземные воды переносят большие количества растворимых солей и при благоприятных условиях образуют большие скопления в виде осадков карбонатов, соленых озер и т.п. С атмосферными осадками на сушу выпадают минеральные соли и пыль, перенесенные ветрами с огромных расстояний.
Вода – один из главных факторов изменения минеральных и почвенных покровов земли. Вода, которая содержит катионы +Н3О, образующиеся при диссоциации угольной и других кислот, участвует в превращении первичных изверженных пород во вторичные, в частности в глинистые, почвообразующие.
В ходе круговорота создается исключительное многообразие вод, их различие.
Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни. Без воды невозможно существование живых организмов. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение, как вода. Ежедневно человечество расходует до 7 млрд м3 воды. В нашей стране ежегодно расходуется более 260 млрд м3 воды. Основными потребителями воды являются химическая, нефтехимическая, целлюлозно-бумажная отрасли промышленности, металлургия, энергетика, где вода используется как сырьё, в качестве химического реагента, растворителя, тепло- и хладоносителя. Значительное количество воды идет на орошение в сельском хозяйстве и для питьевых нужд. Замечательное свойство воды – растворять самые различные соединения – широко используется в геолого-разведочном деле при поиске полезных ископаемых, как рудных (сульфидных руд, полиметаллов), так и нерудных (нефти, газа, солей и т.д.). В районах месторождений подземная вода имеет специфический химический состав.
СТРОЕНИЕ МОЛЕКУЛ ВОДЫ
В молекулах воды ядра атомов образуют равнобедренный треугольник с протонами в основании и ядром атома кислорода в вершине. В свободных молекулах воды (в парах) межъядерные расстояния О–Н равны 0,09568 нм. Угол между направлениями связей составляет 104о27’, а расстояние между протонами 0,1515 нм (рис. 1).
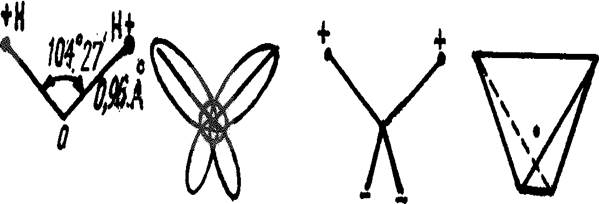
Рис. 1. Модель молекулы воды (по Н.Бьерруму)
Под влиянием электростатического поля соседних молекул или ионов указанные параметры могут несколько изменяться. Это происходит при изменении агрегатного состояния воды, растворении в ней других веществ или под влиянием поверхностного слоя кристаллов твердого тела, с которым соприкасается вода.
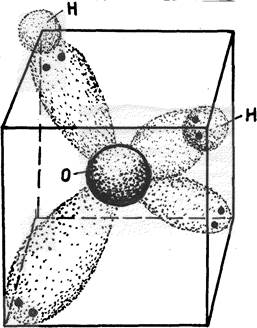
При образовании молекулы воды происходит sp3-гибридизация орбиталей атома кислорода и возникают четыре гибридные электронные орбитали. При этом два гибридных облака, участвующие в образовании ковалентной связи, вытягиваются в направлении атома водорода. Электроны, образующие связи О–Н, смещены к более электроотрицательному атому кислорода. В результате атом кислорода имеет отрицательный заряд –0,66 элементарного заряда, атомы водорода – положительный, 0,33 каждый. Неподелённые пары электронов, находящиеся на гибридных орбиталях, не участвующих в образовании связи, удаляются от ядра атома кислорода в сторону, противоположную связям О–Н. Это способствует появлению двух полюсов отрицательных зарядов. Таким
|
|
Вследствие такого несимметричного строения вода обладает высоким дипольным моментом (1,84 Д) или 5,52∙10–3 Кл∙м. Это один из самых больших электрических дипольных моментов молекул с небольшим числом атомов. Эти особенности строения молекулы Н2О имеют очень важные следствия:
1) большой электрический дипольный момент молекулы воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах;
2) молекула воды образует водородные связи с электроотрицательными атомами других молекул, в том числе других молекул воды;
3) неподеленные электронные пары позволяют молекуле Н2О образовывать комплексные соединения по донорно-акцепторному механизму с катионами металлов.
Два первых следствия являются причиной того, что вода имеет высокие температуры кипения и плавления. Отсюда же широкий температурный интервал существования жидкого состояния воды (0…100оС) и большие числовые значения теплоты испарения (40,7 кДж/моль) и теплоты плавления (6,0 кДж/моль). В результате, вода является растворителем, способным растворять огромное число неорганических и биоактивных веществ.
Высокая полярность является также причиной диссоциации в воде электролитов. Значительное влияние на строение и свойства воды и её растворов оказывает способность молекул воды образовывать водородные связи. Каждая молекула воды способна образовать четыре водородные связи с соседними молекулами по схеме (рис.3):
|
|


Рис. 3. Структура воды
а) образование водородных связей между молекулами воды;
б) гексагональная структура льда
Количество связей зависит от температуры. Но взаимодействие между молекулами воды оказывается достаточно сильным, что даже в парах воды присутствуют димеры и тримеры состава (Н2О)2 и (Н2О)3. В растворах же могут возникать длинные цепи ассоциатов (Н2О)n. Длина водородной связи О ... Н изменяется в пределах от 0,14 до 0,2 нм, а энергия от 17 до 33 кДж/моль.
СТРУКТУРА ВОДЫ
Структура воды имеет большое значение для объяснения её свойств и процессов, связанных с её участием. Структура жидкой воды в настоящее время точно не установлена, о чем свидетельствуют десятки теорий. В основе этих теорий лежит представление о подобии структуры жидкой воды структуре льда.
Известно 13 полиморфных модификаций льда, устойчивость которых зависит от температуры и давления. При 0°С и давлении I атм. устойчивым является лед, имеющий гексагональную кристаллическую решетку (рис. 3). В кристалле льда каждая молекула воды окружена тетраэдрически четырьмя другими молекулами, которые стягиваются с ней водородными связями. Из рисунка видно, что такое соединение молекул воды приводит к возникновению ажурного каркаса, имеющего свободные полости – «пустоты», размеры которых превышают размеры самих молекул.
Водяной пар не имеет структуры, он состоит преимущественно из одиночных молекул воды и, как уже упоминалось, частично из ассоциатов из двух и трех молекул. Многие ученые полагают, что структура жидкой воды занимает промежуточное положение между паром и структурой льда. Они считают, что при плавлении льда часть водородных связей разрушается и пустоты кристаллического каркаса льда, слегка нарушенного тепловым движением молекул, частично заполняются освободившимися одиночными молекулами. С повышением температуры степень заполнения полостей каркаса молекулами воды увеличивается. Согласно теории, разработанной советским ученым Самойловым, в результате теплового движения молекулы приобретают способность к трансляционному (скачкообразному) переходу в полостях каркаса от одного положения равновесия к другому. Существуют два положения равновесия в узлах льдоподобных каркасов и в их полостях. Скачкообразно могут перемещаться только молекулы, обладающие повышенной энергией, т.е. активированные молекулы. Время перехода молекул из одного состояния в другое, а оно происходит преимущественно по пустотам, составляет величину порядка 10–13 с.
ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Чистая вода прозрачна, не имеет запаха и вкуса. По ряду физических свойств чистая вода обнаруживает по сравнению с другими химическими соединениями необычные – аномальные – отклонения. Аномалии свойств воды, имеющие исключительное значение в природе и жизни, связаны с её структурными особенностями и со способностью образовывать молекулярные агрегаты.
Аномалия плотности заключается в том, что плотность льда (0,9168г/см3 при 0°С) меньше, чем у жидкой воды (0,9982 г/см3 при 20°С), а максимум плотности (0,99997 г/см3) достигается при 4°С. Это связано со структурными превращениями, происходящими с водой при изменении температуры. При увеличении температуры от более низкой до +4°С часть водородных связей в структуре льда разрушается. В среднем на каждую молекулу в этих условиях приходится уже не 4 водородные связи, а 3,4. Среднее время существования каждой водородной связи в жидкой воде очень мало и составляет менее 10–9 секунды. Освободившиеся молекулы воды попадают в полости льдоподобного каркаса, что приводит к уменьшению объёма и повышению плотности жидкой воды по сравнению со льдом. При температуре выше 4°С процесс заполнения пустот уже не компенсируется увеличением объёма воды за счет роста интенсивности теплового молекулярного движения. В результате объём воды начинает увеличиваться, а плотность уменьшается. При охлаждении воды протекают обратные процессы. Замерзание её сопровождается увеличением объёма примерно на 10%. Это может привести к разрыву труб, емкостей, к развитию трещин в скальных породах, разрушению бетона, цементного камня при нахождении их в условиях мерзлоты.
Аномально высокая теплоемкость воды (4,178 Дж/г К при 20оС) связана с затратой тепла не только на повышение температуры, но и на частичный разрыв водородных связей и заполнение молекулами воды пустот структуры. Эта особенность воды существенно влияет на климат и жизнь живых организмов.
Крайне высокая величина теплоты испарения воды (2250 кДж/кг при 22°С), которая обусловливает величину работы для преодоления сил притяжения и перевода вещества из жидкого в газообразное состояние, объясняется относительной прочностью водородных связей.
Высокий дипольный момент воды при сравнительно небольшом молекулярном объёме обусловливает в электрическом поле особенно сильную поляризацию, которая характеризуется аномально высокой диэлектрической проницаемостью, равной 81. Диэлектрическая проницаемость представляет собой число, показывающее, во сколько раз силы взаимодействия частиц какого-либо вещества уменьшаются в растворителе по сравнению с силами их взаимного притяжения в пустоте. Высокая диэлектрическая проницаемость обусловливает высокую растворяющую и диссоциирующую способность воды.
Из всех жидкостей (за исключением ртути) вода обладает самым высоким поверхностным натяжением (73.10-3 Н/м при 18 °С). Это свойство определяет многие поверхностные явления.
ИЗОТОПНЫЙ СОСТАВ ВОДЫ
Все аномалии воды невозможно объяснить, не учитывая, что у атомов водорода и кислорода, составляющих молекулу воды, существуют изотопы. Для водорода известны два стабильных изотопа: протий 1Н и дейтерий 2Н (D). Содержание дейтерия в природной смеси изотопов водорода–0,015(мольных%). У кислорода три стабильных изотопа – 160, 170, 180. Соотношение их в природной смеси 2670:1:5. Таким образом, соединение, которое мы называем водой, в природе является смесью 9 изотопных разновидностей: H216O, H217O, H218O, HD18O, HD17O, HD16O, H216O, D216O, D217O, D218O. Основную массу воды составляют молекулы H216O (99,73 мольных %). Вода, отвечающая химической формуле D2О, называется тяжелой водой, свойства которой отличаются от свойств Н2О. Тяжелая вода замерзает при 3,8°С, кипит при 101,4°С, плотность её 1,1059 при 20°С. Максимальную плотность она имеет при +11,23°С. Растворимость электролитов в тяжелой воде ниже, а неэлектролитов выше, чем в обычной воде.
Специфические свойства тяжелой воды связаны с её строением. Структура её идентична структуре обычной воды, но молекула отличается меньшим расстоянием О–D по сравнению с О–Н. Вследствие этого в льдоподобном каркасе молекулы тяжелой воды оказываются ближе друг к другу, благодаря чему дейтериевая связь прочнее водородной. Тяжелую воду получают электролизом природной воды. Поскольку тяжелая вода труднее подвергается электролизному разложению, то она накапливается в электролизере. В тяжелой воде замедляются некоторые реакции и биологические процессы. Она, в частности, применяется в качестве замедлителя ядерных процессов.
ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
В молекуле воды атомы связаны между собой прочными σ–связями. Энергия образования молекул водяного пара при температуре 25оС составляет 926,3 кДж/моль. Прочностью связей следует объяснить высокую устойчивость молекулы воды к нагреванию – термической диссоциации, которая начинается лишь выше 1000°С.
2Н2О  2Н2+О2
2Н2+О2
Разложение воды происходит также под действием ультрафиолетового (фотодиссоциация) или радиоактивного излучения (радиолиз). В последнем случае, кроме Н2 и О2, образуется также перекись водорода и свободные радикалы. Радиолиз воды оказывает большое влияние на геологические процессы, в частности, на накопление осадков, образование рассолов солей, на окислительные процессы в нефтях и т.д. При обычных условиях вода не проявляет свойств окислителя или восстановителя, поскольку все электроны в молекуле воды прочно связаны (потенциал ионизации равен 12,56 В). Только при взаимодействии с сильными восстановителями, преимущественно при высокой температуре, вода играет роль окислителя:
2Ме + 2Н2О = 2МеОН + Н2↑
С + Н2О = СО + Н2↑
Окисляется же вода ещё труднее и также при действии только очень сильных окислителей, например:
H2O + [O] = H2O2
H2O + F2 = 2HF + O(F2O, H2O2, O2)
H2O + Cl2 = HCl + HClO
Вместе с тем, вода является весьма реакционноспособным веществом. Это объясняется: I) наличием в её молекуле двух неподеленных пар электронов, что определяет способность образовывать донорно-акцепторные связи с катионами металлов и водородные связи с атомами сильно электроотрицательных элементов; 2) высокой полярностью молекул воды и их высоким поляризующим действием; 3) способностью диссоциировать на ионы Н+ и ОН–. Эти свойства определяют способность воды вступать в реакции присоединения (процессы гидратации) и реакции гидролитического разложения (реакции гидролиза). Металлы взаимодействуют с водой, образуя соответствующий гидроксид и водород.
2Na+H2O=2NaOH+H2
Ca+2H2O=Ca(OH)2+H2
Оксиды ряда металлов и многих неметаллов соединяются с водой, образуя основания и кислоты.
SO2+H2O  H2SO3
H2SO3
SO3+H2O=H2SO4
2NO2+H2O=HNO3+HNO2
P2O5+3H2O=2H3PO4
CaO+H2O=Ca(OH)2
MgO+H2O=Mg(OH)2
Многие из сильно основных и сильно кислотных оксидов настолько энергично взаимодействуют с водой, что могут быть использованы для поглощения и связывания её, как осушители (Р2О5). Присоединение воды к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов, кетонов.



При взаимодействии воды с солями могут происходить реакции гидролиза и гидратации.
2CaCO3+2H2O  Ca(HCO3)2+Ca(OH)2
Ca(HCO3)2+Ca(OH)2
AlCl3+H2О  (AlOH)Cl2+HCl
(AlOH)Cl2+HCl
Вода обладает также каталитической активностью: взаимодействие щелочных металлов или водорода с галогенами, некоторые органические реакции идут лишь в присутствии хотя бы следов воды.
СТРОЕНИЕ ВОДНЫХ РАСТВОРОВ
Образование растворов сопровождается изменением структуры воды. При растворении электролитов происходит гидратация ионов, которая сопровождается как образованием гидратных оболочек вокруг ионов, так и изменением теплового, трансляционного движения молекул воды. Ионы, находящиеся в растворе, располагаясь внутри полости льдоподобного каркаса, могут устойчиво взаимодействовать с ближайшими молекулами воды, уменьшая их трансляционное движение и, следовательно, подвижность. Такое явление называется положительной гидратацией. Она характерна для ионов с малым радиусом и большим зарядом, т.е. имеющих большую плотность заряда. Такие ионы, упорядочивающие структуру воды, называют стрикторами. К ним относятся Cr3+, Al3+, Mg2+, Ca2+, Ba2+, Na+, OH–, CO32-, SO42-. Крупные ионы частично разрушают льдоподобный каркас воды, разрывая водородные связи. Если к тому же заряд иона небольшой, то разорванные водородные связи не будут эффективно заменены сильным взаимодействием молекул воды с ионом. При этом трансляционное движение молекул воды усиливается, возрастает их подвижность. Это явление, вызывающее разупорядочивание структуры воды, называют отрицательной гидратацией. Ионы с малой плотностью заряда (K+, NH4+, NO3–, Br–, I–, Cl–), вызывающие отрицательную гидратацию, называют дестрикторами. Так как в растворе одновременно находятся катионы и анионы и каждый из них влияет на структуру воды, то суммарное их воздействие зависит от того, какой из ионов производит более интенсивное изменение. Например, раствор КОН более упорядочен по структуре, чем чистая вода. Это объясняется тем, что упорядочивающее действие аниона -ОН преобладает над разупорядочивающим действием катиона К+. Ионы в водных растворах и сами совершают трансляционное движение по пустотам льдоподобного каркаса. При этом стрикторы перемещаются (мигрируют) вместе со «связанной водой», дестрикторы без ближайших молекул воды, а точнее при их обмене. Это следует учитывать при рассмотрении движения воды в пластах при оценке обменных реакций в буровых растворах.
Механизм гидратации катионов и анионов неодинаков. Катионы, имеющие незаполненный квантовый уровень, связываются с молекулами воды за счет донорно-акцепторной связи с неподеленной парой атома кислорода. Гидратная оболочка анионов формируется за счет водородных связей. Поэтому катионам свойственна более сильная гидратация, чем анионам. Модель гидратной оболочки иона представлена на рис. 4А, 4Б.


Рис. 4 А. Простая модель двухслойной Рис. 4 Б. Строение гидратированного
гидратной оболочки иона катиона
Предполагается, что находящийся в растворе ион окружен двумя слоями. Расположенные во внутреннем слое А молекулы воды наименее подвижны. Структура воды здесь наиболее упорядочена за счет наиболее прочного взаимодействия с ионом электролита. В этом слое, как говорят, происходит ближняя гидратация. Ориентация диполей воды перерастает в химическую связь. Время жизни молекул воды в ней может достигать нескольких часов. Область С заполнена молекулами воды с ненарушенной, «нормальной» структурой.
В промежуточном слое В происходит дальняя гидратация. Здесь вода находится под поляризующим воздействием иона и молекул воды области С. Находясь под одновременным воздействием вода в слое В имеет наиболее разупорядоченную структуру (рис. 4Б).
|

Время жизни молекул во второй гидратной оболочке составляет доли секунды.
В целом гидратация сопровождается большими энергетическими эффектами, ∆S гидратации имеют большие положительные значения. Стрикторы характеризуются максимальной толщиной слоя А, дестрикторы – слоя В.
Гидратация ионов и влияние их на структуру воды зависит от концентрации раствора. В разбавленных растворах, когда гидратированные ионы находятся на каком-то расстоянии друг от друга, между ними сохраняются участки воды с ненарушенной структурой (рис.5, а). При повышении концентрации расстояние между гидратированными ионами уменьшается, они начинают сближаться, и при концентрации раствора
1,5-2 моль/л происходит перекрывание гидратных оболочек (рис. 5, б). При дальнейшем повышении концентрации разупорядочивающее влияние ионов с отрицательной гидратацией исчезает, поскольку весь объём раствора подвержен действию электростатических сил притяжения. В концентрированных растворах область структурно нормальной воды в растворе перестает существовать (рис. 5, в). Такие растворы по структуре напоминают расплав электролита. Поэтому концентрированные растворы электролитов сильно отличаются по своим свойствам, особенно по растворяющей способности. Так, некоторые горные породы и минералы практически не растворяются в чистой воде, но хорошо растворяются в концентрированных водных растворах. Это следует учитывать при приготовлении и использовании буровых растворов в скважинах.
Влияние ионов на структуру воды можно сравнить с влиянием температуры и давления, так как рост температуры способствует ослаблению структуры воды, а рост давления способствует её упорядоченности. Отсюда возникло понятие о структурной температуре ионного раствора, т.е. такой температуре, при которой вода в нем имеет ту же структуру и свойства, что и чистая вода. Стрикторы понижают структурную температуру воды, дестрикторы – повышают. Понятие «структурная температура» дает возможность судить о структурных перестройках, происходящих под воздействием растворенных в воде веществ. Поскольку с перестройкой структуры связано изменение диэлектрической проницаемости, то увеличение или уменьшение этого параметра свидетельствует и об изменении растворяющей способности воды. Чем сильнее проявляется упорядочивающее действие ионов, тем заметнее снижается диэлектрическая проницаемость. Изменяется и такое свойство, как текучесть: стрикторы – Na+, SO42– и др. уменьшают текучесть раствора. Суммарный эффект воздействия давления и растворенного электролита отражаетcя понятием структурное давление раствора – это давление в растворе, соответствующее внешнему давлению в чистой воде, при котором частота трансляционных скачков молекул воды (следовательно, и структура воды) оказывается такой же, как и в данном растворе. Из представления о структурном давлении следует вывод, основанный на принципе Ле-Шателье. В системах, где наблюдается равновесие между твердой фазой и водой, рост внешнего давления должен приводить к растворению ионов с отрицательной гидратацией (например. K+, Cl–, I–, Br– и др.). При понижении давления в раствор будут переходить ионы с положительной гидратацией – Mg2+, Ca2+ и т.д. На основе понятий о структурной температуре раствора и о структурном давлении объясняют вертикальную зональность состава подземных вод. Их следует учитывать при применении буровых растворов в зависимости от глубины бурения cкважин и изменения пластовых условий.
Гидратная вода иногда настолько прочно связана с ионами, что при охлаждении раствора молекулы воды входят в состав кристаллизующейся соли. Такие твердые кристаллические образования, имеющие в своем составе воду, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Состав кристаллогидратов обычно выражают в виде формул, показывающих, какое количество молекул кристаллизационной воды приходится на одну молекулу вещества. Например, кристаллогидрат сульфата кальция (гипс), содержащий на один моль CaSO4 два моля воды, изображается формулой СаSO4∙2H2O.
Многие соли кристаллизуются из водных растворов с различным количеством кристаллизационной воды, в зависимости от температуры. Так, сульфат меди образует кристаллы с пятью, тремя и одной молекулами воды. Если соль образует несколько кристаллогидратов, то тот из них, который содержит больше воды, устойчив при более низких температурах.
Кристаллизационная вода может быть удалена нагреванием. При этом разложение идет ступенчато, например, разложение пентагидрата меди проходит в три стадии:
CuSO4∙5H2O  CuSO4∙3H2O + 2H2O
CuSO4∙3H2O + 2H2O
CuSO4∙3H2O  CuSO4∙H2O + 2H2O
CuSO4∙H2O + 2H2O
CuSO4∙H2O  CuSO4 + H2O
CuSO4 + H2O
Если сушкой при высоких температурах кристаллизационную воду удалить, соль будет поглощать влагу из воздуха. Такое свойство, гигроскопичность, проявляет CaCl2. Эта соль, поглощая из воздуха воду, превращается в раствор.
Равновесие в гетерогенной реакции разложения кристаллогидратов характеризуется давлением водяных паров, которое для данной температуры является величиной постоянной. Она называется давлением диссоциации. Равновесное давление водяного пара над кристаллогидратами ниже, чем над чистой водой. Так, при 50°С давление насыщенного пара чистой воды равно 92,51 мм рт. ст., а равновесное давление водяных паров для CuSO4∙5H2O при этой температуре – 47, для CuSO4∙3H2O – 30, для CuSO4∙H2O – 4,4 мм рт. ст. (рис. 6).
|
|

Для различных кристаллогидратов одной соли наименьшим давлением водяного пара обладают кристаллогидраты с меньшим содержанием воды. С повышением температуры давление диссоциации кристаллогидрата возрастает. Дегидратация кристаллогидратов может происходить или при повышении температуры или при понижении концентрации водяных паров в окружающей среде.
Если влажность окружающего воздуха меньше, чем давление диссоциации данного кристаллогидрата, то он теряет воду. Слитность кристаллов при этом нарушается, и они превращаются в тонкий порошок; происходит выветривание кристаллов. При большой влажности окружающей среды безводные соли или кристаллогидраты с малым содержанием воды вначале гидратируются с большим содержанием молекул воды в кристалле, а затем, продолжая поглощать воду, расплываются. Это дает возможность применять некоторые безводные соли (СаСl2, K2CO3, CuSO4) в качестве осушителей. Характер связи молекул воды в кристаллической решетке кристаллогидрата может быть различным. Молекулы воды могут быть связаны как с катионами за счет донорно-акцепторных связей, так и с анионами за счет водородных связей. Кристаллогидраты, образующиеся за счет донорно-акцепторного взаимодействия, по существу представляют собой частный случай комплексных соединений. Например, кристаллогидрат CrCl3∙6H2O является в действительности комплексным соединением [Cr(OH2)6]Cl3. Своеобразными свойствами обладают кристаллогидраты с большим числом молекул воды, например, Na2SO4∙10H2O, Al2(SO4)3∙27H2O. Они имеют структуру льда, в полостях которой равномерно распределены противоположно заряженные ионы. За счет стягивающего действия молекул воды электростатически взаимодействующими ионами структура льда стабилизируется, что проявляется в повышении температуры плавления кристаллогидрата более чем на 30оС. Такие кристаллогидраты называются тектогидратами.
С растворами электролитов имеют много общего и растворы неэлектролитов и неполярных газов. Если размер молекул растворяемого вещества небольшой, то они, растворяясь, внедряются в полости льдоподобных структур воды. По мере заполнения такими молекулами пустот льдоподобного каркаса происходит стабилизация структуры воды, падает величина диэлектрической проницаемости и снижается растворяющая способность воды по отношению к солям. Крупные молекулы неэлектролитов и неполярных газов образуют в структуре воды полости больших размеров, например, за счет изгиба водородных связей. Энергия, необходимая для образования таких полостей, выделяется при разрыве водородных связей. Каждая молекула неэлектролита, находясь в полости, стабилизирует большое количество молекул воды. Так, молекула метана, в зависимости от условий, может удерживать от 6 до 20 молекул воды. Образуемые структуры называются гидратами. Образование гидратов сопровождается выделением тепла (14-134 кДж/моль), так как энергия взаимодействия между молекулами неэлектролита и воды больше энергии взаимодействия между молекулами воды. Предполагают, что в гидратах молекулы воды расположены по углам пятиугольников, а из пятиугольников строятся сложные многогранники (полиэдры), пустоты в которых и заполнены молекулами неэлектролитов (рис. 7).
 Рис.7 Модель гидрата газа
Рис.7 Модель гидрата газа
Если эти молекулы удалить, то устойчивость всего каркаса уменьшается и он подвергается частичному или полному распаду и перестройке. Способствуя разрушению структуры воды, образование гидратов вызывает повышение температуры замерзания. По мере растворения неполярного газа наблюдается увеличение объёма воды. Это можно объяснить вытеснением молекулами газа тех молекул воды, которые до этого заполняли пустоты льдоподобного каркаса. Этот факт следует учитывать при добыче и перекачке обводненных газов.
Гидраты образуют многие компоненты природного газа. Газовые гидраты – твердые кристаллические вещества, по внешнему виду напоминающие снег. Плотность гидратов отдельных газов изменяется в широких пределах – от 0,8 до 1,8 г/см3. Для природных газов плотность гидрата находится в пределах 0,9-1,1 г/см3.
Гидраты компонентов природных газов имеют формулы: CH4 ∙ 5,75H2O;
C2H6 ∙ 8H2O; C3H8 ∙ 17H2O; C4H10 ∙ 17H2O; H2S ∙ 6H2O; CO2 ∙ 6H2O. Образование гидратов определяется составом газа, внешним давлением и температурой. Чем выше плотность газа, тем выше температура гидратообразования. Зависимость гидратообразования и газов от температуры и давления определяется диаграммой состояния (рис. 8).
|

Для заданной температуры повышение давления выше равновесной кривой сопровождается образованием гидрата. Обратное снижение давления или повышение температуры при неизменном давлении сопровождается разложением гидрата.
В определенных условиях в районах распространения многолетней мерзлоты возможно существование месторождений природного газа в виде гидратов. Создание эффективных методов поисков и эксплуатации таких месторождений, основанных на основе использования различных свойств гидратов и связанной воды, позволит значительно увеличить запасы газа.
При попадании в воду неполярных молекул значительных размеров, таких как молекулы жидких углеводородов, происходит разрыв связей между молекулами воды, а новые связи с молекулами углеводородов не образуются. Поэтому жидкие углеводороды в воде не растворяются.
СТРУКТУРА ВОДЫ НА ТВЕРДЫХ ПОВЕРХНОСТЯХ
Многие вещества способны поглощать (адсорбировать) на своей поверхности воду из окружающей среды за счет нескомпенсированного силового поля. Наиболее сильно молекулы воды адсорбируются на поверхности веществ, которые способны связывать их в результате взаимодействия химического характера, то есть за счет хемосорбции. Она наблюдается, например, при адсорбции водяных паров на поверхности некоторых оксидов металлов. В этом случае образуется лишь мономолекулярный слой связанной воды. К этой форме адсорбции примыкает поглощение воды на поверхности многих ионных кристаллов, когда молекулы воды взаимодействуют с катионами с образованием донорно-акцепторных связей, или с анионами с образованием водородных связей, или притягиваются ионами в результате ион-дипольного взаимодействия. Адсорбция воды в более слабой форме происходит и под влиянием физических факторов за счет нескомпенсированного электростатического поля частиц (атомов, ионов, молекул) поверхности. Адсорбция молекул воды твердыми поверхностями имеет много общего с гидратацией ионов и молекул в растворах, то есть представляет собой воздействие активных центров поверхностей на трансляционное движение молекул воды и оказывает влияние на поляризацию отдаленных молекул. В результате ближайшие к поверхности молекулы воды оказываются прочно связанными и закономерно ориентированными, структура воды при этом упорядочивается. Толщина слоя такой прочно связанной воды очень невелика. С удалением от поверхности сила связи ослабевает и ориентирование молекул воды также ослабевает. В зависимости от удаленности молекул воды от поверхности и, соответственно, от уровня энергетической связи с поверхностью адсорбционно-связанную воду подразделяют на прочносвязанную (гигроскопическую) и рыхлосвязанную (пленочную). Силы связи между поверхностью и прочносвязанной водой очень велики, но радиус их действия мал и составляет доли микрона. Толщина слоя прочносвязанной воды в большей мере зависит от химического состава поверхности: наибольшая толщина слоя прочно адсорбированной воды характерна для минералов и материалов на основе силикатов, в меньшей мере – для минералов карбонатных пород и ещё меньше для сульфидов. Вследствие высокой упорядоченности структуры прочносвязанная вода по свойствам сильно отличается от свойств жидкой воды в обычном состоянии и приближается к её свойствам в кристаллическом состоянии. Она имеет гораздо меньшее давление насыщенного пара, поскольку в ней ограничено движение молекул, плотность её в среднем равна 1,5 г/см, температура замерзания около –80°С, диэлектрическая проницаемость её составляет 2,0-2,2, поэтому растворяющая способность очень мала. По мере увеличения расстояния от твердой поверхности силы притяжения молекул воды ослабевают и за слоем прочносвязанной воды находится рыхлосвязанная вода. Она образует вокруг минерала как бы пленку, которая удерживается вблизи минерала, благодаря межмолекулярным силам между молекулами связанной воды, сильнополяризованным силовым полем поверхности. Эффект поляризации распространяется в более слабой степени на последующие слои. Ориентирующее действие полярной поверхности и повышение связанности воды могут проявляться на расстоянии порядка 10-6 см, вызывая, в частности, её повышенную вязкость, более низкую температуру замерзания (-1÷-1,5°С) по сравнению со свободной водой. На практике соотношения между прочносвязанной и рыхлосвязанной водой сильно усложняются в связи с тем, что вместо чистой воды в процессе участвуют различные природные или другие воды, содержащие растворенные электролиты, газы и другие вещества. Эти примеси оказывают влияние на количество связанной воды за счет образования вокруг них гидратных оболочек.
Большое количество адсорбционно-связанной воды находится в микротрещинах и у стенок поровых каналов большого диаметра горных пород, преимущественно глинистых. Количество связанной воды в глинах (примерно 600 млн км3-) соизмеримо по объёму с количеством воды в океанах и морях. Гигроскопическая вода настолько прочно связана с частицами породы, что не способна передвигаться в пустотах породы под действием силы тяжести. Пленочная вода способна передвигаться по породам от мест, где толщина пленки большая, к местам, где пленки тоньше. Движение по стенкам пустот происходит до тех пор, пока пленки не станут равной толщины. При тектонических движениях, уплотнении пород и других процессах пленочная вода отжимается из пород или, наоборот, засасывается в них. С этим связаны многие важные явления формирования химического состава подземных вод, рудообразования, нефте- и газообразования.
Вода может находиться и между двумя твердыми поверхностями в узких капиллярах. Такая вода называется капиллярной. Роль капилляров могут играть поры соответствующего размера, любые по геометрической форме. Вода заполняет капилляры в грунтах, горных породах, бетонах и т.д. и удерживается в них за счет сил поверхностного натяжения. По своей структуре и свойствам капиллярная вода является рыхлосвязанной, то есть переходной между связанной и свободной. Например, вода, связанная капиллярными силами в относительно широких капиллярах, обладает давлением пара, близким к давлению насыщения, и поэтому замерзает почти при 0°С. При переходе к более узким капиллярам вода становится более связанной, давление пара понижается и соответственно понижается температура её замерзания (рис. 9).
|

В гелях и студнях вода одновременно может находиться в прочносвязанном, рыхлосвязанном и свободном состоянии.
