Механізми перетравлення поживних речовин у травному тракті
Поживні речовини, які надходять з продуктами харчування, проходять наступні обов'язкові етапи метаболізму: травлення, всмоктування, транспорт з травного тракту до інших органів і тканин, проникнення всередину клітини (етап транспорту через клітинну мембрану) і перетворення ферментативними системами клітини.
Перетравлення є початковим етапом метаболізму поживних речовин, у процесі якого відбувається гідроліз харчових компонентів їжі ферментами травного тракту. Характер гідролізу поживних речовин визначається складом ферментів травних соків і специфічністю їх дії.
Більшість травних ферментів має відносну субстратну специфічність дії, що полегшує гідроліз різних поживних речовин до мономерів і простіших сполук. Розпаду в травному тракті підлягають вуглеводи, ліпіди, білки та деякі простетичні групи складних білків. Інші компоненти їжі (вітаміни, мінеральні речовини та вода) всмоктуються у незміненому стані.
Процес травлення в основному відбувається у трьох відділах травного тракту: ротовій порожнині, шлунку і тонкій кишці, де виділяються секрети залоз, що містять гідролітичні ферменти. У товстій кишці за участі мікрофлори частково розщеплюється целюлоза.
У порожнину травного тракту надходить приблизно 8,5 л травних соків, в яких міститься до 10 г різних ферментів.
У залежності від розміщення ферментів процес травлення поділяють на три види: порожнинне (гідролітичні ферменти знаходяться у секретах травних залоз у вільному стані), мембранне, або пристінкове (ферменти знаходяться у слизу або зв’язані з апікальною мембраною епітеліоцитів) і внутрішньоклітинне (ферменти знаходяться в цитоплазмі та органоїдах клітин). Для травного тракту характерно перших два види. Мембранне травлення відбувається у ворсинках тонкої кишки. Особливість його полягає в тому, що гідроліз невеликих молекул (наприклад, дипептидів, дисахаридів) здійснюється на поверхні клітинної мембрани кишкового епітелію і поєднується з транспортом продуктів гідролізу всередину клітини. Внутрішньоклітинний гідроліз забезпечується переважно ферментами лізосом.
Ферменти травного тракту можна розділити на чотири групи:
1) ферменти, що беруть участь у травленні вуглеводів (гліколітичні ферменти);
2) ферменти, що беруть участь у травленні білків і пептидів (протеолітичні ферменти);
3) ферменти, що беруть участь у травленні нуклеїнових кислот (нуклеази і гідролази нуклеотидів);
4) ферменти, що беруть участь у травленні ліпідів (ліполітичні ферменти).
10.2.1. Перетравлення білків у шлунку.Травлення білків, які поступили в організм у складі їжі, розпочинається в шлунку під впливом шлункового соку. Останній – продукт діяльності кількох типів клітин: парієнтальні клітини стінки шлунка синтезують хлоридну кислоту та фактор Касла (глікопротеїн, який зв’язує вітамін В12, запобігаючи його руйнуванню та сприяючи всмоктуванню); головні – секретують пепсиноген; додаткові та інші – виділяють муцинмісний слиз.
Впродовж доби в людини утворюється 1,5 - 2 л шлункового соку, його густина становить 1,002 – 1,007 г/см3, а рН - 1,5 – 2,5. Твердий залишок складається з органічних (ферменти, муцини) і неорганічних (хлоридів, сульфатів, фосфатів, гідрокарбонату натрію, калію, кальцію, магнію) речовин. Основний неорганічний компонент шлункового соку – хлоридна кислота (НСI) може бути як у вільному, так і у зв’язаному з білками стані.
Білки, що надходять у шлунок, стимулюють виділення гістаміну та групи білкових гормонів – гастринів, які, своєю чергою, викликають секрецію НСІ і пепсиногену. Синтез НСІ відбувається в парієнтальних клітинах і являє собою цАМФ-залежний процес, який підсилюється на тлі глікогенолітичної та гліколітичної активності, що супроводжується продукцією пірувату. окиснювальне декрбоксилювання останнього до ацетил-КоА та СО2 забезпечує накопичення у цитоплазмі НАДН2, який використовується для генерування Н+.
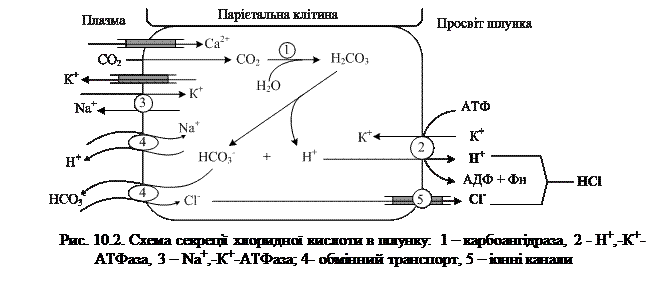 Джерелом протонів є Н2СО3, яка утворюється в парієнтальних клітинах шлунка з СО2 та Н2О під впливом фермента карбоангідрази (рис. 10.2). Дисоціація Н2СО3 призводить до утворення бікарбонату, котрий за участі спеціальних білків виводиться в плазму в обмін на Cl-, та протонів, котрі поступають у просвіт шлунка шляхом активного транспорту за участі Н+, -К+ -АТФази. При цьому концентрація іонів Н+ у просвіті шлунка зростає в 106 разів. Іони Cl- поступають у просвіт шлунка через хлорні канали.
Джерелом протонів є Н2СО3, яка утворюється в парієнтальних клітинах шлунка з СО2 та Н2О під впливом фермента карбоангідрази (рис. 10.2). Дисоціація Н2СО3 призводить до утворення бікарбонату, котрий за участі спеціальних білків виводиться в плазму в обмін на Cl-, та протонів, котрі поступають у просвіт шлунка шляхом активного транспорту за участі Н+, -К+ -АТФази. При цьому концентрація іонів Н+ у просвіті шлунка зростає в 106 разів. Іони Cl- поступають у просвіт шлунка через хлорні канали.
Під час секреції мітохондрії оточують секреторні канальці, а в деяких випадках їх мембрани зливаються – утворюється мітохондріально-секреторний комплекс, в якому іони Н+ можуть безпосередньо акцептуватись Н+-К+-АТФазою секреторної мембрани і транспортуватися з клітини.
Na+-К+-АТФаза, розташована на базо-латеральній поверхні парієнтальної клітини, переносить іони К+ з крові в обмін на Na+, тоді як Н+-К+-АТФаза транспортує калій з первинного секрету в обмін на протони.
Таким чином, кислотоутворювальна функція парієнтальних клітин здійснюється завдяки фосфорилуванню-дефосфорилуванню, наявності мітохондріального окиснювального ланцюга, який транспортує іони Н+ з матриксу, а також активності Н+-К+-АТФази секреторної мембрани, яка перекачує протони з клітини за рахунок енергії АТФ.
Утворена хлоридна кислота створює оптимальне рН для дії протеолітичних ферментів шлункового соку та викликає денатурацію і набухання білків, що сприяє їх розщепленню ферментами; бере участь у звурдженні молока; стимулює секрецію ферменту ентерокінази ентероцитами 12-палої кишки; забезпечує антибактеріальні властивості шлункового соку; регулює активність підшлункової та шлункових залоз, гальмуючи утворення гастрину та стимулюючи синтез секретину й інших гастроінтестинальних гормонів; впливає на моторну активність шлунка, сприяє перетворенню пепсиногену на пепсин.
Пепсин А (методом електрофорезу виділено 7 видів пепсину) утворюється в головних клітинах слизової оболонки шлунка в неактивній формі, у вигляді проферменту пепсиногену – білка, який складається з одного поліпептидного ланцюга з молекулярною масою 40 000 Да. Під впливом НСl він перетворюється на активний пепсин (молекулярна маса 40 000 Да): шляхом обмеженого протеолізу від N-кінця пепсиногену відщеплюється пептид (42 амінокислотних залишки), утворений переважно позитивно зарядженими амінокислотами. Утворений пепсин містить в основному негативно заряджені амінокислоти, він активує решту молекул пепсиногену (автокаталіз), оптимум рН для дії цього фермента — 1,5—2,5. Каталітична активність пепсину дуже висока: 1 г пепсину впродовж двох годин здатний гідролізувати 50 000 г денатурованого яєчного альбуміну.
Активний центр пепсину містить карбоксильні групи 2-х залишків аспарагінової кислоти, у нативній або денатурованій молекулі білка він швидко гідролізує пептидні зв’язки, утворені карбоксильними групами ароматичних амінокислот (фенілаланін, триптофан, тирозин), повільно руйнуються зв’язки між лейцином і дикарбоновими амінокислотами. Оскільки цей фермент належить до ендопептидаз, то внаслідок його дії у шлунку утворюються короткі пептиди, які гідролізуються до амінокислот у тонкій кишці.
У слизовій оболонці шлунка міститься також фермент пепсин С (гастриксин), який гідролізує пептидні зв’язки дикарбонових амінокислот, рН оптимум його дії 3,0 – 3,5. Співвідношення між пепсином і гастриксином у шлунковому соці коливається в межах 1:2 - 1:5. Пепсин В (желатиназа) – розріджує желатин, гідролізує білки сполучної тканини, але рН оптимум його дії знаходиться в межах 5 – 6. Пепсин Д (хімозин, ренін) – фермент з молекулярною масою 40 000 Да, що синтезується в шлунку дітей грудного віку та молодих тварин, специфічно діє на основний білок молока — казеїн: шляхом відщеплення глікопептиду перетворює його на параказеїн. Останній у присутності іонів кальцію перетворюється на сироподібну масу, яка далі розщеплюється пепсином. Особливе значення цей процес має для молодих організмів, в яких молоко в перші місяці життя є основним продуктом харчування. У дорослих звурдження молока в шлунку відбувається за участі пепсину та НСl. Оскільки всі перелічені ферменти мають подібну первинну структуру, очевидно, вони походять від спільного гена-попередника.
виділення пепсинів стимулюють ацетилхолін, гастрин і, меншою мірою, гістамін. При зменшенні виділення хлоридної кислоти протеолітична активність гальмується, тоді як при збільшенні секреції НСI пепсин стає агресивним фактором стосовно слизової оболонки шлунка. Дія пепсину на клітини слизової, не захищені слизом, призводить до руйнування епітеліальних клітин шлункових залоз, а згодом – до утворення ерозій та виразок.
10.2.1.1. Порушення травлення білків у шлунку.Процес перетравлення білків у шлункуможе порушуватися при різних захворюваннях, які супроводжуються змінами кислотності та утворення пепсину.
Кислотність шлункового соку визначають за кількістю мл 0,1 н NаОН, що затрачається на титрування 100 мл шлункового соку по певному індикатору і виражають у титраційних одиницях (ТО). При визначенні кислотності шлункового соку розрізняють загальну кислотність, зв’язану НСl та вільну НСl. Загальна кислотність – сукупність усіх кислотореагуючих речовин, що містяться у шлунковому соку, який накопичується впродовж 1 години. Цей показник у нормі становить 40 – 60 ТО. Зв’язана НСl – зв’язана хлоридна кислота з білками та продуктами їх травлення, у нормі становить 20 – 30 ТО. Вільна НСl – кислота, не зв’язана з компонентами шлункового соку, у нормі становить 20 – 40 ТО.
У клініці кислотність досліджують шляхом внутрішньошлункової рН-метрії (у порожнині шлунка рН-датчиками). Нормальними показниками вважають рН у тілі шлунка в базальну фазу секреції 1,5 – 2, а в стимульовану – 1,21 – 2,2. Про посилену кислотопродукцію (гіперацидність) свідчить рН у базальну фазу 1,5 і нижче та 1,2 і нижче в стимульовану фазу. Відповідно, рН 2,1 – 5,9 базального секрету та рН 2,3 – 3 стимульованого секрету відповідають гіпоацидності, а рН вище 6 і 5 – анацидності (відсутності хлоридної кислоти).
Таблиця 10.2.Склад шлункового соку за умов норми та при деяких патологічних станах
| Стан | рН | Кислотність | Пепсин | Фактор Касла | Лактат | Кров | ||
| Загальна | Зв’язана НСl | Вільна НСl | ||||||
| Норма | 1,5 – 2,0 | 40 – 60 | 20 – 30 | 20 – 40 | + | + | - | - |
| Гіперацидний гастрит | 1,0 | + | ± | - | - | |||
| Гіпоацидний гастрит | 2,5 | ± | ± | ± | - | |||
| Ахілія | 6 і > | - | - | - | + | - | ||
| Виразка шлунка | 1,5 | + | + | - | + | |||
| Рак шлунка | 6 і > | 40 – 60 | + | + | + | + |
Як видно з таблиці 10.2, одночасно з нормальними складовими частинами при деяких захворюваннях у шлунковому соку можуть міститися й інші речовини: молочна кислота (утворюється при молочнокислому бродінні в застійному шлунковому вмісті при відсутності вільної НСІ, а також як продукт метаболізму ракових клітин); кров (може потрапляти в шлунковий сік при кровотечі із стінок шлунка, стравохода, при легеневих кровотечах, екстракції зуба тощо); леткі жирні кислоти (ацетатна, масляна - можуть утворюватися при ахлоргідрії); жовчні пігменти (білірубін, білівердин) можуть потрапляти в шлунок із дванадцятипалої кишки внаслідок дуодено-гастрального рефлюксу). У клініці часто визначають ці речовини з діагностичною метою за допомогою спеціальних реакцій.
10.2.2. Травлення білків у тонкій кишці.Суміш високомолекулярних поліпептидів, що не розщепилися в шлунку, надходить у тонку кишку, де під дією підшлункового та кишкового соків у слаболужному середовищі (рН 7 – 8) відбувається наступний етап ферментативного розщеплення білків.
До складу соку підшлункової залози входять різні ферменти (протеолітичні, гліколітичні та лі політичні), протеолітичні, зокрема, представлені трипсиногеном, хімотрипсиногеном, прокарбоксипептидазами А і В, проеластазою тощо. Шляхом обмеженого протеолізу вони перетворюються на активні форми – трипсин, хімотрипсин, карбоксипептидази та еластазу відповідно.
Виділення протеолітичних ферментів у неактивній формі має велике біологічне значення, оскільки сік підшлункової залози містить ще низку інших ферментів (ліпазу, амілазу тощо), які мають білкову природу. Присутність активного трипсину разом з цими ферментами призводила б доїх руйнування ще в підшлунковій залозі. Крім того, у клітинах підшлункової залози міститься інгібітор трипсину, який у випадку передчасної активації фермента утворює з ним міцний комплекс. Вважають, що здатність шлунка та кишки протидіяти пепсину і трипсину, зумовлена крім наявності муцину ще й тим, що в слизовій оболонці цих органів є антиферменти — антипепсин або антитрипсин, які гальмують дію відповідних ферментів.
Надходження кислого хімуса з шлунка в 12-палу кишку стимулює виділення її слизовою оболонкою фермента ентерокінази,який шляхом відщеплення від N-кінця молекули трипсиногену гексапептиду перетворює його на активний трипсин (249 амінокислотних залишків). Дія ентерокінази проявляється на початковій стадії активації трипсиногену, після чого включається автокаталітичний механізм, при якому утворений трипсин сам активує перетворення трипсиногену на активну форму.
Трипсин, своєю чергою, активує інші протеолітичні ферменти. Так, під впливом трипсину неактивний хімотрипсиноген перетворюється на кілька активних ферментів: спочатку утворюється активний p-хімотрипсин, далі - d-хімотрипсин і в кінцевому результаті – стабільна форма активного фермента - a-хімотрипсин, який складається з трьох поліпептидних ланцюгів, з’єднаних дисульфідними містками.
Кожен з протеолітичних ферментів підшлункової залози володіє специфічністю (рис. 10.3).
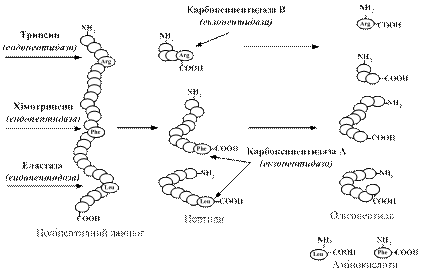
Рис. 10.3. Схема розщеплення білків протеолітичними ферментами підшлункової залози
Трипсин розщеплює пептидні зв'язки, утворені карбоксильними групами аргініну та лізину з утворенням поліпептидів і невеликої кількості вільних амінокислот. Хімотрипсингідролізує пептидні зв'язки, утворені карбоксильними групами тирозину, фенілаланіну, триптофану і метіоніну, що призводить до утворення різної величини пептидів і незначної кількості амінокислот. Цей фермент володіє більшою субстратною специфічністю порівняно з трипсином, він каталізує гідроліз не лише пептидів, а й ефірів, амідів і інших ацилпохідних. Карбоксипентидази А і В (Zn-вмісні ферменти) відщеплюють С-кінцеві залишки амінокислот: карбоангідраза А гідролізує пептидні зв’язки ароматичних та аліфатичних амінокислот, карбоксипентидаза В діє на пептиди, що мають С- кінцеві залишки аргініну та лізину. Еластазарозриває пептидні зв’язки між залишками нейтральних амінокислот, найактивніша у відношенні еластину.
Підшлункова залоза також секретує колагеназу – протеїназу, що розщеплює пептидні зв’язки в молекулі колагену (рН оптимум 7 – 9); еластомукопротеїназу та колагенмукопротеїназу, які розщеплюють мукопротеїни (рН оптимум 7 – 9); ендонуклеази: РНКаза діє на складноефірні зв’язки між фосфатною кислотою та 5-гідроксильним кінцем фосфодіефірного містка в молекулі РНК; ДНКаза діє на складноефірні зв’язки між 3-гідроксильним кінцем і фосфатною кислотою в молекулі ДНК; калікреїн виділяється підшлунковою залозою у вигляді прокалікреїну, активується трипсином.
Процес розпаду (гідролізу) білків закінчується за участі ферментів тонкої кишки, завдяки яким низькомолекулярні пептиди розщеплюються до амінокислот (табл. 10.3).
Таблиця 10.3. Протеолітичні ферменти тонкої кишки
| Амінопептидази | |
| Аланінамінопептидаза Лейцинамінопептидаза | відщеплюють з N-кінця пептиду аланін і лейцин відповідно |
| Дипептидази | |
| Гліцигліциндипептидаза Пролілдипептидаза Проліндипептидаза | розщеплює дипептид до 2-х молекул гліцину каталізує гідроліз пептидного зв’язку, в утворенні якого бере участь СООН-група проліну гідролізує дипептиди, у котрих азот проліну зв’язаний кислотно-амідним зв’язком |
Таким чином, внаслідок послідовної дії протеолітичних ферментів травного тракту білки, які надходять з різними харчовими продуктами, розщеплюються до структурних компонентів - амінокислот, які підлягають всмоктуванню.
10.2.3. Біохімічні механізми всмоктування амінокислот.Амінокислоти, що вивільняються під час гідролізу білків, швидко всмоктуються у мікроворсинках тонкої кишки. Цей процес може відбуватися шляхом ко-транспорту або за допомогою специфічного g-глутамільного циклу.
Ко-транспорт амінокислот через апікальну мембрану ентероцита – це вторинно-активний процес, який вимагає затрат енергії і здійснюється за допомогою низки спеціальних білків-перносників: нейтральних з коротким вуглецевим ланцюгом (аланін, серин, треонін) і довгим або розгалуженим вуглецевим ланцюгом (валін, лейцин, ізолейцин); основних (лізин, аргінін); кислих (глютамінова та аспарагінова кислоти); імінокислот (пролін, оксипролін). Більшість з них функціонують за участі Na+-залежних механізмів симпорту. Іони натрію входять всередину клітини разом з амінокислотами, потім відкачується з цитоплазми за допомогою Na+-, K+-АТФази.
У g-глутамільному циклі беруть участь шість ферментів, один з яких – g-глутамілтрансфераза знаходиться в мембрані, а інші – у клітині (рис. 10.4).
Перенесення амінокислот здійснює g-глутамілтрансфераза, кофактором якої є глутатіон:
Ак + глутатіон ® g-глутаміл-Ак + цистеїнілгліцин
 Інші п’ять ферментів циклу забезпечують відщеплення в цитоплазмі клітини амінокислоти від g-глутаміну та ресинтез глутатіону. Транспорт в клітину однієї амінокислоти вимагає затрати трьох молекул АТФ. Дипептиди та негідролізовані білки всмоктуються шляхом піноцитозу і в клітині гідролізуються лізосомальними протеазами.
Інші п’ять ферментів циклу забезпечують відщеплення в цитоплазмі клітини амінокислоти від g-глутаміну та ресинтез глутатіону. Транспорт в клітину однієї амінокислоти вимагає затрати трьох молекул АТФ. Дипептиди та негідролізовані білки всмоктуються шляхом піноцитозу і в клітині гідролізуються лізосомальними протеазами.
З ентероцитів амінокислоти шляхом полегшеної дифузії надходять у кровоносні капіляри, звідки через систему ворітної вени потрапляють у печінку та загальний кровоплин.
10.2.4. Гниття білків у товстій кишці. Деяка частина тих амінокислот, які не всмокталися, використовуються мікрофлорою товстої кишки як джерело живлення. У товсту кишку потрапляє біля 1 % амінокислот. Під впливом мікроорганізмів вони перетворюються шляхом декарбоксилування, дезамінування й окислення з утворенням амінів, жирних кислот, спиртів, фенолів, сірководню, індолу, скатолу тощо. Цей процес отримав назву гниття білків у товстій кишці.
Так, наприклад, триптофан під дією мікроорганізмів перетворюється на скатол та індол — отруйні речовини, які зумовлюють запах калу.

Внаслідок декарбоксилування тирозину утворюється тирамін, який, подібно до адреналіну, підвищує кров'яний тиск, а розпад тираміну призводить до утворення фенолу та крезолу:

З сірковмісних амінокислот — цистину, цистеїну, метіоніну в товстій кишці утворюються гідрогенсульфід, меркаптан, метан тощо.

Слід зазначити, що при гнитті в результаті декарбоксилування діаміномонокарбонових кислот орнітину та лізину утворюються відповідні аміни путресцин і кадаверин, які належать до трупних отрут.


Утворені токсичні речовини (індол, скатол, фенол, крезол тощо) з товстої кишки через систему ворітної вени надходять у печінку, де підлягають знешкодженню (розділ «Біохімія печінки»).
10.2.5. Травлення вуглеводів.Вуглеводи їжі (крохмаль, сахароза, лактоза тощо) під впливом ферментів глікозидаз гідролізуються до моносахаридів, оскільки лише в такому вигляді вони можуть всмоктуватися в ентероцитах тонкої кишки. Проте початковий етап перетравлення вуглеводів відбувається в порожнині рота.
У слині міститься фермент a-амілаза (a-1,4-глікозидаза), яка розщеплює a-1,4-глікозидні зв’язки в молекулі крохмалю. Але оскільки в порожнині рота їжа знаходиться недовго, тому крохмаль гідролізується частково з утворенням великих фрагментів – декстринів і невеликої кількості мальтози. Амілаза слини не розщеплює a-1,6-глікозидні зв’язки і не гідролізує дисахариди.
у кислому середовищі шлунка (рН 1,5 – 2,5) дія амілази слини призупиняється. Однак всередині харчової грудки її активність може деякий час зберігатися. Шлунковий сік не містить ферментів, що розщеплюють вуглеводи.
 У дванадцятипалій кишці рН середовища шлункового вмісту нейтралізується секретом підшлункової залози, рН якого становить 7,0 – 8,0 за рахунок наявності в ньому бікарбонатів (НСО3-). Із секретом підшлункової залози в тонку кишку поступає панкреатична α–амілаза. Цей фермент гідролізує α-1,4-глікозидні зв’язки крохмалю та декстринів з утворенням мальтози, а з залишків глюкози, які знаходяться в молекулі глікогену в місцях розгалуження і з’єднані a-1,6-глікозидним зв’язком, утворюється дисахарид ізомальтоза (рис. 10.5). Крім цього, утворюється деяка кількість олігосахаридів, що містять 3- 8 залишків глюкози, з’єднаних a-1,4- і a-1,6 - зв’язками.
У дванадцятипалій кишці рН середовища шлункового вмісту нейтралізується секретом підшлункової залози, рН якого становить 7,0 – 8,0 за рахунок наявності в ньому бікарбонатів (НСО3-). Із секретом підшлункової залози в тонку кишку поступає панкреатична α–амілаза. Цей фермент гідролізує α-1,4-глікозидні зв’язки крохмалю та декстринів з утворенням мальтози, а з залишків глюкози, які знаходяться в молекулі глікогену в місцях розгалуження і з’єднані a-1,6-глікозидним зв’язком, утворюється дисахарид ізомальтоза (рис. 10.5). Крім цього, утворюється деяка кількість олігосахаридів, що містять 3- 8 залишків глюкози, з’єднаних a-1,4- і a-1,6 - зв’язками.
a-Амілаза підшлункової залози, так само як і a-амілаза слини належить до ендоглікозидаз, тому не розщеплює a-1,6-глікозидні зв'язки в крохмалі, а також β-1,4-глікозидні зв'язки у молекулах целюлози. Остання проходить через кишку в незміненому стані, виконуючи попри те низку важливих функцій: збільшує об'єм їжі, бере участь у формуванні калових мас і позитивно впливає на процес травлення. Її частковий гідроліз з утворенням спиртів, органічних кислот та вуглекислого газу відбувається в товстій кишці під впливом ферментів мікрофлори.
Травлення мальтози, ізомальтози, сахарози, лактози та олігосахаридів відбувається під дією специфічних ферментів, їх активність у просвіті кишки дуже низька, проте вони активно діють на поверхні епітеліальних клітин кишки, утворюючи ферментативні комплекси. Так, сахаразо-ізомальтазний комплекс гідролізує сахарозу, ізомальтозу, мальтозу та мальтотріозу, розщеплюючи α-1,2-, і α-1,4- та α-1,6- глікозидні зв'язки. На цей комплекс припадає 80 % від всієї мальтазної активності кишки.
Глікоамілазний комплекс каталізує гідроліз α-1,4-глікозидних зв'язків між залишками глюкози в олігосахаридах, за механізмом дії цей фермент належить до екзоглікозидаз. Комплекс також розщеплює зв’язки в мальтозі, діючи як мальтаза.
β-Глікозидазний комплекс (лактаза) розщеплює β-1,4-глікозидні зв'язки між галактозою та глюкозою в лактозі. Активність цього ферменту коливається в залежності від віку. Так, у плода вона особливо активна в пізні терміни вагітності та зберігається на високому рівні до 5-7-річного віку, потім активність ферменту знижується і становить 10 % від рівня активності, характерного для дітей.
Глікозидні зв’язки між мономерами трегалози – дисахариду грибів – гідролізує трегалазний комплекс.
Узгоджена спільна дія всіх перерахованих ферментів забезпечує травлення харчових оліго- і полісахаридів з утворенням моносахаридів (фруктози, галактози, манози, ксилоли, арабінози), основним з яких є глюкоза.
Моносахариди з порожнини кишки проникають у епітеліоцити тонкої кишки або шляхом полегшеної дифузії за участі спеціальних переносників або шляхом активного транспорту (ко-транспорту) за рахунок градієнта концентрації іонів натрію, який створюється Na+-, K+-АТФазою. Глюкоза та іони Na+ поступають у клітину за градієнтом концентрації і одночасно глюкоза транспортується проти градієнта концентрації (вторинно активний транспорт). Відповідно, чим більший градієнт іонів Na+, тим більше поступлення глюкози в ентероцити. Якщо концентрація Na+ у позаклітинній рідині зменшується, транспорт глюкози знижується. Такий транспорт характерний і для галактози.
Цей механізм забезпечує перенесення моносахаридів проти градієнта концентрації і тому може функціонувати тоді, коли концентрація глюкози або галактози в кишці невелика.
Якщо концентрація глюкози або фруктози в просвіті кишки велика, то вона може транспортуватися в клітину шляхом полегшеної дифузії.
з епітеліальних клітин моносахариди проникають у кров шляхом полегшеної дифузії за допомогою спеціальних білків-переносників (транспортерів), далі через ворітну вену вони надходять у печінку, де значна частина глюкози перетворюється на глікоген, решта глюкози поступає в клітини інших органів (табл.. 10.4).
Таблиця 10.4.Локалізація білків-транспортерів для глюкози (ГЛЮТ)
| Тип ГЛЮТ | Локалізація в органах |
| ГЛЮТ-1 | Мозок, плацента, нирки, товста кишка |
| ГЛЮТ-2 | Печінка, нирки, β-клітини підшлункової залози, ентероцити |
| ГЛЮТ-3 | Мозок, плацента, нирки |
| ГЛЮТ-4 | М’язи (у тому числі міокард), жирова тканина |
| ГЛЮТ-5 | Тонка кишка |
Усі типи ГЛЮТ можуть локалізуватися як у плазматичній мембрані, так і в цитозольних везикулах. ГЛЮТ-4 (меншою мірою ГЛЮТ-1) майже повністю знаходиться в цитоплазмі клтин. Вплив інсуліну на ці клітини призводить до переміщення везикул, які містять транспортер, до плазматичної мембрани, злиття з нею та вcмоктування транспортера в мембрану. Після цього відбувається полегшений транспорт глюкози в ці клітини. Зниження концентрації інсуліну в крові сприяє переміщенню транспортерів в цитоплазму, внаслідок чого надходження глюкози в клітини припиняється.
10.2.5.1. Порушення травлення та всмоктування вуглеводів.Дефекти ферментів, які беруть участь у гідролізі вуглеводів у тонкій кишці або порушення всмоктування продуктів гідролізу вуглеводів в ентероцити можуть стати причиною розвитку низки патологій, які супроводжуються осмотичною діареєю. Неперетравлені в тонкій кишці вуглеводи поступають у просвіт товстої кишки, де підлягають ферментативному гідролізу мікроорганізмами з утворенням органічних кислот і газів. Ці порушення призводять до притоку води в кишку, збільшення об’єму її вмісту, посилення перистальтики, спазмів, болю, метеоризму.
Недостатня активність дисахаридаз або всього ферментативного комплексу лежить в основі порушення перетравлення вуглеводів. Спадкові форми недостатньої активності ферментів виявляють достатньо рано, наприклад, вже після першого годування грудним молоком (при недостатності лактази), після переходу на штучне вигодовування (при недостатності a-амілази чи специфічних дисахаридаз).
Так, при дефіциті лактази кишковий сік втрачає здатність розщеплювати молочний цукор. Ця патологія успадковується як аутосомно-рецесивним типом, особливо часто зустрічається в мешканців східних країн та населення Північної Америки. Первинну лактазну недостатність поділяють на 2 типи: природжену, яку спостерігають у грудних дітей, і лактазну недостатність (пізній тип), яка проявляється після 4-5 років. Основним клінічним проявом недостатності лактази є проноси через 1 – 2 години після вживання в їжу молока.
Крім природженої лактазної недостатності, існують і вторинні, набуті форми дефіциту лактази, які зустрічаються при інфекційних захворюваннях (дизентерія), опроміненні тощо.
Дефіцит сахарази зустрічається рідше, ніж дефіцит лактази, успадковується за аутосомно-рецесивним типом і характеризується порушенням пристінкового гідролізу сахарози на глюкозу та фруктозу. Ця патологія ускладнюється дегідратацією, підвищенням температури тіла та колапсом.
Недостатність сахарази може комбінуватися з недостатністю ізомальтази та мальтази, вкрай рідко зустрічається недостатність трегалази, яка проявляється диспепсичними явищами після вживання грибів.
Порушення всмоктування моносахаридів здебільшого є наслідком дефекту чи недостатності компонентів транспортної системи моносахаридів через мембрану.
Так, причиноюпорушення всмоктування глюкози та галактозиє мутація загального транспортного білка для глюкози і галактози у слизистій оболонці кишки і проксимальних ниркових канальцях. Захворювання виявляється діареєю після вживання вуглеводів, що містять глюкозу, галактозу, лактозу або сахарозу. Фруктоза при цьому засвоюється добре. Аналогічні порушення виникають при пошкодженні транспортних систем різними чинниками, дефекті Na+, К+-АТФази, дії інгібіторів і зменшенні продукції АТФ.
10.2.6. Перетравлення ліпідів.У слині присутня лінгвальна ліпаза, яка синтезується залозами, розташованими на спинці язика і яка відносно стійка в кислому середовищі шлункового соку, тому впродовж 1 – 2 год діє на жири їжі в шлунку. Особливістю гідролізу жирів у дітей грудного та молодшого віку є те, що в них активна шлункова ліпаза, яка діє при нейтральному значенні рН, характерному для шлункового соку дітей такого віку. Цей фермент гідролізує жири, відщеплюючи, в основному, жирні кислоти біля третього атома вуглецю гліцеролу. Далі процес гідролізу відбувається вже в тонкій кишці.
У дорослої людини в шлунку спостерігається часткове руйнування ліпопротеїнових комплексів мембран клітин їжі, що робить жири доступнішими для подальшої дії на них ліпази панкреатичного соку.
Після того, як хімус потрапляє в дванадцятипалу кишку, відбувається нейтралізація хлоридної кислоти панкреатичним і кишковим соками і розпад бікарбонатів, після чого пухирці утвореного вуглекислого газу сприяють доброму змішуванню харчової кашки з травними соками. Основний процес розщеплення жирів відбувається переважно у верхніх відділах тонкої кишки, де є умови для емульгування жирів (змішування води та жиру).
Цей процес відбувається за участі жовчних кислот, які потрапляють у кишку в складі жовчі у вигляді солей або кон¢югованих сполук із гліцином і таурином (при вживанні вуглеводної їжі переважають гліцинові кон¢юганти, а при споживанні білкової – тауринові). Жовчні кислоти є кінцевими продуктами обміну холестерину, похідними холанової кислоти (див. розділ 5). До складу жовчі людини входять, в основному, холева, дезоксихолева, хенодезоксихолева кислоти.
Ці сполуки діють як детергенти, розташовуючись на поверхні крапель жиру та знижуючи їх поверхневий натяг, внаслідок чого великі краплі жиру розпадаються на велику кількість дрібних. Це призводить до збільшення площі поверхні розмежування фаз жир/вода, що сприяє прискоренню гідролізу жиру панкреатичною ліпазою. Емульгуванню жирів сприяють також перистальтика кишок, білки, СО2 і моноацилгліцероли.
Жовчні кислоти, з¢єднавшись згодом із жирними кислотами в місці їх гідролізу, утворюють комплекси, які називають холеїновими. Такі комплекси всмоктуються через мембрани епітеліальних клітин тонкої кишки і розщеплюються у них на складові частини.
Після емульгування гідроліз тригліцеридів до гліцерину і жирних кислот здійснює панкреатична ліпаза; складні ліпіди підлягають впливу фосфоліпаз (А1, А2, С, Д) і розщеплюються до гліцерину, вищих жирних кислот, азотистих основ і фосфорної кислоти; ефіри холестерину розщеплюються до нерозчинного холестерину та жирних кислот за участі ферменту холестеролестерази (рис. 10.6).

Рис. 10.6. Схема поступлення екзогенних жирів у тканини організму
Активне функціонування панкреатичної ліпази реалізується при рн панкреатичного соку 7,5 – 8,0 та наявності жовчних кислот. Процес взаємодії ліпази з поверхнею розподілу фаз у системі жовчнокисла сіль/триацилгліцерол потребує додаткового фактора – білка коліпази, що міститься у секреті підшлункової залози. Коліпаза потрапляє в порожнину тонкої кишки в неактивному стані і активується шляхом часткового протеолізу під впливом трипсину. Її роль полягає у зв’язуванні своїм гідрофобним доменом з поверхнею міцели емульсованого жиру. Інша частина молекули коліпази сприяє формуванню такої конформації панкреатичної ліпази, при якій активний центр фермента максимально наближений до субстратів – молекул жиру. Панкреатична ліпаза гідролізує жири в положеннях 1 і 3, тому основними продуктами гідролізу є 2-моноацилгліцероли (b-моноацилгліцероли) та вільні жирні кислоти.
Гідроліз фосфоліпідів (гліцеролфосфоліпідів) каталізується фосфоліпазою А2, яка синтезується у підшлунковій залозі у вигляді проферменту та перетворюється на активну форму шляхом гідролізу певних пептидних зв'язків у молекулі каталітично неактивного білка. Цей фермент гідролізує складноефірні зв'язки в положенні - 2 фосфогліцеридів з утворенням лізофосфоліпідів. Інші фосфоліпази, що містяться в кишковому соку, розщеплюють гліцерофосфоліпіди до гліцеролу, вищих жирних кислот, азoтистих основ та фосфатної кислоти.
Гідроліз ефірів холестеринувідбувається під впливом холестеролестерази (гідролази холестеринових ефірів) з утворенням холестеролу, який всмоктується в складі міцел.
Продукти гідролізу ліпідів – жирні кислоти з довгим вуглецевим радикалом, 2-моноацилгліцероли, холестерол, а також солі жовчних кислот утворюють у просвіті кишки змішані міцели, особливість будови яких полягає в тому, що гідрофобні частини молекул повернуті всередину міцел, а гідрофільні – назовні, тому міцели добре розчиняються в водній фазі вмісту тонкої кишки. Ці структури дифундують через мембрани всередину клітин слизової оболонки тонкої кишки. Разом з ними всмоктуються жиророзчинні вітаміни та солі жовчних кислот. Останні транспортуються через ворітну вену в печінку, з печінки – знову в жовчний міхур, тонку кишку, де знову беруть участь в емульгуванні жирів (процес ентерогепатичної циркуляції). Кожна молекула жовчних кислот за добу проходить 5 – 8 таких циклів, лише 5 % жовчних кислот виділяється в складі калу.
У клітинах слизової оболонки тонкої кишки жирні кислоти з довгим вуглецевим ланцюгом та 2-моноацилгліцероли включаються в процес ресинтезу з утворенням триацилгліцеролів (фермент ацилтрансфераза), причому жирні кислоти вступають у реакцію естерифікації лише в активній формі (активування відбувається за участі фермента тіокінази). Одночасно відбувається активний синтез гліцерофосфоліпідів, необхідних для формування транспортних форм ліпідів. Взаємодіючи з ацил-КоА, молекули холестеролу перетворюються на його ефіри (фермент ацилхолестеролацилтрансфераза (АХАТ)). З триацилгліцеролів, гліцерофосфоліпідів, ефірів холестеролу, жиророзчинних вітамінів, що поступають у складі їжі, формуються ліпопротеїнові комплекси – хіломікрони (ХМ), у складі яких ліпіди потрапляють у периферійні тканини. ХМ мають достатньо великі розміри, тому після приймання жирної їжі плазма на кілька годин (до утилізації жиру тканинами) набуває молочного кольору.
Порушення гідролізу та всмоктування харчових ліпідів супроводжується розвитком стеатореї - наявності збільшеної кількості жирів у калових масах (див. нижче).
Всмоктування жирів гальмується при ураженні епітелію тонкої кишки інфекційними та токсичними агентами, авітамінозі (через порушене утворення ферментів, що беруть участь у ресинтезі триацилгліцеролів).
10.2.7. Регуляція травлення.Гормональна регуляція функцій органів травної системи здійснюється за участю різних за своїм походженням речовин: гіпоталамічними гормонами гормонами кори надниркових, статевих залоз, а також гормонами гастроентеропанкреатичної системи. Останні належать до гормоноподібних речовин, що утворюються у клітинах травного тракту (слизова оболонка шлунка, кишок та підшлункова залоза) і мають пептидну природу (табл.10.5). Більшість з них за механізмом дії належать до істинних гормонів (гастрит, секретин, холецистокінін, мотилін, панкреатичний поліпептид, ентероглюкагон, шлунковий інгібувальний пептид), а інші володіють паракринною чи нейроендокринною дією (вазоактивний інтестинальний пептид, соматостатин). Виділення цих регуляторів відбувається під дією їжі і визначається її складом.
Таблиця 10.5. Регулятори травлення та їх характеристика
| Регулятор | Місце утворення | Ефект |
| Гістамін | ЕСL-клітини шлунка | Стимулює виділення НСl і, меншою мірою, пепсиногену в шлунку, посилює моторику шлунка, мiкроциркуляцію та проникнiсть судин |
| Гастрин | G-клітини шлунка | Стимулює виділення НСl і пепсиногену в шлунку, посилює виділення слизу та ПГ Е, гальмує евакуацію шлункового вмісту в тонку кишку; збільшує секрецію секретину, холецистокініну, соматостатину, кишкових і панкреатичних ферментів |
| Бомбезин, гастрин вивiльняючий гормон | Р-клітини шлунка, тонкої кишки | Збiльшує концен трацiю гастрину в кровi, стимулює видiлення кислоти, моторику шлунка, секрецiю пiдшлун-кової залози, посилює виділення ентероглюкагону, нейронзину та панкреатичного поліпептиду |
| Соматостатин | D-клiтини шлунка, пiдшлункової залози, тонкої кишки | Гальмує секрецiю шлункового соку, знижує секрецiю та синтез деякиx гормонiв гiпофiза та майже всix гормонiв травної системи, знижує пролiферацiю клiтин шлунка |
| Грелін «Гормон голоду» | Р/D1-клітини шлунка | активує клітини в дугоподібному ядрі, котрі збуджують апетит |
| Ентерогастрон | Слизова оболонка тонкої кишки | Гальмує секрецію НСl і пепсиногену в шлунку |
| Секретин | S-клітини тонкої кишки | Стимулює продукцію рідкої частини панкреатичного соку, збагаченого водою, гідрокарбонатами але не ферментами, стимулює жовчоутворення в печінці, інгібує секрецію НСl |
| Нейротензин | N-клiтини тонкої кишки | Гальмує секрецiю шлунка та стимулює секрецію бiкарбонатiв підшлунковою залозою, стимулює секрецію соку тонкої кишки; стимулює шлункову i кишкову моторику, поглинання i зберiгання поживниx речовин жировою тканиною |
| Холецистокінін – панкреозимін | І-клітини проксимального відділу тонкої кишки | Стимулює продукцію підшлункового соку, збагаченого ферментами і скорочення жовчного міхура, інгібує секрецію НСl |
| Хімоденін | тонка кишка | Стимулює секрецію білків і особливо хімотрипсиногену в підшлунковій залозі |
| Ентерокринін | Тонка кишка | Стимулює секрецію залоз тонкої кишки |
| Вілікінін | Слизова оболонка тонкої кишки | Стимулює рух ворсинок тонкої кишки і тим самим сприяє пересуванню їжі |
| Шлунковий інгібувальний пептид (глюкозозалежий інсулінотропний пептид) | К–клітини 12- палої, порожньої та товстої кишок | Гальмує секреторну та моторну функцію шлунка, інгібує абсорбцію жирів, реабсорбцію натрію і води в травному тракті, інгібує ліпопротеїнліпазу |
| Пептид YY | L-клітини клубової та товстої кишок | Сповільнює секрецію шлункового, підшлункового соків і жовчі, сприяє тривалішому перебуванню їжі в кишці, пригнічує апетит |
| Вазоактивний інтестинальний пептид | D1-клітини тонкої кишки | Стимулює кровотік і перистальтику кишок, інгібує секрецію НСl парієнтальними клітинами шлунка, стимулює секрецію пепсиногену головними клітинами шлунка |
| Речовина Р | ЕСl-клітини шлунка та 12-палої кишки | Посилює моторику стравохода, шлунка, тонкої та товстої кишок, стимулює панкреатичну секрецію та секрецію слинних залоз, інгібує секрецію жовчі та соматостатину |
| Глюкагоноподібний пептид-1 | L-клітини клубової та товстої кишок | Гальмує секрецію НСl, соматостатину та глюкагону, послаблює моторну активність |
| Секретин | S-клітини проксимального відділу тонкої кишки | Посилює секрецію бікарбонатів і води у клітинах проток підшлункової залози та біліарного тракту, гальмує секрецію НСl. |
| Мотилін | ЕСl-клітинами і М-клітини шлунка, тонкої та ободової кишки | Викликає скорочення гладких м’язів шлунка і кишки |
| Панкреатичний поліпептид | РР-клітини острівців лангернанса підшлункової залози | Антагоніст холецистокініну: пригнічує секрецію підшлункової залози та стимулює секрецію шлункового соку |
| Енкефаліни, ендорфіни | G-клітини тонкої кишки | Гальмують секрецiю бікарбонатів, а також секрецію ферментів підшлунковою залозою, мають цитопротективну дію і запобігають діареї |
Регуляторна дія цих гормонів пов’язана з їх вивільненням у внутрішнє середовище через базолатеральну поверхню мембрани клітини. З міжклітинної рідини вони потрапляють у кров і виказують специфічний ефект. Механізми дії цих гормонів вивчені недостатньо. На ацинарних клітинах підшлункової залози ідентифіковано 6 різних класів рецепторів. для сімейства гастрину вони функціонують за участі інозитольної системи, тоді як рецептори секретину – компоненти аденілатциклазної системи.
Гормони цієї системи не лише беруть участь у регуляції секреції, моторики, всмоктування, трофіки, вивільнення інших регуляторних пептидів, а також чинять загальні ефекти: впливають на діяльність серцево-судинної та ендокринної систем та на метаболізм в цілому.