Список рекомендованих джерел
МВ 02070855-1182-2003
Івано-Франківськ
МВ 02070855-1182-2003
Михайлів Н.П. Матеріалознавство. Лабораторний практикум. - Івано-Франківськ: Факел, 2003.-118 с.
Лабораторний практикум підготовлено для студентів всіх технічних спеціальностей денної та заочної форм навчання, які вивчають курс “Матеріалознавство” згідно з навчальними та робочими програмами.
Рецензент доктор.техн.наук, професор Мельник П. І.
ã Дане видання — власність ІФНТУНГ. Забороняється тиражування та розповсюдження.
МВ 02070855-1182-2003
Михайлів Н.П. Матеріалознавство. Лабораторний практикум. - Івано-Франківськ: Факел, 2003.- 118с.
Лабораторний практикум підготовлено для студентів всіх технічних спеціальностей денної та заочної форм навчання, які вивчають курс “Матеріалознавство” згідно з навчальними та робочими програмами.
Рецензент доктор.техн.наук, професор Мельник П. І.
Відповідальний за випуск зав. кафедри
зносостійкості та відновлення деталей
доктор технічних наук, професор Криль Я. А.
Нормоконтролер Гургула О. Г.
Коректор Будуйкевич Н.Ф.
Голова експертно – рецензійної
колегії університету Костриба І. В.
© Дане видання — власність ІФНТУНГ. Забороняється тиражування та розповсюдження.
Зміст
1 Дослідження процесу кристалізації …………………...…...4
2 Макроскопічний метод дослідження металів і сплавів .... 11
3 Мікроскопічний метод дослідження металів і сплавів ....15
4 Визначення твердості металів ………………………….....22
5 Діаграма стану двокомпонентних сплавів ......................... 29
6 Діаграма стану залізо-вуглець .............................................42
7 Перетворення в залізовуглецевих сплавах
при нагріванні і охолодженні ..............................................48
8 Вивчення структури і властивостей
вуглецевих сталей .................................................................54
9 Вивчення структури і властивостей чавунів ......................59
10 Гартування cталей ................................................................ 65
11 Відпускання загартованої сталі ...........................................75
12 Вивчення структури і властивостей сталей після поверхневого зміцнення методом хіміко-термічної обробки ............80
13 Вивчення структури і властивостей легованих сталей .....88
14 Структура і будова сплавів на основі міді .........................94
15 Структура і властивості сплавів на основі алюмінію .......98
16 Структура і властивості антифрикційних сплавів ...........102
17 Структура і властивості фрикційних матеріалів ............. 107
18 Структура і властивості композиційних матеріалів ........110
Додатки.......................................................................................114
Робота №1
Дослідження процесу кристалізації
Мета роботи
1.1 Ознайомитись з процесом кристалізації і формою кристалів, які утворюються при кристалізації розчину солей.
1.2 Ознайомитись з будовою стального виливка.
2 Технічні засоби навчання
2.1 Насичені розчини солей: хлористого амонію NH4Cl, біхромату калію K2Cr2O7, алюмокалієвого галуну (KAlSO4)·12H2O.
2.2 Мікроскоп біологічний.
2.3 Скляні пластинки, електроплитка, піпетка.
3 Теоретичні відомості
Перехід речовини з рідкого агрегатного стану в твердий при охолодженні відбувається за двома основними схемами: аморфитизація і кристалізація. Аморфитизація забезпечує лише формування ближнього порядку розташування атомів і такі речовини називаються аморфними. Кристалізація забезпечує як ближній порядок, так і дальній порядок розташування атомів і такі речовини називаються кристалічними. Вони можуть бути як чистими хімічними елементами, так і хімічними, чи електронними сполуками, а також твердими розчинами.
Кристалізацією називають процес переходу металу із рідкого стану в твердий кристалічний.
Причиною кристалізації або перекристалізації (зміни фазового стану) є природне намагання системи зайняти такий стан, при якому запас її вільної енергії є мінімальним. Це положення добре ілюструється характером зміни вільної енергії системи, наведеним на рисунку 1.1.
Термодинамічно це записується як різниця між значенням повної енергії та енергії при певній температурі:
G=E – TS,
де E – повна енергія системи;
G – вільна енергія;
Т – температура;
S – ентропія (міра безпорядку системи).
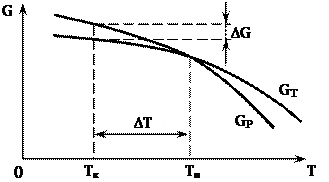

Рисунок 1.1 – Зміна вільної енергії металу в рідкому GР та твердому GТ станах залежно від температури (Tк – температура, при якій протікає кристалізація)
При температурі Тп рідка і тверда фази знаходяться в термодинамічній рівновазі, тому процесу кристалізації не відбувається, бо центри кристалізації, які виникли спонтанно так само спонтанно розчиняються в рідині. Тому температура в точці Тпл є теоретичною температурою кристалізації (або плавлення при нагріві).
Для протікання процесу кристалізації необхідно, щоб вільна енергія твердого стану була меншою, ніж рідини. Це є можливим при переохолодженні до температури нижче теоретичної температури кристалізації. Тоді різниця вільних енергій металу в рідкому і твердому стані рівна:
G=GР-GT>0.
Різниця між теоретичною і дійсною температурою кристалізації називається ступенем переохолодження
Т=Тп – Тк
Із збільшенням ступеню переохолодження збільшується різниця вільних енергій твердого і рідкого стану, а тому повинна рости швидкість процесу кристалізації. Але процес кристалізації зв’язаний з переміщенням атомів металу і залежить від швидкості дифузії. Збільшення швидкості переохолодження зменшує швидкість дифузії, а відповідно гальмує ріст кристалів.
Як відомо, кристалізація складається з двох процесів: утворення зародків (центрів кристалізації) та росту кристалів з цих центрів. Обидва процеси характеризуються власними швидкостями, які становлять параметри кристалізації.
Першим параметром кристалізації є швидкість утворення зародків (n), яка характеризує кількість зародків, що утворюються в одиниці об’єму за одиницю часу і вимірюється в см-1/с-1. Другий параметр (с) – лінійна швидкість росту кристалів – характеризує зміну лінійних розмірів кристала і вимірюється в см/с. Досліджуючи кристалізацію прозорих органічних речовин при різних температурах, Г.Таман встановив, що ці параметри залежать від ступеню переохолодження (рисунок 1.2).
Як видно з рисунка 1.2 із збільшенням ступеню переохолодження значення сі n зростають, досягають максимума, а потім понижуються і при великих ступенях переохолодження практично падають до нуля.
Слід звернути увагу на те, що швидкість утворення зародків (їх число) зростає повільніше ніж швидкість росту кристалів. Таким чином співвідношення між параметрами n і с при різних ступенях переохолодження різне. А від співвідношення параметрів n і с залежать розміри зерен в металах.
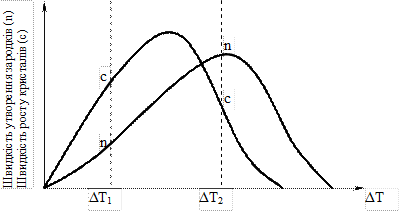
Рисунок 1.2– Залежність швидкості утворення зародків кристалізації і швидкості росту кристалів від ступеню переохолодження
За теорією Тамана кількість зерен N пропорційна швидкості утворення центрів кристалізації n і обернено пропорційна швидкості росту кристалів с:
N=k·n/c,
де k – сталий коефіцієнт.
Підбираючи ступінь переохолодження можна регулювати величину зерна в металі. При малих ступенях переохолодження (наприклад при Т1, рисунок 1.2) виникає мало центрів кристалізації, а швидкість росту кристала велика, внаслідок чого формується грубозерниста структура. У випадку, коли швидкість утворення зародків велика, а швидкість росту кристала мала (наприклад при Т2, рисунок 1.2) формується дрібнозерниста структура. Надто великі ступені переохолодження можуть взагалі загальмувати виникнення центрів кристалізації і тоді метал переходить у твердий аморфний стан.
Розмір зерна впливає на механічні та інші властивості металів. Дрібнозернистий метал має більшу міцність, в’язкість і пластичність.
Розрізняють дві форми кристалізації: нормальна і дендритна (деревоподібна). При нормальній формі кристалізації кристал зростає за рахунок нашарування атомних площин на гранях кристала приблизно рівномірно з усіх сторін, в результаті чого утворюється геометрично правильний кристал (рисунок 1.3, а, б).
При дендритній кристалізації ріст кристала йде в певних напрямках, які звуться вісями кристалів. Спочатку утворюється вісь першого порядку, потім – другого, третього і т.д. (рисунок 1.3, в).
Поки утворені кристали омиває розплав, вони ростуть вільно і мають більш-менш правильну геометричну форму. Та коли закристалізовуються останні ділянки розплаву, кристали стикаються між собою і втрачають правильну геометричну форму – утворюються кристаліти (зерна).

а,б – нормальна кристалізація; в – дендритна
Рисунок 1.3 – Форма кристалів
В природі переважає дендритна кристалізація. За цією схемою кристалізуються технічні метали і сплави. Форма кристала залежить від швидкості і напрямку відводу тепла при кристалізації рідини, наявності нерозчинних частинок та інших факторів. При направленому відводі тепла виростають витягнуті кристали. В цьому плані характерною є будова металевого виливка (рисунок 1.4).
Усадочна раковина
зона 1- дрібнозерниста
зона 2- стовпчаті кристали
зона 3- рівноосні кристали
зона ліквації
Рисунок 1.4 – Схема будови виливка спокійної сталі
Кристалізація розпочинається на стінках виливниці (форми). При першому дотиканні до стінок виливниці в тонкому шарі рідкого металу виникає різкий градієнт температур і явище переохолодження, яке веде до утворення великої кількості центрів кристалізації. Швидкість росту кристалів в цій зоні невелика (рисунок 1.2), внаслідок чого формується дрібнозерниста структура.
Дальше формується зона витягнутих (стовпчастих) кристалів (зона 2). Після утворення дрібнозернистої зони 1 умови тепловідводу змінюються із-за підвищення температури стінки виливниці та інших причин, градієнт температур в прилягаючому шарі рідкого металу різко зменшується і зменшується ступінь переохолодження. В результаті із невеликого числа центрів кристалізації починають рости нормально орієнтовані до поверхні зони 1 (тобто в напрямку відводу тепла) стовпчасті кристали.
В центрі виникає зона 3, яка складається з великих рівноосних кристалів. Це вказує на те, що в цій зоні виникає мало центрів кристалізації, а швидкість росту кристала досить висока із-за невеликого ступеню переохолодження.
4 Завдання і порядок виконання роботи
4.1 На скляну пластинку за допомогою піпетки нанести краплю перенасиченого розчину солі.
4.2 Помістити пластинку на предметний столик мікроскопа і спостерігати процес кристалізації.
4.3 Проробити пункти 4.1 і 4.2 для кожного розчину солей.
4.4 Зарисувати схематично кристалізаційну картину.
4.5 Зарисувати будову запропонованого виливку металу.
5 Контрольні запитання
5.1 Які процеси лежать в основі кристалізації?
5.2 Які параметри характеризують процеси кристалізації?
5.3 Що таке ступінь переохолодження?
5.4 Як змінюються параметри кристалізації в залежності від ступеню переохолодження?
5.5 Що таке зерно? Яка різниця між зерном і кристалом?
5.6 Від чого залежить розмір зерна?
5.7 Як впливає форма і розмір зерен на механічні властивості металів?
5.8 Пояснити чому на холодному склі утворюється дрібнозерниста структура.
Робота №2
Макроскопічний метод дослідження металів і сплавів
Мета роботи
1.1 Ознайомитись з методикою дослідження структури металів і сплавів за зломом та макрошліфом.
1.2.Ознайомитись з методикою виготовлення макрошліфу.
2 Прилади та технічні засоби навчання
2.1 Заготовки макрошліфів.
2.2 Зразки зломів металів і сплавів.
2.3 Набір шліфувальних шкірок і травників.
2.4 Зразки макрошліфів.
2.5 Лупа.
2.6 Фотопапір, 5% розчин сірчаної кислоти, розчин гіпосульфіту (фіксаж).
3 Методичні вказівки до самостійної роботи
Метод макроаналізу не дає кількісної, а лише якісну оцінку будови і відповідно властивостей матеріалу. Макроаналіз проводиться візуально неозброєним оком або із збільшенням до 50 раз ( розрізна здатність лупи) за зломом поверхні або спеціально виготовленим макрошліфом. Макроаналіз дозволяє визначити:
1. Порушення суцільності металу (усадочна рихлість, флокени, газові пустоти і раковини, тріщини, непровари в зварних з'єднаннях, неметалеві включення і т.п.).
2. Будову сплаву (розмір зерен, їх форму, розташування, дендритну будову виливка та інше ).
3. Хімічну неоднорідність розташування, деяких елементів у сплаві (ліквацію).
4. Будову сплаву, яка утворилась в результаті термічної обробки, наприклад, зону цементації, поверхневого гартування та інше.
5.Будову сплаву, викликану обробкою тиском (волокнистість будови, лінії зсуву в наклепаному металі).
Для дослідження макроструктури використовують метод шліфів і метод зломів. Вид злому досліджують спостереженням, а інші особливості макроструктури – на макрошліфах.
Макроаналіз за зломом. Вивчаючи вигляд злому можливо встановити характер руйнування виробу (крихке, в'язке чи втомне).
В площині злому можуть бути виявлені дефекти, які сприяли руйнуванню металу.
Крихкий злом може бути дрібнозернистим або ж грубозернистим і характеризується кристалічністю без слідів протікання пластичної деформації.
В'язкий злом має характерну волокнисту будову, яка формується в результаті протікання пластичної деформації.
Втомний злом завжди має дві зони руйнування: втомну дрібнозернисту і зону крихкого або в'язкого руйнування в залежності від властивостей матеріалу
Макроаналіз за макрошліфом. За направленням (розташуванням) волокон, які утворились в результаті обробки металу тиском в гарячому стані, можна визначити якій обробці піддавався метал при виготовленні досліджуваного виробу, а також в окремих випадках передбачити надійність експлуатації такого виробу.
Це важливо знати для таких виробів, як колінчасті вали, зубчасті колеса, клапани, гаки підйомних кранів, де потрібно добиватись розташування волокон за профілем деталі.
Макрошліф виготовляють таким чином. З тієї частини деталі або заготовки, яка для конкретного дослідження становить найбільший інтерес вирізують зразок. Вирізування зразка із заготовки або деталі проводиться на металорізальних верстатах, механічною або ручною пилкою по металу, а з матеріалу після термообробки – відрізним наждачним кругом. Щоб не спричинити суттєвих змін у будові металу, потрібно уникати значного нагріву зразка під час вирізування. За допомогою напильника або шліфувального круга, вирівнюють поверхню призначену для макроаналізу.
Отриману таким чином поверхню зразка шліфують на шліфувальних паперах з різною зернистістю абразива механічно або вручну.
Спочатку виконують грубе шліфування на спеціальному абразивному крузі або на спеціальному крупнозернистому шліфувальному папері. Під час щліфування на абразивному крузі необхідно застосовувати інтенсивне охолодження, з метою запобігання термічного впливу на внутрішню будову зразків. Грубе шліфування закінчують після повного вирівнювання всієї поверхні шліфа.
Після грубого шліфування зразок очищують від частинок відокремленого металу та зруйнованого абразива і шліфують на шліфувальному папері з поступовим переходом від паперу з розміром абразивних частинок від 120-100 мкм, до паперу з зернистістю абразива 20-14 мкм. При переході від паперу одного розміру зернистості до іншого необхідно очищувати зразок від абразива та змінювати напрям шліфування на 90о. При ручному шліфуванні шліфувальний папір кладуть на скло або іншу тверду, гладку підкладку.
Після цього зразки промивають водою та просушують. Для визначення дефектів шліф знежирюють та протравлюють.
Визначення ліквації сірки в сталі за макрошліфом проводиться методом Баумана. Полягає він у наступному.
Поверхню шліфа, добре відшліфовану на шліфувальному папері з дрібним зерном, протирають ваткою, змоченою спиртом. Потім бромсрібний фотопапір на світлі змочують і витримують на протязі 5-10 хвилин у 5% -ному водному розчині сірчаної кислоти і злегка підсушують між листами фільтрувального паперу. Після цього фотопапір емульсійною стороною прикладають до приготовленої площини макрошліфа і обережно, недопускаючи зміщення паперу, погладжують гумовим валочком або рукою (в гумовій рукавиці). Через 3-5 хвилин фотопапір промивають у воді і фіксують у гіпосульфіті (20-30 хвилин) і сушать.
Сірка в сталі знаходиться у вигляді сульфіду MnS і рідше у FeS. Сульфіди на поверхні макрошліфа вступають у реакцію із сірчаною кислотою:
MnS + H2SO4 = MnSO4 + H2S
Сірководень, що виділився в результаті реакції, взаємодіє з кристаликами бромистого срібла на фотопапері.
2AgBr + H2S = AgS + 2HBr
Сірчисте срібло на фотопапері утворює темнобурі плями, які свідчать про місця розташування сірки в площині макрошліфа.
4 Завдання і порядок виконання роботи та оформлення звіту
4.1 Описати і замалювати зломи запропонованих зразків.
4.2 Під керівництвом викладача провести аналіз на характер розташування сірки в площині макрошліфа методом Баумана.
4.3 Наклеїти у звіт відбиток макрошліфа і описати його.
5 Контрольні запитання
5.1 Які задачі вирішує макроаналіз:
а) за зломом металу;
б) за макрошліфом?
5.2 Як здійснюється макроаналіз за методом Баумана?
Робота №3
Мікроскопічний метод дослідження металів і сплавів
Мета роботи
1.1 Ознайомитись з будовою та принципом роботи мета-графічного мікроскопа.
1.2 Засвоїти методику приготування шліфів для мікроаналізу.
2 Технічні засоби навчання
2.1 Металомікроскоп.
2.2 Оптична схема металомікроскопа.
2.3 Заготовки для виготовлення шліфів і травники для виявлення мікроструктури.
2.4 Набір шліфувально-полірувального матеріалу для виготовлення шліфів.
3 Методичні вказівки до самостійної роботи
Опрацювати за підручником і конспектом лекцій з курсу "Матеріалознавство" суть металографічного аналізу з допомогою металомікроскопів.
Мікроскопічний аналіз (мікроаналіз) – вивчення внутрішньої будови металів (мікроструктури) за допомогою оптичного мікроскопа при збільшенні від 50 до 2000 разів.
Мікроаналіз дає можливість вивчити форму та розміри окремих зерен і фаз, з яких складається метал, виявити в металі неметалеві включення та мікродефекти, а також виявити зміни внутрішньої будови, які відбулись під впливом різних факторів при термічній і хіміко-термічній обробці.
Мікроаналіз широко використовують для встановлення причин руйнування деталей при експлуатації. Для цього вирізують зразки біля місця руйнування і на віддалі від нього, і досліджують зміни в структурі металу.
Звернути увагу на принцип роботи металомікроскопа. Дослідження з його допомогою проводять у відбитих променях, тобто зразок повинен не просвічуватись світловим промінням.
За допомогою поворотних і відбиваючих призм зображення мікроструктури виводиться в окуляр для візуального спостереження або у фотоокуляр для фотографування. При візуальному спостереженні рекомендується застосовувати жовто-зелені фільтри, які є найбільш чутливими для людського ока.
Конструкцію металомікроскопа розділяють на три системи: оптичну, освітлення і механічну.
В оптичну систему входять такі важливі елементи, як об'єктив та окуляр від яких, власне, і залежить збільшення металомікроскопа. Компонуючи об'єктив і окуляр, можна досягти збільшення до 1500 раз, а із застосуванням імерсійного масла - до 2000 раз.
Об'єктив являє собою систему лінз, що розміщені в одній оправі і обернені до об'єкту дослідження. Він дає обернене збільшене дійсне зображення об'єкту. Об'єктиви випускають двох типів: ахроматичні і апохроматичні. Перші використовують при малих, а другі - при великих збільшеннях.
Окуляр - це система лінз, розміщених в одній оправі і повернута до ока спостерігача. Окуляр виправляє оптичні дефекти і дає уявне збільшене зображення, отримане об'єктивом.
Корисне збільшення мікроскопа М залежить від збільшення об’єктива, при якому виявляються деталі предмету вивчення. Воно визначається за формулою:
 ,
,
де d1 - віддаль, що відповідає роздільній здатності людського ока, рівна 0,2-0,3 мм;
d - віддаль, що відповідає роздільній здатності оптичної системи.
Природно, що чим менше d, тим більше корисне збільшення мікроскопа. Величина, обернена мінімальній віддалі між двома точками, при якій ці точки розглядаються окремо ( не зливаються в одне ціле ), називається роздільною здатністю.
Ще однією із основних характеристик металомікроскопа є числова апертура об’єктива. Вона впливає на чіткість зображення і визначає роздільну здатність мікроскопа і входить у формулу, за якою визначають роздільну здатність оптичної системи:
 ,
,
де - довжина світлової хвилі (для звичайного білого світла 6000 Å);
n - коефіцієнт заломлення середовища між об'єктивом мікроскопа і шліфом (для повітря n = 1 );
- половина розкритого кута, який створюється пучком променів, що входять в об’єктив (мах = 70°).
Добуток n·sin називають числовою апертурою об’єктива і позначають літерою А. Отже, максимальне збільшення оптичного мікроскопа, в якому використовуються видимі промені світла із довжиною хвилі приблизно 60 мкм, буде при максимальному значенні опертури А, що відповідає мінімальному значенню , тобто

Тоді корисне збільшення мікроскопа:

Оптична схема металомікроскопа подана на рисунку 3.1.

Рисунок 3.1 – Оптична схема металомікроскопа МИМ-7
Мікрошліф 13 розміщують на предметному столику мікроскопа полірованою поверхнею вниз, яка освітлюється світловими променями знизу. Світлові промені від джерела світла 1 проходять через колектор 2, відбиваються від дзеркала 3, проходять через світлофільтр 4 і апертурну діафрагму 5, лінзу 6, фотозатвор 7, поясову діафрагму 8, пентапризму 9, лінзу 10 і попадають на напівпрозору відбиваючу пластину 11. Від цієї пластини світлові промені направляються в об'єктив 12 і на об'єкт дослідження (мікрошліф) 13. Відбившись від мікрошліфа, промені попадають знову в об'єктив 12, проходять через відбиваючу пластину 11 і ахроматичну лінзу 14. Дзеркалом 15 направляють в окуляр 16 для візуального спостереження.
Для фотографування дзеркало 15 відводиться в сторону (виключається із оптичної схеми ) і світлові промені проходять через фотоокуляр 17, відбиваються дзеркалом 18 і попадають на фотопластинку 19.
Мікроаналіз проводять на мікрошліфах. Мікрошліф – це зразок, який вирізують з досліджуваної деталі або заготовки з плоскою відшліфованою, відполірованою та протравленою поверхнею.
Мікрошліф виготовляють таким чином. З тієї частини деталі або заготовки, яка для конкретного дослідження становить найбільший інтерес вирізують зразок. Для проведення досліджень найзручнішим є мікрошліф у вигляді циліндра 10 мм і висотою 10-15 мм або у вигляді куба із стороною 10 мм. Вирізування зразка із заготовки або деталі проводиться на металорізальних верстатах, механічною або ручною пилкою по металу, а з матеріалу після термообробки – відрізним наждачним кругом. Щоб не спричинити суттєвих змін у будові металу, потрібно уникати значного нагріву зразка під час вирізування. За допомогою напильника або наждачного круга вирівнюють поверхню призначену для мікроаналізу. Для запобігання термічного впливу на внутрішню будову зразків під час шліфування на абразивному крузі необхідно застосовувати інтенсивне охолодження.
У випадку, коли зразки мають невеликі розміри або складний профіль поверхні їх заливають в оправках легкоплавкими матеріалами (сірка, сплав Вуда, пластмаса, тощо) або затискають в спеціальних струбцинках. Щоб не пошкодити дифузійний шар, одержаний хіміко-термічною обробкою, при виготовленні шліфа, між шліфом і стінкою струбцинки кладуть тонку м’ягку мідну прокладку.
Після повного вирівнювання зразка на наждачному крузі проводять шліфування на шліфувальних паперах з різною зернистістю абразива механічним способом або вручну.
Шліфування проводять на шліфувальних паперах з поступовим переходом від паперу з розміром абразивних частинок 120-100 мкм до паперу з зернистістю абразива 20-14 мкм. При переході від паперу одного розміру зернистості до іншого необхідно очищувати зразок від абразива та змінювати напрям шліфування на 90о. На кожному послідуючому папері шліфують до зникнення рисок від попереднього паперу. Шліфувальний папір під час шліфування рекомендується класти на скло або іншу тверду підкладку.
Після закінчення шліфування зразок промивають водою і просушують фільтрувальним папером. На фетр або сукно наносять алмазну пасту розміром абразивних частинок 3-1 мкм і зразок полірують. Полірування виконують механічним спрособом або вручну. Полірування вважається закінченим тоді, коли з поверхні шліфа зникають усі риски і вона набуває дзеркального блиску.
Крім механічного полірування використовують електролітичне. Електролітичне полірування використовують для чистих металів і однофазних сплавів.
Для виявлення мікроструктури зразок піддають травленню. Травлення проводять хімічними реактивами, серед яких найбільш часто використовують слабкі спиртові розчини кислот та суміші різних кислот. Залізовуглецеві сплави протравлюють в 3-5%-му розчині азотної кислоти в спирті.
Відполіровану і промиту поверхню зразка протирають ваткою змоченою спиртом. На підготовлену поверхню піпеткою наносять травник. Коли відполірована поверхня стає легко матовою, шліф промивають водою, потім спиртом і висушують фільтрувальним папером або потоком підігрітого повітря. Тривалість травлення залежить від хімічного складу матеріалу шліфа і складу травника і встановлюється експериментально.
4 Завдання і порядок виконання роботи
та оформлення звіту
4.1 Користуючись шліфувально-полірувальним набором приготовити мікрошліф.
4.2 Проглянути під металомікроскопом непротравлений шліф.
4.3 Протравити мікрошліф (виявити мікроструктуру).
4.4 Проглянути мікроструктуру під металомікроскопом і зарисувати її в зошит.
4.5 Зарисувати оптичну схему металомікроскопа.
4.6 Визначити збільшення при якому велось вивчення шліфа під мікроскопом
4.7 Відповісти на контрольні запитання.
5 Контрольні запитання
5.1 Принцип роботи металомікроскопа МИМ-7.
5.2 Які задачі вирішуються з допомогою металомікроскопа?
5.3 В чому полягає суть виявлення мікроструктури металу чи сплаву при застосуванні МИМ-7?
Робота №4
Визначення твердості металів
Мета роботи
1.1 Ознайомитись з основними методами і приладами для визначення твердості металів і сплавів.
1.2 Засвоїти методику роботи з приладами Брінеля, Роквелла та Віккерса.
2 Технічні засоби навчання
1.3 Твердоміри ТШ, ТК, ТП.
1.4 Відліковий мікроскоп.
1.5 Таблиця твердості.
1.6 Комплект стандартних зразків.
3 Методичні вказівки до самостійної роботи
Ознайомитись з матеріалом розділу "Пластична деформація і механічні властивості" за будь-яким підручником з матеріалознавства. Звернути увагу на те, що в усіх методах принцип вимірювання твердості один і той же. Це є взаємодія між собою двох матеріалів, в результаті якої деформується поверхня досліджуваного матеріалу і за величиною деформації оцінюють твердість цього матеріалу.
Конкретно - твердість матеріалів визначають шляхом втискування в нього спеціального твердого наконечника (індентора) у вигляді алмазного чи твердосплавного конуса або загартованої кульки чи алмазної пірамідки при певному навантаженні. Після розвантаження індентора на матеріалі залишається відбиток за яким і визначають його твердість.
Для визначення твердості різних матеріалів користуються стандартними методиками із застосуванням спеціальних приладів.
Визначення твердості за методом Брінеля.В основу цього методу покладений принцип втискування загартованої кульки діаметром 2,5; 5,0: 10 мм при навантаженні 250, 500,1000 і 3000 кГс. Цілком зрозуміло, що таким методом можна замірювати твердість матеріалів за значенням нижчу твердості загартованої кульки, бо інакше буде деформуватися не поверхня матеріалу, а сама кулька. Практично це твердість до 450 кГс/мм2. Після зняття навантаження на поверхні матеріалу залишається сферичний відбиток (рисунок 1а), величина якого залежить від твердості матеріалу: чим твердіший матеріал, тим менший діаметр відбитка.
Навантаження під яким втискується кулька визначається за формулою P=kD2,
k- коефіцієнт вибраний на основі математичної теорії моделювання і має значення 30, 10, 2,5. Вибирають в залежності від роду матеріалу, його твердості. Чим більша твердість матеріалу, тим більший коефіцієнт. Для чорних металів та їх сплавів - 30, для міді і її сплавів -10, для алюмінію та його сплавів - 2.5.
D - діаметр кульки в мм.
Знаючи діаметр відбитка, діаметр кульки та величину навантаження, твердість визначають за формулою:

,
де Д – діаметр кульки в мм;
d - діаметр відбитка в мм;
Р – навантаження в кГс.
Твердість за Брінелем (НВ) визначають в кГс/мм2 або в МПа.
Для того, щоб кожний раз не робити обчислень твердості, користуються складеною для цього таблицею значень твердості в залежності від навантаження P і діаметра відбитка D. Діаметр кульки, навантаження і час випробування підбирають в залежності від природи матеріалу, товщини зразка чи деталі. Діаметр відбитка визначають відліковим мікроскопом ОМ-1.
Таблиця 4.1 – Таблиця для вибору параметрів випробування при визначенні твердості за методом Брінеля
| Матеріал | Твердість НВ, кГс/мм2 | Товщина зразка, мм | Діаметр кульки, мм | Наванта– ження, кГс | Тривалість навантаже-ння, с |
| Чорні метали | 140-450 | Більше 6 6 – 3 Менше 3 | 10.0 5.0 2.5 | 187.5 | |
| Менше 140 | Більше 6 6 – 3 Менше 3 | 10.0 5.0 2.5 | 62.5 | ||
| Кольорові метали | 35-130 | Більше 6 6 – 3 Менше 3 | 10.0 5.0 2.5 | 62,5 | |
| 8-35 | Більше 6 6 – 3 Менше 3 | 10.0 5.0 2.5 | 62,5 15,6 |
Вимірювання твердості за Роквеллом.За цим методом твердість вимірюється втискуванням в матеріал алмазного конуса з кутом при вершині 120° (при вимірюванні твердості загартованих сталей і надтвердих матеріалів) або загартованої стальної кульки діаметром 1,58 мм (при вимірюванні твердості відпалених сталей та кольорових металів). Твердість за Роквеллом визначається за глибиною відбитка. За одиницю твердості в цій методиці взята умовна одиниця, яка відповідає осьовому переміщенню наконечника на 0,002 мм (на циферблаті індикатора відповідає одній поділці). При вимірюванні алмазним конусом навантаження на індентор виставляють 150 кГс і відлік твердості проводиться за чорною шкалою (шкала С). При вимірюванні кулькою навантаження на індентор виставляють 100 кГс і відлік ведуть за червоною шкалою (шкала В). Відповідно одиниці твердості позначають HRC і HRB. Оскільки число твердості за Роквелом є безрозмірним, то для порівняння з числами твердості за іншими методами користуються перевідними таблицями одних одиниць в інші.

А) б) в)
а – за методом Брінеля; б – за методом Роквелла;
в – за методом Віккерса
Рисунок 4.1 – Схема визначення твердості
Вимірювання твердості за Віккерсом, Цей метод вимірювання твердості застосовують для виробів, які пройшли поверхневе зміцнення (хіміко-термічну обробку, поверхневе гартування, наплавлення і т.п.) і в яких потрібно визначити твердість поверхневого досить тонкого шару. З цією метою в поверхневий шар втискується алмазна пірамідка (з кутом між її протилежними гранями 136°) під навантаженням 5,10,20... 100 кГс. Тривалість витримки під навантаженням складає 10-15 секунд. Після розвантаження визначають величину діагоналі відбитка, а за таблицею - твердість. Таблиця складена за обчисленнями за формулою:

,
де Р - навантаження на пірамідку в кГс;
- кут між протилежними гранями пірамідки, який дорівнює 136°;
d - середнє арифметичне довжин обох діагоналей в мм.
4 Завдання і порядок виконання роботи та оформлення звіту
4.1 Ознайомитись з будовою твердомірів і методикою роботи на них.
4.2 Вибрати прилад і зразки для визначення їх твердості.
4.3 Провести вимірювання твердості вибраних зразків.
4.4 Записати значення виміряної твердості за методом Брінеля в таблицю 4.2, за методом Роквелла в таблицю 4.3, за методом Віккерса в таблицю 4.4.
4.5 За результатами визначеної твердості стальних зразків методом Брінеля побудувати графік залежності твердості сталі від процентного вмісту вуглецю.
4.6 Відповісти на контрольні запитання.
Таблиця 4.2
| № | Наймну-вання ма- теріалу | Хімічний склад матеріалу (%С для сталі). | Діаметр кульки D, мм | Наванта- ження Р, кГс | Діаметр відбитка, d, мм | Твердість по Брінелю НВ |
Таблиця 4.3
| Клас виробів | Наймнування виробів | Стан матеріалу | Шкала | Навантаження Р, кГс | Твердість | ||
| HRC | HRB | HB | |||||
| Різальний інструмент | 1 плашка | Т.о. | С | ||||
| Виміювальний інструмент | |||||||
| Ударно-штамповий інструмент | |||||||
| Важконаван-тажені деталі машин | |||||||
| Сталі до термообробки і кольорові метали |
Таблиця 4.4
| Вид обробки | Фазовий склад поверхневого шару | Навантаження Р,кГс | Середнє арифметичне обох діагоналей d, мм | Твердість HV |
5 Контрольні запитання
5.1 В чому полягає вимірювання твердості за методом Брінеля?
5.2 Як визначається навантаження під яким втискують кульку?
5.3 Стандартні діаметри кульок. Від чого залежить вибір діаметра кульки?
5.4 Який вибирають коефіцієнт k при вимірюванні твердості чорних металів і їх сплавів?
5.5 Чому твердість загартованої сталі неможливо визначити за методом Брінеля?
5.6 Що втискують, під яким навантаженням і по якій шкалі читають показники при вимірюванні твердості загартованих стальних зразків за методом Роквелла?
5.7 Що втискують, під яким навантаженням і по якій шкалі читають показники при вимірюванні твердості стальних зразків до термообробки за методом Роквелла?
5.8 Для яких виробів застосовують метод вимірювання твердості за Віккерсом?
Робота №5
Діаграма стану двокомпонентних сплавів
Мета роботи
1.1 Ознайомитись з методикою аналізу різних типів діаграм стану в залежності від взаємодії компонентів між собою.
1.2 Вивчити термінологію та інформацію закладену в лінії і критичні точки діаграми стану.
1.3 Ознайомитись з методикою побудови кривих охолодження та нагрівання сплавів за допомогою діаграми стану.
2 Прилади та технічні засоби навчання
2.1 Набір карток з діаграмами стану різних двокомпонентних сплавів.
2.2 Набір мікрошліфів типових зразків двокомпонентних сплавів.
2.3 Альбом типових мікроструктур двокомпонентних сплавів.
3 Методичні вказівки до самостійної роботи
Опрацювати за підручником і конспектом лекцій з курсу "Матеріалознавство” розділ „Теорія сплавів”: Звернути увагу на термінологію й особливу увагу на принцип побудови діаграм стану двокомпонентних сплавів.
Чисті метали використовуються рідко, в основному в електрорадіотехніці. Основними конструкційними матеріалами являються металеві сплави. Вони володіють більш цінним комплексом механічних, фізичних та технологічних властивостей, ніж чисті метали.
Сплав – речовина, яку одержують поєднанням (сплавленням, спіканням, електролізом тощо) двох або більше хімічних елементів або стійких хімічних сполук. Якщо основою сплаву є метал, то він називається металевим сплавом.
Компонент – незалежна складова частина системи (сплаву). Компонентами можуть бути хімічні елементи (метали, неметали) і хімічні сполуки. Чистий метал можна розглядати як однокомпонентну систему. Сплав двох металів - як двокомпонентну систему. Хімічні сполуки розглядають як компоненти лише в разі їхньої стійкості (не дисоціюють) у досліджуваному інтервалі температур.
Фаза –однорідна область сплаву, яка утворюється в результаті взаємодії компонентів і характеризується однаковими властивостями в кожній її точці і відділена від інших фаз поверхнею розділу, при переході через яку хімічний склад, структура і властивості фази змінюються скачкоподібно. Фазами можуть бути хімічні елементи, чисті метали, тверді розчини, хімічні сполуки. За агрегатним станом фази бувають твердими, рідкими, газоподібними. Однорідна речовина, або чистий метал, є однофазною системою, а механічна суміш двох компонентів - двофазною.
Система - сукупність фаз (у рідкому, твердому чи газоподібному стані), які знаходяться в рівновазі при заданих умовах (температура, тиск).
В залежності від фізико-хімічної взаємодії компонентів можуть утворюватися наступні фази: рідкі розчини, тверді розчини, хімічні сполуки.
При вивченні взаємодії компонентів сплаву між собою у твердому стані слід засвоїти такі поняття: тверді розчини, хімічні сполуки, механічні суміші.
У рідкому стані компоненти більшості сплавів розчиняються один в одному необмежено, утворюючи рідкий розчин (розплав). У твердому стані їхня взаємна розчинність змінюється. Таким чином, в сплавах при фізико-хімічній взаємодії компонентів у твердому стані можуть утворюватися: тверді розчини, хімічні сполуки.
Твердий розчин – однорідна фаза, в якій атоми розчиненого компонента розташовуються в кристалічній гратці розчинника, змінюючи її параметри. Якщо атоми розчиненого компонента займають у кристалічній гратці місця атомів розчинника, то утворюється твердий розчин заміщення (рисунок 5.1а). Якщо атоми розчинюваного компонента розміщуються в порожнинах кристалічної ґратки між атомами розчинника, тоді утворюються тверді розчини впровадження.
Утворення того чи іншого розчину пов'язане з типом кристалічної ґратки і співвідношенням атомних радіусів компонентів.

А) б)
а – заміщення; б – впровадження
Рисунок 5.1 – Тверді розчини
Тверді розчини впровадження утворюють такі елементи як водень, азот, вуглець, частково бор, решта - розчини заміщення.
Необмежену розчинність, тобто здатність утворювати тверді розчини в будь-яких пропорціях, можуть мати лише елементи, які мають однаковий тип кристалічних ґраток і їхні параметри відрізняються між собою не більше як на 14-15%, причому ця припустима різниця в параметрах різна для різних металів.
Хімічні сполуки утворюють компоненти з великою різницею в електронній будові їхніх атомів та кристалічних ґраток. Вони відрізняються від твердих розчинів конкретним співвідношенням числа атомів компонентів, яке відповідає стехіометричній пропорції (AnBm). Кристалічна гратка сполуки має іншу будову ніж кристалічні ґратки компонентів.
Якщо компоненти сплаву у твердому стані не утворюють тверді розчини і хімічні сполуки то вони утворюють механічні суміші чистих компонентів (евтектику). Будова металевих сплавів залежить від того, в яку взаємодію вступають компоненти, які їх утворюють.
Під структурою розуміють форму, розмір і характер взаємного розміщення фаз у сплаві. Структура сплаву виявляється мікроаналізом.
На практиці важливо знати фазовий стан і структуру сплавів залежно від температури й концентрації компонентів, що їх утворюють. Такий зв'язок демонструють діаграми стану, які будують для умов рівноваги або близьких до них.
Врівноваженими вважаються умови, при яких процеси відбуваються зворотно, тобто в даному випадку, коли кристалізація металів і сплавів при охолодженні відбувається при температурі плавлення. Врівноважений стан відповідає мінімальному значенню енергії Гіббса. Цей стан може бути досягнений тільки при дуже малих швидкостях охолодження або тривалому (повільному) нагріванні.
Із вивченого в розділі "Кристалізація металів" ми знаємо що в реальних умовах завжди має місце деяке переохолодження.
Діаграма стану – цеграфічне зображення фазового стану сплаву в залежності від концентрації компонентів і температури.
Щоб зрозуміти що являє собою діаграма стану та її значення для аналізу сплавів, треба звернути особливу увагу на її побудову.
Діаграми стану будують на основі термічного методу аналізу, суть якого полягає в побудові, на основі експериментальних даних, кривих охолодження чистих компонентів та сплавів з різною концентрацією компонентів, і визначенні по них критичних точок.
Криві охолодження будуються в координатах температура (вісь Y) - час (вісь X). По перегинах або зупинках температури на кривій охолодження, зв'язаних з тепловими ефектами перетворень, визначають температури відповідних перетворень. Ці температури називають критичними, а точки на кривих охолодження, які їм відповідають - критичними точками.
Точки початку кристалізації називають точками "ліквідус", а точки кінця кристалізації - "солідус".
При охолодженні аморфного тіла (смоли, скла) його температура падає безперервно і поступово, тобто аморфне тіло затвердіває поступово і поступово плавиться в певному інтервалі температур. Чисті метали затвердівають (кристалізуються) при постійній температурі, а сплави – в інтервалі температур, про що свідчать криві охолодження (рисунок 5.2)
При кристалізації чистих металів і механічних сумішей спостерігається тимчасова зупинка температури – на кривій охолодження відмічається горизонтальною лінією. При кристалізації сплавів виділення твердої фази супроводжується лише зміною швидкості охолодження і на кривій охолодження спостерігається перегин.
Отже, чисті метали кристалізуються при постійній температурі (одна критична точка Т.1), а сплави кристалізуються в інтервалі температур, мають точку початку кристалізації („ліквідус”) Т.1, і точку кінця кристалізації („солідус”) Т.2 (рисунок 5.2).

а – аморфного тіла; б – кристалічного тіла (чистого металу); в – сплаву з евтектикою;
г – сплаву з утворенням твердого розчину.
Рисунок 5.2 – Криві охолодження
Діаграма стану будується наступним чином.
На вісі абсцис відмічають концентрації сплавів і чистих компонентів. В цих точках проводять ординати і проставляють критичні точки чистих компонентів, а також сплавів, взяті з кривих охолодження (рисунок 5.3).
Зверніть увагу на те, що точка початку вісі Х відповідає стопроцентній концентрації компонента А і нульовій концентації компонента В. Зліва направо зменшується концентрація компонента А і відповідно збільшується концентрація компонента В.
З'єднуючи точки початку кристалізації одержують на діаграмі стану лінію "ліквідус", а з'єднуючи точки кінця кристалізації і одержують лінію "солідус" (рисунок 5.3).
 |
Отже, лінія "ліквідус" на діаграмі стану являє собою геометричне місце точок початку кристалізації, а лінія "солідус" – геометричне місце точок кінця кристалізації.
Тепер зрозуміло, що якщо лінії діаграми побудовані по критичних точках, одержаних експериментально, то маючи діаграму стану двокомпонентних сплавів, ми маємо критичні точки всіх сплавів (з будь-якою концентрацією двох компонентів) цієї системи, а відповідно фазовий стан при будь-якій температурі. І можемо по діаграмі стану побудувати криву охолодження для будь-якого сплаву. Для цього на вісі X проставляємо концентрацію сплаву. В цій точці проводимо ординату. Точки перетину ординатою ліній діаграми є критичними точками даного сплаву.
При побудові кривих охолодження користуються правилом фаз ( закон Гіббса).
Закон Гіббса встановлює залежність між числом степеней свободи, числом компонентів, числом фаз і виражається рівнянням:
С = К – Ф +m ,
де К – кількість компонентів;
Ф – число фаз;
m – число зовнішніх факторів (температура, тиск). Якщо прийняти, що всі перетворення протікають при постійному тиску, це рівняння прийме вид:
С = К – Ф +1 .
При аналізі діаграми стану двокомпонентних сплавів виникають питання про фазовий склад якого-небудь сплаву при даній температурі, про концентрацію в цих фазах компонентів, про відносну кількість кожної з фаз. Відповіді на ці запитання можна отримати при допомозі правила відрізків (правила важіля).
Щоб визначити вміст компонентів у фазах, через точку, що характеризує стан сплаву, проводять горизонтальну лінію до перетину з лініями діаграми, які обмежують цю область (рисунок 5.3). Точки перетину називають нодами, а пряму, що їх з’єднує конодою. Проекції точок перетину коноди з лініями діаграми на вісь концентрацій показують склад фаз. Наприклад, у сплаві 3 (рисунок 5.3) при температурі точки с рідина за своїм складом відповідає точці d´ на вісі абсцис.
Щоб визначити кількісне співвідношення фаз, визначають довжину відрізків коноди від заданої точки на діаграмі до точок, що визначають склад фаз. Довжини цих відрізків обернено пропорційні кількостям фаз.
Якщо масу рідини позначити буквою Р, а масу всього сплаву – буквою В, то можна записати  (рисунок 5.3).
(рисунок 5.3).
Якщо масу всього сплаву прийняти за 100%, то кількість рідкої фази визначиться співвідношенням  .
.
По аналогії, для твердої фази можна записати  .
.
Така інформація, яку дають діаграми стану має величезне практичне значення. Особливо для сплавів на основі металів які володіють поліморфізмом, тобто змінюють тип кристалічної ґратки в твердому стані.
Знання діаграми стану потрібні конструктору, який закладає матеріал для виготовлення деталі, технологу, який назначає режими термічної обробки, технологію гарячої обробки різних сплавів, ливарнику, який заливає метал в форми і т.д.
4 Завдання і порядок виконання роботи та
оформлення звіту
4.1 Викреслити діаграму стану задану викладачем.
4.2 Позначити точки і нанести фази в різних областях діаграми.
4.3 Користуючись наведеним прикладом на рисунку 5.4:
а) описати лінії на діаграмі стану;
б) вказати структуру в усіх областях діаграми стану;
в) побудувати криву охолодження або нагрівання (за завданням викладача) заданого сплаву із застосуванням правила фаз Гіббса в координатах „температура – час”.
г) в точці, заданій викладачем, в двофазній області визначити кількість твердої і рідкої фази за правилом відрізків.
4.4 Для сплаву, заданого викладачем, за правилом відрізків визначити кількість твердої і рідкої фази в двофазній області при заданій температурі.
4.5 Дати відповіді на контрольні запитання.
На рисунку 5.4 приведений приклад виконання і оформлення роботи по пунктах 4.1-4.3.
Приклад виконання роботи
 |
А б
а – діаграма стану, б – крива охолодження сплаву І-І
Рисунок 5.4 – Побудова кривої охолодження за діаграмою стану двохкомпонентних сплавів
Аналіз діаграми
Дана діаграма стану відноситься до типу, коли компоненти необмежено розчинні один в одному в рідкому стані, обмежено розчинні в твердому стані і утворюють евтектику, – твердий розчин компонента В в компоненті А; - твердий розчин компонента А в компоненті В; ACD – лінія ліквідус; AECDB – лінія солідус; ЕСD – лінія евтектичного перетворення; FE – лінія граничної розчинності компонента В в компоненті А при зміні температури.
Побудова кривої охолодження
На вісі абсцис (вісі концентрацій) діаграми стану відмічаємо концентрацію заданого сплаву. В цій точці проводимо ординату. Точки перетину ліній діаграми ординатою є критичними точками для даного сплаву. Точка 1 – точка „ліквідус” (точка початку кристалізації), точка 2 – точка „солідус” (точка кінця кристалізації). Для правильної побудови кривої охолодження сплаву користуємося законом Гіббса.
За законом Гіббса С=К-Ф+1,
де С – число ступенів свободи;
Ф – число фаз;
К – кількість компонентів.
Чим більше ступенів свободи, тим стрімкіший хід кривої охолодження.
Якщо, наприклад, розрахунок дає значення С=0, то це означає, що немає жодного ступеню свободи і не може змінюватись ні один параметр системи. На кривій охолодження, в цьому випадку, буде температурна зупинка (горизонтальна лінія). Якщо С=1, то процес йде зі зміною температури, на кривій охолодження буде точка перегину, в цьому інтервалі температур крива охолодження буде полога. При С=2 – стрімкий хід кривої охолодження. В даному випадку С=2 в інтервалі температур від 0 до 1 (С=21+1=2). В інтервалі температур від т.1 до т.2 С=22+1=1. В цьому інтервалі температур крива охолодження полога, йде процес кристалізації -фази зі зміною температури. Закінчується кристалізація -фази в т.2. На лінії ECD в рівновазі знаходяться 3 фази: , Р, і С=23+1=0. При цій температурі (лінія ECD) на кривій охолодження температурна зупинка (горизонтальна лінія 22´). На лінії ECD протікає евтектичне перетворення. Із рідкої фази одночасно виділяються кристали і , утворюючи механічну суміш фаз (+) – евтектику. Структура сплаву нижче лінії ECD є двохфазною – +Евт., тобто – +( +) і С=22+1.
Визначення кількості твердої і рідкої фази в двофазній області для сплаву І-І при температурі t1
На ординаті сплаву при температурі t1 відкладаємо точку с. Через цю точку проводимо горизонтальну лінію – коноду до перетину з лініми діаграми відповідно в точках е і d, які мають назву точки ноди. Кінці коноди впираються в однофазні області рідкої фази і -твердого розчину. Отже, ці фази будуть в сплаві І-І при температурі t1 (точка с). при цьому склад рідкої фази визначається проекцією точки d на вісь абсцис (d´), -твердого розчину – проекцією отчки е (е´). Відносна кількість кожної з фаз визначається співвідношенням відповідних відрізків коноди. Якщо масу рідини позначити буквою Р, а масу всього сплаву – буквою В, то можна записати  . Якщо масу всього сплаву прийняти за 100%, то кількість рідкої фази визначиться співвідношенням
. Якщо масу всього сплаву прийняти за 100%, то кількість рідкої фази визначиться співвідношенням  . По аналогії для твердої фази можна записати:
. По аналогії для твердої фази можна записати:  .
.
5 Контрольні запитання
5.1 Що таке крива охолодження, нагріву?
5.2 Як будують криві охолодження, нагріву?
5.3 Що таке сплав, як його одержують?
5.4 Дати визначення поняттям компонент, фаза, система?
5.5 Які фази утворюють компоненти при взаємодії в твердому стані?
5.6 Які ви знаєте тверді розчини і що являють вони собою?
5.7 Що таке хімічна сполука?
5.8 Що таке механічна суміш? Коли вона утворюється?
5.9 Що являє собою діаграма стану сплавів?
5.10 Як будують діаграму стану двокомпонентних сплавів?
5.11 Що таке лінія "ліквідус"?
5.12 Що таке лінія "солідус"?
5.13 В чому полягає закон Гіббса?
Робота №6
Діаграма стану залізо – вуглець
Мета роботи
1.1 Вивчити діаграму стану залізовуглецевих сплавів, як узагальнений результат експерементальних даних з досліджень сплавів заліза з вуглецем.
1.2 Провести фазовий аналіз будови діаграми стану залізо-вуглець.
1.3 Провести структурний аналіз будови діаграми стану Fe-C.
1.4 Засвоїти термінологію фазової і структурної будови діаграми стану залізовуглецевих сплавів.
2 Прилади та технічні засоби навчання
Моделі кристалічних ґраток і - заліза, стенд діаграми стану залізо-вуглець, крива охолодження чистого заліза.
3 Методичні вказівки до самостійної роботи
Опрацювати за конспектом лекцій та підручниками і рекомендованими посібниками тему "Будова діаграми стану залізо-вуглець". Звернути увагу на те, що діаграма стану залізо-вуглець побудована для сплавів з концентрацією вуглецю лише до 6.67%С, яка відповідає 100% хімічній сполуці Fe3C (рисунок 6.1). Оскільки сплави з більшим вмістом вуглецю дуже крихкі і на практиці не використовуються.. Таку концентрацію вуглецю-6.67% має карбід заліза Fe3C. В системі залізо-вуглецевих сплавів Fе3С, як фазу, називають цементитом, який в системі залізовуглецевих сплавів поводить себе як самостійний компонент.
Слід звернути увагу на те, що вуглець при охолодженні залізовуглецевих сплавів може не тільки хімічно взаємодіяти з залізом, утворюючи Fe3C, а й виділятися у вигляді графіту. Тому розрізняють дві діаграми стану: залізо-цементит (Fe-Fe3C) і залізо-графіт (Fe-C). Перша діаграма на рисунку 6.1 показана суцільними лініями, друга – штриховими. Всі лінії системи Fe-C розміщуються на діаграмі вище ліній системи Fe-Fe3C (евтектичне і евтектоїдне перетворення відбувається за вищих температур: 1153 і 738оС відповідно). Точки C, E, S зміщені вліво (С – 4,26%, Е – 2,11%, S – 0,7%). Діаграму стану Fe-Fe3C називають нестабільною (метастабільною), оскільки цементит за певних умов розпадається з утворенням вільного вуглецю (графіту), а діаграму стану Fe-C називають стабільною.
Оскільки основним компонентом в залізо-вуглецевих сплавах є залізо, то слід звернути увагу на властивості заліза, особливо на його поліморфізм – властивість змінювати тип кристалічної ґратки в твердому стані. Залізо кристалізується в кількох модифікаціях (, , ), (рисунок 6.1).
Обов'язково запам'ятати розчинність вуглецю в - і залізі, так як теорія термічної обробки залізо-вуглецевих сплавів ґрунтується на фазових перетвореннях і змінній розчинності вуглецю в , і – залізі при зміні температури. -залізо при кімнатній температурі може розчинити 0.006%С (точка Q на діаграмі) і найбільше 0.02%С (точка P на діаграмі) при температурі 727°С.
Мінімальна розчинність вуглецю в -залізі складає 0.83%С при температурі 727°С (точка S на діаграмі) і максимальна – 2.14%С (точка Е на діаграмі) при температурі 1147°С.
Вникнути в механізм фазового перетворення чистого заліза та залізо-вуглецевих сплавів, відзначивши при цьому, що фазові перетворення чистого заліза відбуваються при постійній температурі, а в залізовуглецевих сплавах – в інтервалі температур.
 |
Слід також звернути увагу на сплав з концентрацією вуглецю 4.3%. Це сплав, який кристалізується з рідкого стану при постійній температурі, як чистий метал. Температура кристалізації такого сплаву відповідає 1147°С. При постійній температурі 1147°С із розплаву одночасно виділяються кристали аустеніту і цементиту, утворюючи механічну суміш – (евтектику) ледебурит. Евтектика (ледебурит) є основною структурною ознакою білих чавунів.
Слід запам'ятати назву фаз які, утворює залізо при взаємодії з вуглецем в твердому стані: ферит, аустеніт, цементит, а також механічні суміші – евтектоїд (перліт) і евтектику (ледебурит).
Ферит (Ф) - твердий розчин впровадження вуглецю та інших домішок в - залізі. Розрізняють низькотемпературний - ферит, з розчинністю вуглецю до 0.02% при температурі 727оС і високотемпературний -ферит, з граничною розчинністю вуглецю 0.1% при температурі 1499 оС.
Ферит (при 0.006%С) має приблизно наступні механічні характеристики: 0,2 = 250 МПа,  50%, = 80%, НВ 80-90.
50%, = 80%, НВ 80-90.
Аустеніт (