
Категории:
АстрономияБиология
География
Другие языки
Интернет
Информатика
История
Культура
Литература
Логика
Математика
Медицина
Механика
Охрана труда
Педагогика
Политика
Право
Психология
Религия
Риторика
Социология
Спорт
Строительство
Технология
Транспорт
Физика
Философия
Финансы
Химия
Экология
Экономика
Электроника
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит из ионов
Принято обозначать степень окисления римской цифрой с указанием: (+), (-).
Практическое значение окислительно – восстановительных реакций очень велико. Они лежат в основе многих таких важных промышленных процессов, как производство металлов, аммиака, серной и азотной кислот, широко используется в аналитической химии (во многих методах анализа).
1.Окислением называется процесс отдачи 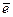 атомом, молекулой или ионом. (пи этом степень окисления повышается). Вещество, участвующее в окислении, называется восстановителем.
атомом, молекулой или ионом. (пи этом степень окисления повышается). Вещество, участвующее в окислении, называется восстановителем.
Al0 - 3 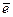 Al3+ Fe2+ -
Al3+ Fe2+ - 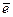 = Fe3+
= Fe3+
H2 - 2 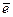 = 2H+ 2Cl- - 2
= 2H+ 2Cl- - 2 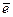 = Cl2
= Cl2
2. Восстановлением называется процесс присоединения 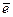 атомом, молекулой или ионом (С.О. при этом понижается). Вещество, участвующее в восстановлении, называется окислителем.
атомом, молекулой или ионом (С.О. при этом понижается). Вещество, участвующее в восстановлении, называется окислителем.
S0 + 2 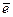 = S2-
= S2-
Cl2 + 2 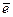 2Cl-
2Cl-
Окисление и восстановление – взаимосвязанные процессы, так как вещества могут отдавать электроны только в том случае, если в реакции участвует другое вещество, способное электроны принимать, что определяет закон сохранения заряда в химических реакциях.
Окислителями являются:
1. Все атомы неметаллов. Окислительные свойства могут проявлять как простые, так и сложные вещества. К типичным (сильным) окислителям относятся галогены ( фтор, хлор и др. ), кислород, а также КС1О3, НС1О3, НNО3, Н2SО4 (конц.), МпО2, КMпО4, К2Сг2О7, РbО2 и др.
Восстановителями являются:
1. Атомы всех элементов, кроме He, Ne, Ar, F. Наиболее легко теряют электроны атомы тех элементов, которые на последнем слое имеют один, два, три электрона.
2. Положительно заряженные ионы металлов, находящиеся в низкой степени окисления, например:
Fe+2, Cr+3, Mn+2, Sn+2, Cu+1.
3. Отрицательно заряженные ионы, например Cl- , Br-, I-, S-2.
4. Слабые кислоты и их соли, например: H2SO3, K2SO3, HNO2 и KNO2
Составление уравнений окислительно – восстановительных реакций.
Составляя уравнение окислительно – восстановительной реакции следует сначала установить функции реагентов ( окислитель, восстановитель, среду ). Подбор коэффициентов в уравнении основан на том, что в результате реакции происходит перераспределение зарядов. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Для подбора коэффициентов в уравнениях реакций окисления – восстановления используют метод электронного баланса.
Метод электронного баланса.
Последовательность составления окислительно-восстановительной реакции складываются из следующих этапов:
Записывают формулы реагентов и продукты реакции, находят элементы, повышающие и понижающие свои степени окисления и восстановления, и выписывают их отдельно, например:
МпСО3 + КС1О3 МпО2 + КС1 + СО2
С1 5+ С1-1
Мп+2 Мп+4
С1+5… + 6е = С1-1 1
Мп+2 – 2е = Мп+4 3
По найденным множителям определяют стехиометрические коэффициенты для уравнения реакции ( коэффициент 1 опускается, но подразумевается ) :
3МпСО3 + КС1О3 = 3МпО2 + КС1 + СО2
Уравнивают числа атомов элементов, не изменивших своих степеней окисления. Получают уравнение окислительно-восстановительной реакции:
3МпСО3 + КС1О3 = 3 МпО2 + КС1 + 3 СО2
Рассмотрим этот же приём для реакции:
K+2Cr+62O72- + 7H2+S+6O2+4+ 3K+2S2- 4K+2S6-O2-4+ Cr23+(S6+O2-4)3+ 3S0+ 7H+2O2-
 Cr6+- 3
Cr6+- 3 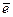 Cr3+ 2 –
Cr3+ 2 –
S2- + 2 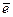 S0 3 –
S0 3 –
10Fe2+S6+O2-4 +2K+Mn+7O4 +8H2SO4 5Fe+32(SO4)3 +2Mn+2SO4 +K2SO4 + 8H2O
 Mn+7 + 5
Mn+7 + 5 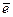 Mn+2 2
Mn+2 2
2I- - 2 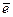 I20 5
I20 5
Для того, чтобы определить степени окисления элементов в окислительно-восстановительной реакции, необходимо иметь ввиду:
Постоянную степень окисления имеют:
.1. Щелочные металлы - (+1 )
2. щелочно-земельные - (+2 )
3. галогены (ионы) - (-1 )
4. водород в соединениях - (+1 ), исключения : гидриды
металлов КН, СаН2 ( -1 )
5. кислород О (-2), исключения : перекисные соединения Н2О2N,а2О2 , - (-1),
ДОМАШНЕЕ ЗАДАНИЕ:
1. Контрольные вопросы :
1.1. Какие реакции относят к окислительно-восстановительным?
1.2. Что такое окисление? Привести примеры.
1.3 Что такое восстановление? Привести примеры.
1.4 Как изменяется степень окисления элементов при окислении и восстановлении? Привести примеры.
1.5 Что такое степень окисления ?
2. Определить степень окисления каждого элемента в соединениях :
К2Сг2О7; КмпО4; К2МпО4; А12 (SО4)3; Си SО4 К2 S
ЛИТЕРАТУРА
4. Ищенко А.А. Аналитическая химия.М.»Академия». 2008.
5. Барсукова З.А. Аналитическая химия.М.Иысш.шк.,1989.
6. Лурье Ю.Ю. Справочник по аналитической химии. М. Химия.1985.