Типові завдання до колоквіуму №1
1. Наведіть по одному прикладу розчинників різних типів: апротонного, протогенного, протофільного, амфіпротного.
2. Константа автопротолізу безводного метанолу рівна 2,0·10-17. Приведіть рН нейтрального розчину метанолу.
3. Який з розчинників – вода, аміак, етанол, проявляє по відношенню до протону акцепторні властивості в найбільшій мірі?
4. Який з розчинників - вода чи аміак, проявляє по відношенню до протона донорні властивості в більшій мірі?
5. Наведіть рівняння автопротолізу аміаку, метанолу. Вкажіть іони ліонію та ліату.
6. Якою кислотою - сильною чи слабкою, буде ацетатна кислота в аміачному розчині? Чому?
7. Напишіть рівняння протолізу карбонат-іону в воді.
8. Напишіть рівняння протолізу ацетатної кислоти в її аміачному розчині.
9. Напишіть рівняння протолізу ацетатної кислоти в її сульфатнокислому розчині.
10. Напишіть рівняння протолізу гідрогенкарбонат-іону у воді. Наведіть приклади відповідних термодинамічних констант протолізу.
11. Наведіть значення рК 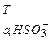 і рК
і рК 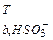 ,
,
12. Наведіть значення pK  , pK
, pK  .
.
13. Наведіть значення К  , К
, К  .
.
14. Вкажіть спряжені кислоти для таких основ: сульфід-іон, гідрогеноксалат-іон.
15. Вкажіть спряжені кислоту і основу для гідрогенсульфіт-іону.
16. Виведіть формули для розрахунку рН розчинів сильних основ з врахуванням і без врахування міжіонної взаємодії.
17. Виведіть формули для розрахунку рН розчинів сильних кислот з врахуванням і без врахування міжіонної взаємодії.
18. Виведіть формулу для розрахунку рН буферних сумішей.
19. Напишіть формулу для розрахунку a(Н+) і pН розчинів слабих основ.
20. Як вирахувати рН суміші сильної і слабої кислоти, суміші двох сильних кислот, суміші двох слабих кислот?
21. Напишіть формулу для розрахунку a(Н+) і pН розчинів слабих кислот.
22. Розрахуйте К  при іонній силі 0,05.
при іонній силі 0,05.
23. Наведіть загальну формулу для розрахунку рН розчинів амфолітів? Приведіть часткові вирази цієї формули для таких амфолітів: NaHCO3, NH4CH.
24. Що таке буферна ємність?
25. 5. Для рівноважного процесу 2A + B = ЗС наведіть формули концентраційної і умовної констант, враховуючи термодинамічну константу (зв’язок констант).
26. Наведіть формули для визначення іонної сили розчину і зв’язку іонної сили з величиною коефіцієнта активності.
27. Що таке “коефіцієнт конкуруючої реакції”? Наведіть формулу для розрахунку  .
.
28. Розрахуйте К  при іонній силі 0,04.
при іонній силі 0,04.
29. Розрахуйте рН 0,05 М розчину амоній нітрату
30. Розрахуйте  при pH = 6,0.
при pH = 6,0.
31. Скільки грамів твердого натрій гідроксиду треба розчинити в 500 мл 0,10 М розчину ацетатної кислоти, щоб одержати буферний розчин, рН якого 4,30?
32. Розрахуйте рН і ступінь протолізу аміаку в розчині, одержаному при 100-кратному розбавленні водою 10 мл 30.0 %-ного розчину аміаку (r=0.892 г/мл).
33. Розрахуйте а  і рН розчину, одержаного розведенням водою 5 мл 10,56 %-го розчину сульфатної кислоти (r= 1,070 г/мл) до загального об’єму 400 мл.
і рН розчину, одержаного розведенням водою 5 мл 10,56 %-го розчину сульфатної кислоти (r= 1,070 г/мл) до загального об’єму 400 мл.
34. Скільки грамів ацетатної кислоти міститься у 300 мл її розчину, рН якого 4,0?
35. Скільки мг твердого гідроксиду натрію необхідно розчинити в 300 мл 0,05 М розчину соляної кислоти, щоб збільшити рН розчину на 3 одиниці?
36. Розрахуйте pH розчину, одержаного змішуванням 200 мл 0,050 М розчину амоній хлориду і 5 мл 3%-ного розчину гідроксиду натрію (r = 1,03 г/мл).
37. Як класифікуються методи хімічного аналізу по величині проби?
38. Які завдання елементного і фазового аналізів?
39. На які групи поділяють визначувані компоненти за їх вмістом у зразку для аналізу?
40. Назвіть основні характеристики аналітичних реакцій. Шо таке аналітичний сигнал?
41. Що таке поріг виявлення, граничне розведення? Наведіть формулу залежності цих величин.
42. Дайте коротке визначення поняття груповий реагент. Перерахуйте основні вимоги до групових реагентів.
43. Які способи підвищення вибірковості аналітичних реакцій Вам відомі? Наведіть приклади конкретного застосування способу.
44. В чому суть крапельного аналізу? Наведіть конкретний приклад його застосування.
45. Напишіть в молекулярному і в іонному вигляді рівняння:
а) розчинення барій фосфату ацетатній кислоті;
б) реакція окиснення хром(ІІІ) сульфату гідроген пероксидом у лужному середовищі.
46. Напишіть молекулярні й іонні рівняння таких реакцій:
а) розчинення алюміній фосфату в надлишку їдкого натру;
б) окислення манган(ІІ) нітрату натрію бісмутатом.
47. Напишіть молекулярні та іонні рівняння таких реакцій:
а) розчинення кальцій фосфату в кислотах;
б) окиснення хром(ІІI) сульфату калій перманганатом у сульфатнокислому середовищі.
48. Аналіз суміші іонів К+, Мg2+, Al3+, Ba2+.
49. Наведіть схему аналізу суміші катіонів другої групи.
50. Аналіз суміші двохзарядних катіонів ІІ аналітичної групи.
51. Напишіть рівняння реакцій виявлення хрому (ІІІ).
52. Складіть схему аналізу суміші таких іонів: NH  , Fe3+, K+, Ba2+.
, Fe3+, K+, Ba2+.