Тема 2. Элементы химической термодинамики
Предисловие
Пособие предназначено для студентов нехимических специальностей и рассчитано на изучение общей и неорганической химии на семинарских занятиях в течение одного семестра 1 час в неделю.
Каждый параграф начинается с определений. Цель — уточнение применяемых терминов. Предлагаются задания с выборочным ответом. Сам набор предлагаемых ответов определяется типичными ошибками, совершаемыми студентами. Ответ следует считать удовлетворительным, если выбор правильного ответа (он может быть и не один) обоснован путем критики всех остальных предложенных определений. Выполнение таких заданий может явиться предметом самого семинарского занятия.
Затем предлагаются задания, как правило, в нескольких вариантах.
Тема 1. Стехиометрия
Определения и утверждения
Выберите правильное(ые) определение(я) или утверждение(я). Ваш выбор обоснуйте путем критики всех остальных определений и утверждений.
1.1.Система —
| 1.закрытая — это | 2.изолированная — это |
1) система, которая не может обмениваться энергией с внешней средой.
2) система, которая не может обмениваться веществом с внешней средой.
3) смесь реагентов в закрытой колбе.
4) смесь реагентов в закрытом термосе.
5) система, которая не может обмениваться с внешней средой ни веществом, ни энергией.
1.2.Химическая система — это
1) выделенная физическими или мысленными границами часть окружающего мира, которую мы рассматриваем.
2) совокупность веществ.
3) совокупность реагирующих веществ.
4) физически выделенная часть пространства с находящимися в ней веществами.
5) то же, но выделенная мысленно.
1.3.Стехиометрические законы — это законы
1) о количественных соотношениях веществ в химических реакциях (стехиометрические коэффициенты в уравнениях химических реакций).
2) о формулах химических веществ.
3) об условиях протекания реакций.
4) о сохранении массы в химических превращениях веществ.
5) о постоянстве состава.
6) обо всем выше сказанном, кроме ответа (3).
1.4.Закон сохранения массы в химических превращениях — это
1) закон природы.
2) правило, которое не всегда соблюдается.
3) приближенный закон в отношении химических превращений.
4) закон, который относится к любой системе.
5) закон, который справедлив только в изолированных системах.
6) закон, который относится только к закрытым системам.
1.5.Закон Авогадро можно сформулировать так: В равных объемах различных газов содержится
1) равное число молекул.
2) приблизительно равное число молекул.
3) то же, что (1) , но при одинаковых условиях.
4) то же, что и (2), но при одинаковых условиях.
5) то же, что (1), но при н.у.
6) то же, что и (2), но при н.у.
1.6.Закон постоянства состава формулируется так:
1) Каким бы способом ни было получено вещество, его состав и, следовательно, свойства одни и те же.
2) То же, но по отношению к веществам молекулярного строения.
3) Каким бы способом ни было получено вещество-дальтонид, его состав и, следовательно, свойства одни и те же.
4) Состав продуктов реакции зависит от относительных количеств взятых реагентов.
5) Состав продуктов реакции зависит от температуры и давления (для веществ, образующихся с участием газа), но не зависит от относительных количеств реагентов.
1.7.Закон постоянства состава
1) — это закон природы.
2) — это правило, которое не всегда соблюдается.
3) — это приближенный закон в отношении химических веществ.
Он относится
4) к любому веществу.
5) только к веществам молекулярного строения.
6) к ионным веществам.
7) к ВМС.
1.8.Дальтониды — это вещества
1) постоянного состава.
2) переменного состава.
3) со стехиометрическим (что такое стехиометрический?) составом внутри области гомогенности (что такое область гомогенности?).
4) со стехиометрическим составом вне области гомогенности.
5) молекулярного строения.
6) ионного строения.
1.9.Бертоллиды — это вещества
1) постоянного состава.
2) переменного состава.
3) со стехиометрическим (что такое стехиометрический?) составом внутри области гомогенности.
4) со стехиометрическим составом вне области гомогенности.
5) молекулярного строения.
6) ионного строения.
Задачи и вопросы
1.10.Что такое
| 1.температура? | 2.высокая температура? | 3.низкая температура? |
1.11.Вычислите изменение массы, которое будет наблюдаться в закрытой системе при сжигании в ней 1 г
1.водорода (2Н2 + О2 = 2Н2Ож + 571,6 кДж).
2.графита (С + О2 = СО2 + 393,5 кДж).
3.метана (СН4 + 2О2 = СО2 + 2Н2Ож + 882 кДж).
Что изменится, если система будет изолированной?
1.12.Какой объем
1.занимает 1 г водорода при нормальных условиях?
2.занимает 1 г водорода при стандартных условиях?
3.занял бы 1 г водорода в аудитории, где Вы сейчас находитесь?
1.13.Н. у. — это
1) аббревиатура слов "нормальные условия".
2) давление 1 атм и температура 0°С.
3) давление 1 атм и температура 25°С.
4) давление 101 кПа и температура 273 К.
5) указание на то, что объем газа измерен при нормальных условиях.
6) указание на то, что объем газа пересчитан на нормальные условия.
1.14.Вычислите молярную массу газа, если при
1.н. у. его плотность по воздуху составляет 1,5.
2.температуре 20°С и давлении 750 мм рт. ст. его плотность по водороду составляет 22.
3.любых условиях его плотность по воздуху всегда равна 0,97.
1.15.Опишите процедуры, которые нужно провести (расчеты и действия) для приготовления
4.1%-ного раствора перманганата калия.
5.10%-ного раствора соляной кислоты (r = 1,05) исходя из 36%-ного (r = 1,18).
6.30%-ного раствора серной кислоты (r = 1,07) исходя из 95%-ного (r=1,83).
1.16.Определите состав продуктов сгорания в сосуде, где находились в равных массовых количествах кислород и
| 1.С. | 2.Н2. | 3.S. |
1.17.Определите формулу вещества, состав которого (%):
| 1.С — 75,0, Н — 25,0. | 2.С — 92,3, Н — 7,7. | 3.О — 94,1, Н — 5,9. |
1.18.Что такое
1.парциальное давление газа? Чему равны парциальные давления газов-компонентов воздуха?
2.относительная влажность воздуха? В каких пределах она может меняться?
3.абсолютная влажность воздуха? В каких пределах она может меняться?
4.идеальный газ? Может ли он в принципе существовать (иными словами, не заключена ли в его определении невозможность его существования)?
5.универсальная газовая постоянная (физический смысл)? Откуда она известна, если идеального газа не существует?
1.19.Откуда известен молярный объем идеального газа? С какой точностью он определен?
1.20.Что такое
1.атомная масса?
2.относительная атомная масса?
1.21.Может ли атомная масса элемента быть
1.больше массового числа самого тяжелого его изотопа? Обратите внимание на Не, U.
2.меньше массового числа самого легкого его изотопа? Обратите внимание на О.
1.22.Определите металл, если при взаимодействии с избытком
1.воды металла массой 0,0249 г выделилось 38,67 мл собранного над водой газа (99,0 кПа, 19°С).
2.соляной кислоты металла массой 0,1179 г выделилось 49,53 мл собранного над водой газа (100,0 кПа, 25°С).
3.гидроксида натрия металла массой 0,1168 г выделилось 44,14 мл собранного над водой газа (102,0 кПа, 23°С).
| Давление насыщенного водяного пара | |||||||||
| Температура, °С | |||||||||
| Давление, кПа | 1,4 | 1,6 | 1,8 | 2,1 | 2,3 | 2,6 | 3,0 | 3,4 | 3,8 |
1.23.Рассчитайте минимальное количество (объем) 30%-го раствора гидроксида натрия (r = 1,33 г/см3), необходимого для получения 40 мл водорода, собранного над водой при 19°С и давлении 101 кПа, путем действия на
| 1.алюминий. | 1.цинк. | 2.кремний. |
1.24.Рассчитайте количество (объем) 30%-ной соляной кислоты (r = 1,15 г/см3), необходимой для получения 40 мл водорода, собранного над водой при 19°С и давлении 101 кПа, путем действия на
| 1.алюминий. | 3.цинк. | 4.железо. |
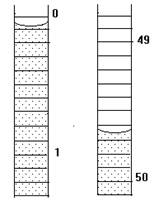
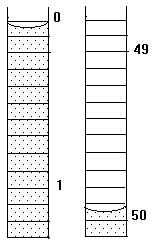
1.25.Начальное положение мениска воды в бюретке показано на рисунке слева, а конечное – справа. Каков объем выделившегося газа?
| 1. | 2. | 3. |
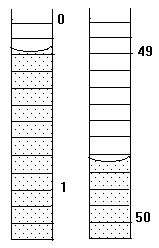
| 
| 
|
1.26.Указанный химический состав соединения принадлежит дальтониду или бертоллиду? Как сохраняется нейтральность вещества в этих соединениях?
1.Оксид титана (III). Может содержать от 59 до 61 ат.% О.
2.Оксид титана (IV). Может содержать от 65,5 до 66,0 ат.% О.
3.Оксид железа (II). Может содержать от 52 до 57,0 ат.% О.
4.Хлорид натрия. Может содержать от 49,95 до 50,00 ат.% Cl.
Тема 2. Элементы химической термодинамики
Энтальпия
Определения и утверждения