Эпидуральные инъекции в лечении вертеброгенного корешкового синдрома
А.Г.БеленькийРМАПО, Москва
Вертеброгенный корешковый синдром (ВКС) представляет собой одну из частых причин нарушения здоровья среди взрослого населения. Современная концепция ВКС предполагает участие в его патогенезе механического, воспалительного, рефлекторного компонентов и вторичных изменений собственно нервных стволов
Структуры, поражающиеся при вертеброгенных заболеваниях, связаны в первую очередь с нижними отделами спинного мозга. Передние и задние корешки, располагающиеся на пояснично-крестцовом уровне интрадурально, спускаются вниз, образуя конский хвост, который окружен оболочками и находится в субарахноидальном пространстве в спинномозговой жидкости. Кнаружи от субарахноидального пространства располагается твердая мозговая оболочка, внутренняя пластинка которой является собственно оболочкой спинного мозга и конского хвоста, а наружная образует надкостницу на всем протяжении позвоночного канала. Передние и задние корешки покидают дуральный мешок и на уровне межпозвонковых отверстий образуют собственно корешковые нервы. Пространство между мешком твердой мозговой оболочки и костными стенками спинномозгового канала, обозначаемое как эпидуральное, заполнено рыхлой жировой клетчаткой. По обеим сторонам от средней линии в эпидуральной клетчатке находятся корешки спинного мозга, которые, направляясь из подоболочечного пространства к межпозвонковым отверстиям, пересекают на своем пути задние отделы межпозвонковых дисков. Экстрадуральные отделы корешков менее подвижны, чем интрадуральные, что создает преимущественные условия для их сдавления при каких-либо объемных процессах в спинномозговом канале. Они фиксированы в проксимальных участках переходящей на них манжеткой твердой мозговой оболочки, а на периферии – связками, окружающими корешковый нерв при выходе из позвоночного канала. Внутри дурального мешка корешки конского хвоста располагаются компактно, экстрадуральные отрезки находятся на значительном расстоянии друг от друга. Нижние поясничные диски пересекаются с каждой стороны одним корешком, разноименным по отношению к диску. Поэтому при выпячивании диска создаются условия для сдавления отдельного корешка. Отклоняясь кнаружи и направляясь вниз, корешки на уровне диска нередко частично или даже полностью прикрыты передневнутренними краями верхних суставных отростков позвонков. Сдавление корешка и корешкового нерва может происходить в эпидуральном пространстве (задняя протрузия диска) и межпозвонковом отверстии (фораминальная грыжа диска, уменьшение диаметра отверстия за счет сближения костных стенок). В межпозвонковом отверстии корешок занимает лишь 1/6–1/4 объема, остальное пространство заполнено кровеносными и лимфатическими сосудами, симпатическими волокнами и рыхлой соединительной тканью. Поэтому компрессия корешка в межпозвонковом отверстии возможна лишь при значительном уменьшении его размеров (абсолютное уменьшение диаметра канала при спондилолистезе или фораминальной грыже) и/или развитии воспалительного отека окружающей его клетчатки. В межпозвонковом отверстии различают медиальный отдел (так называемый боковой карман позвоночного канала), собственно канал и его латеральный отдел (рис. 1). Опыт многих тысяч операций, выполненных по поводу грыж диска, показал, что наиболее часто выпавший диск сдавливает корешок в позвоночном канале у самого дурального мешка. Кроме грыжи диска возможны и негрыжевые факторы компрессии корешка – "негрыжевой радикулит". Такие компрессии отмечаются у 8% оперируемых, это упомянутое сдавление корешка в "боковом кармане" с частым образованием спаек, варианты с участием дегенеративных изменений суставного отростка, компрессия корешка корнем дужки, утолщенной желтой связкой, аномальными и приобретенными костными выступами позвонков [1]. Однако при всех вариантах вертеброгенной патологии корешка клиническая картина определяется состоянием корешкового нерва, зависящего в свою очередь от степени воспалительного отека, дополнительно сдавливающего корешковый нерв.
Лечение ВКС включает комплексное воздействие на патологический процесс, как правило, с использованием противовоспалительных препаратов. В большинстве случаев эффективными являются покой, прием нестероидных противовоспалительных препаратов (НПВП), периферических миорелаксантов. Однако в упорных случаях или противопоказаниях к применению НПВП (сопутствующая язвенная болезнь желудка или двенадцатиперстной кишки) методом воздействия на воспалительный отек является локальное введение препаратов микрокристаллических глюкокортикостероидов (ГКС) в комбинации с местными анестетиками непосредственно в зону компрессии корешка. Патогенетическим обоснованием такого подхода является воздействие на рефлекторный и воспалительный компоненты патологического процесса. При оценке вклада в лечебный эффект каждого из используемых в комбинации препаратов, основная роль, безусловно, принадлежит ГКС, что было показано в двойных слепых исследованиях сравнительной эффективности эпидурального введения ГКС и анестетика в раздельности, а также их комбинации [2, 3]. Непосредственный эффект процедуры, обеспечиваемый анестетиком, свидетельствует о правильности постановки диагноза и выполнения самой инъекции и предполагает максимальный эффект основного компонента смеси – ГКС.
Широко применяемым вариантом метода локальной инъекционной терапии ВКС являются паравертебральные блокады, техника которых хорошо известна [4]. Результаты паравертебрального введения анестетика с ГКС зависят от локализации сдавления корешка. Данный способ лечения эффективен в случае поверхностной локализации компрессии корешкового нерва – в латеральной части межпозвонкового отверстия, при болях, обусловленных дегенеративно-воспалительными явлениями в дугоотростчатых суставах. При раздражении собственно корешков конского хвоста (задняя протрузия диска) или сдавления корешка в месте входа в межпозвонковое отверстие ("боковом кармане" канала) такой подход часто не приносит результата. В этом случае логичным решением задачи создания терапевтической концентрации препарата в непосредственной близости от патологического очага является эпидуральное введение ГКС.
Метод эпидурального введения лекарственных препаратов предложен Sicard в 1901 г. для анестезии и успешно применяется с этой целью до настоящего времени. В 1953 г. Lievre (через 2 года после сообщения Hollander об эффективности внутрисуставного введения ГКС при ревматоидном артрите) впервые применил эпидуральное введение ГКС в комбинации с анестетиком для лечения ишиаса. С этого времени, т.е. уже более 50 лет, эпидуральные инъекции ГКС применяются как метод лечения упорных люмбоишиалгий. Сам факт, что, несмотря на существование различных точек зрения на его место среди методов лечения ВКС, эпидуральные инъекции ГКС продолжают применяться, свидетельствует о том, что метод прошел проверку временем и сейчас прочно занимает свою нишу в арсенале современных методов лечения данной распространенной патологии.
Рис. 1. Поперечный разрез через поясничный позвонок.
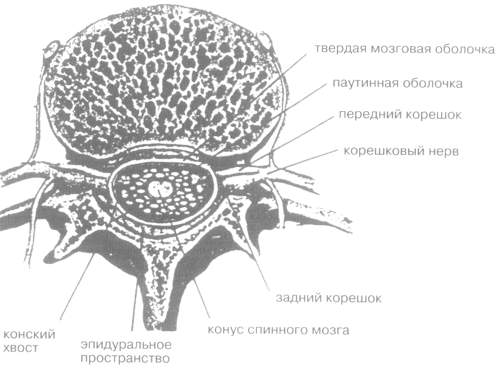
Рис. 2. Схема проведения пункции эпидурального пространства.
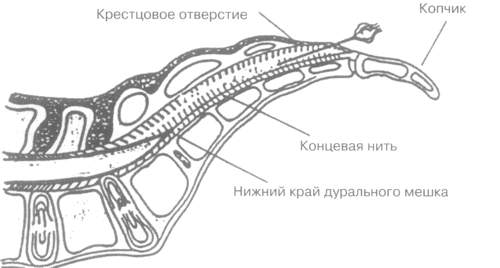
Известно 3 доступа в эпидуральное пространство:
1) интерламинарный или люмбальный доступ – инъекция проводится между дужками поясничных позвонков;
2) сакральный или каудальный – через крестцовое отверстие, расположенное между крестцом и копчиком;
3) транссакральный – через одно из наружных отверстий крестца.
Большинство авторов отдают предпочтение сакральному доступу как технически более простому и имеющему наименьшее количество осложнений. Эпидуральную пункцию проводят в тех же условиях, что и внутрисуставное введение ГКС. Необходимы: средства для дезинфекции кожи, шприцы объемом 5 и 20 мл, иглы длиной 40–50 мм и диаметром 0,8 мм, 0,5% раствор новокаина, разовая доза длительно действующего микрокристаллического препарата ГКС (5 мг бетаметазона дипропионата, 40 мг триамцинолона ацетонида, 80 мг метилпреднизолона ацетата), противошоковый набор (атропин, кордиамин, адреналин, преднизолон). Инъекция может проводиться при нескольких положениях пациента: лежа на кушетке на животе, с вытянутыми или опущенными на пол ногами, на боку, с ногами, согнутыми и приведенными к животу. Крестцовое отверстие (hiatus sacralis) представляет собой естественное "окно" в эпидуральное пространство треугольной формы со средним диаметром около 6 мм и ограниченное по бокам рогами крестца (cornu sacralis). Его находят пальпаторно по ориентирам, которыми служат остистые отростки нижних крестцовых позвонков, рога крестца и сам копчик. Диаметр и форма сакрального отверстия имеют анатомические варианты, в частности у 4% людей крестцовое отверстие отсутствует [5], что может быть причиной неудачных попыток пункции эпидурального пространства через крестцовое отверстие. Убедившись в отсутствии в месте предполагаемой инъекции признаков инфекции или раздражения, кожу обрабатывают дезинфицирующим раствором. Проводят инфильтрационную анестезию места будущей инъекции 2–4 мл 2% раствора лидокаина, от поверхности кожи до "провала" иглы в эпидуральное пространство. Как правило, происходит "пошаговый" поиск иглой крестцового отверстия, но при анестезии процедура неприятных ощущений больному не доставляет. Некоторые авторы рекомендуют проведение пункции эпидурального пространства без анестезии, мотивируя это затруднениями в обнаружении сакрального отверстия после инфильтрации тканей анестетиком [6]. В направлении, показанном на рис. 2, в эпидуральное пространство вводят иглу длиной 40–50 мм (не рекомендуется использовать иглы длиной более 50 мм из-за опасности пункции дурального пространства). После введения иглы осуществляют пробную аспирацию – при появлении в шприце крови или спинномозговой жидкости процедуру прекращают. При пробном давлении на поршень шприца убеждаются в свободном поступлении жидкости, что свидетельствует о нахождении конца иглы в эпидуральном пространстве. Затем вводят основной раствор: разовая доза микрокристаллического ГКС, разведенная в 20–60 мл 0,5% новокаина. Введение значительного объема раствора (40–60 мл) преследует цель "орошения" препаратом максимально большей площади в эпидуральном пространстве. В ряде исследований благоприятные результаты были получены и при использовании меньших объемов раствора – 10–20 мл [2, 7], но в работе, в которой объем вводимого раствора составлял всего 2 мл [8], различий в эффективности между ГКС и плацебо обнаружено не было.
Процедура требует навыков локальной инъекционной терапии, хотя вероятность ошибки невелика. При слишком глубоком введении иглы возможно попадание препарата в субарахноидальное пространство, но данная ошибка предупреждается пробной аспирацией спинномозговой жидкости, получение которой до начала введения ясно укажет на неправильное положение иглы. В случае нахождения конца иглы в пресакральных тканях во время введения ощущается сопротивление и становится заметным появление инфильтрата в мягких тканях крестцовой области. После процедуры пациент самостоятельно встает и находится под наблюдением еще 20 мин. Признаком правильности выполнения процедуры являются исчезновение или значительное уменьшение боли через несколько минут после инъекции, умеренное онемение и "легкость" в нижних конечностях, обусловленные действием анестетика.
Процедура безопасна. Между поверхностью кожи и мембраной, закрывающей крестцовое отверстие, нет ни крупных сосудов, ни нервных стволов. При анализе результатов проведения 75 000 процедур количество серьезных осложнений не превысило 0,05% (коллапс, кровоизлияние в стекловидное тело, эпидуральный абсцесс, арахноидит, ассоциированный с введением в субарахноидальное пространство препаратов, содержащих в качестве консерванта полиэтиленгликоль). Частота легких нежелательных реакций в виде усиления люмбалгии, артериальной гипотензии и головной боли в первые сутки составила в среднем 1,5%. Случаев смерти не было [9]. При неполном или нестойком эффекте процедуру повторяют с интервалом в 3–7 дней до 3 раз. Положительный результат отмечается в 70–80% случаев люмбоишиалгии, резистентных к другим видам терапии, в том числе и при сохранении болевого синдрома после операций по поводу грыжи диска [6]. При этом эффект наблюдался независимо от наличия инструментально подтверждаемых протрузии или грыжи межпозвонкового диска [9].
Большинство ретроспективных [10, 11] и плацебо-контролируемых исследований эффективности эпидурального введения ГКС, в том числе и двойных слепых [2, 7, 12], показало достоверное улучшение состояния пациентов после введения ГКС с длительностью эффекта до 3 мес наблюдения. Обескураживающим, на первый взгляд, выглядит факт, что через 6 и 12 мес каких-либо различий между группами леченых пациентов и контроля не наблюдалось, в том числе и по показателю доли прооперированных больных, составившей 24 и 25% соответственно [7]. Приведенные данные являются, с одной стороны, аргументом против влияния эпидурального введения ГКС на долговременный прогноз люмбоишиалгий, с другой – свидетельствуют о достоверной эффективности эпидуральных инъекций при подостром течении люмбоишиалгии, имеющих и в целом благоприятный прогноз. Отсутствие эффекта эпидуральных инъекций ГКС на долговременный прогноз ВКС отнюдь не уменьшает их терапевтического значения, но говорит лишь об ограниченных возможностях метода, предназначенного в первую очередь для быстрого купирования болевого синдрома, обусловленного воспалительным отеком в зоне сдавления корешка. Очевидно, что при преобладании механических причин сдавления ГКС не имеют места приложения. Предугадать результат процедуры затруднительно, однако среди предикторов неэффективности эпидурального введения ГКС известны: отсутствие влияния на боль изменений положения тела, отрицательный тест Лассега, боль, усиливающаяся при кашле, и массивность предшествующей терапии [11].
Показания к эпидуральному введению ГКС