Электрод сравнения -это электрод, потенциал которого
1) применяется для характеристики окислительно-восстановительных свойств природных
соединений
2) зависит от протекания побочных реакций
3) зависит от активности (концентрации) анализируемых ионов
4) практически постоянен и легко воспроизводим
8. Какое утверждение ошибочно: стеклянный электрод
1) описывается электрохимической схемой:
AgúAgCl|0,1 М раствор HClúстеклянная мембрана
внутренний внутренний
электрод раствор
сравнения,
2) используется для как электрод определения при потенциометрическом определении рН
3) имеет стеклянную мембрану (шарик) из специального стекла-литийбарий силикатного
4) имеет потенциал, который определяется по формуле: е ст. эл. = ео ст. эл+0,059 pH
9. Окислительно-восстановительный потенциал может определяться по уравнению (t = 25 °С):
1) е = е° - 
2) е = е° + 
3) е = е°+ 
4) е = е° - 
10. Величина окислительно-восстановительного потенциала зависит от рН для следующей полуреакции:
1) Fe(CN)63- + 1e-« Fe(CN)64-
2)  О2+ 2Н+ + 2е- « Н2О
О2+ 2Н+ + 2е- « Н2О
3) Zn+2+2e- « Zno
4) AgCl +1e- « Ag + Cl-
11. В гальваническом элемент :Pt, Н2׀ H+| |Ag+׀Ag протекает реакция:
1) Н2 + 2Ag+ = 2Ag + 2Н+
2) 2Ag + 2Н+= Н2 + 2Ag+
3) 2Ag++ 2Н+= Н2 + 2Ag+
4) 2Ag++ 2Н+= Н2 + 2Ag0
Гальваническим элементом (электрохимической цепью) называют
1) устройство, которое превращает химическую энергию в электрическую
2) устройство, для разложения вещества с помощью электричества
3) устройство, состоящее из двух электродов и раствора электролита
4) устройство, состоящее из трех электродов и раствора электролита
13. Для определения рН мочи используется индикаторный электрод:
1) стеклянный - 
2) редокс-PtúSn+4,Sn+2
3) хлорсеребряный - 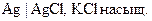
4) серебряный- 
14. Электрохимическая схема цепи, составленной из стеклянного и хлорсеребряного электродов для измерения рН – это :
1) AgúAgCl |0,1 М HClúстеклянная мембрана|исследуемый раствор|| С1-,AgCl |Ag
pH-?
2) С1-,AgCl |Ag||исследуемый растворúстеклянная мембранаú 0,1М HClú AgCl |Ag
pH-?
3) Ag|AgCl |0,1 М HClúстеклянная мембрана|исследуемый раствор|| Ag, AgCl | Сl¯
pH-?
4) Ag|AgCl |Сl¯||исследуемый растворúстеклянная мембранаú 0,1М HClú AgCl |Ag
pH-?
Внутренняя поверхность клеточной мембраны в состоянии физиологического покоя заряжена
1) положительно
2) заряд может быть любым
3) не заряжена
4)отрицательно
16. Продукты коррозии луженого железа в растворе соляной кислоты:
1) FeO,Fe(OH)2
2) FeCl2,H2
3) SnO, Sn(OH)2
4) SnCl2, H2
Для защиты цинковых изделий от электрохимической коррозии в качестве катодного покрытия используют
1) марганец
2) алюминий
3) хром
4) магний
Продукты электролиза раствора иодида калия
1) H2, K, I2, KOH
2) K, I2, KOH
3) H2, I2, KOH
4) H2, K, HI
| Вариант 3 | ||||||||||||||||||
Часть В
| B-1 | а) Составить электрохимическую схему из двух электродов: водородного (ан+= 0,001 моль/л, Рн2= 101,3 кПа, Т = 298 К) и ртутно-каломельного (e = 0,245 В); б) Написать уравнения реакций, протекающих на электродах и в цепи; в) Вычислить ЭДС цепи. |
| B-2 | а) Определить направление окислительно-восстановительной реакции 2KI + H2O2+ H2SO4 ↔ I2+ K2SO4 + 2H2O, если e0(H2O2, H2O) =1,776 B, e0(I2, 2I-) = 0,536 В: б) Составить гальванический элемент, в котором протекала бы эта реакция. |
| B-3 | Определить рН молока, если ЭДС цепи, составленной из стеклянного электрода (e0ст.эл.= 0,400 В) и хлорсеребряного (e0хс(нас) = 0,201 В), равна - 0,207 В (Т = 298 К). |
Вариант 4
Часть А
1. Уравнение Нернста е = е° +  ln
ln  определяет величину:
определяет величину:
1) мембранного потенциала
2) контактного потенциала
3) диффузионного потенциала
4) электродного потенциала
2. Величина потенциала маргацевого электрода в 0,01 М растворе Mn(NO3)2 при Т=298К (е0= -1,18В) равна:
1) -1,239В
2) -1,121В
3) -1,150В
4) -1,210В
3. Чем левее металл расположен в ряду напряжения (электрохимическом ряду), тем:
1) выше его стандартный электродный потенциал
2) сильнее окислительные способности его катионов
3)сильнее его восстановительные способности
4) больше электрическая подвижность катионов
4. Электрохимическая схема стандартного водородного электрода:
1) Pt,H2(  = 101,3 кПа;) |2Н+ (
= 101,3 кПа;) |2Н+ (  =0, 1 моль/л)
=0, 1 моль/л)
2) Pt,H2(  = 101,3 кПа; Т = 298 К ) |2Н+ (
= 101,3 кПа; Т = 298 К ) |2Н+ (  = 1 моль/л)
= 1 моль/л)
3) Pt,H2(  = 101,3 кПа; Т = 298 К ) |2Н+ (
= 101,3 кПа; Т = 298 К ) |2Н+ (  =0, 1моль/л)
=0, 1моль/л)
4)Pt,H2( =101,3 кПа) |2Н+ (
=101,3 кПа) |2Н+ (  = 1 моль/л)
= 1 моль/л)
5. Зависимость величины потенциала водородного электрода от рН раствора (при 25°С) выражается формулой:
1) 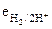 = 0,400 – 0,059рН
= 0,400 – 0,059рН
2) 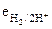 = 0,400 + 0,059 рН
= 0,400 + 0,059 рН
3) 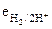 = + 0,059 рН
= + 0,059 рН
4) 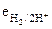 =- 0,059 рН,
=- 0,059 рН,
6. Какое утверждение ошибочно: хлорсеребряный электрод:
1) используется для определения ПР труднорастворимых соединений
2) имеет стандартный потенциал равный 0,222В
3) описывается электрохимической схемой: Ag| AgCl, Сl-
4)характеризуется полуреакцией Ag+ + le-«Ag°