Работа 20. Выделение муцина из слюны и изучение его свойства
(2часа)
Цель занятия - выделит муцин из слюны и изучить его свойства.
Содержание работы. Выделить муцин из слюны, осадив его раствором уксусной кислоты, провести бизретовую реакцию и реакцию с α-нафтолом, подтверждающую наличие моносахаридов в муцине.
Подготовка к занятиям. Необходимо знать классификацию белков - протеидов, их физические и химические свойства.
Литература [ 2,с.161-169; 4,с.91-95; б.с.92-98; 7, с. 131; 8, с. 102-107].
Вопросы для самоконтроля
1. Какие белки относятся к гликопротеидам? Приведите примеры.
2. Какие мукополисахариды Вы знаете?
3. Какими свойствами - кислыми или основными - обладает муцин?
4. В каких раствора муцин осаждается, а в каких - растворяется?
5. В каких секретах содержится муцин?
Аппаратура и реактивы: штатив с пробирками, стеклянные палочки, уксусная кислота (1%-ный раствор), гидроксид натрия (10%-ный раствор), соляная кислота (0,1%-ный раствор), сульфат меди (1%-ный раствор), ос-нафтол (0,2%-ный раствор), серная кислота концентрированная.
Ход работы
В три пробирки собрать по 1-2 мл слюны и добавить в каждую по каплям 1%-ный раствор уксусной кислоты до появления сгустков муцина. Осадок муцина в пробирках осторожно промыть водой, придерживая сгусток палочкой.
После промывания к сгустку муцина в первой пробирке добавить 1 мл 10%-ного раствора едкого натрия, размешать и после растворения провести биуретовую реакцию. Для этой цели добавить еще 5-6 капель едкого натрия и 1-2 капли сернокислой меди. Пробирку встряхнуть и наблюдать появление розовой или фиолетовой окраски.
Во вторую пробирку прилить 1 мл 0,1%-ного раствора соляной кислоты и наблюдать растворение осадка.
В третью пробирку к сгустку муцина добавить 5-6 капель α-нафтола, смешать и осторожно добавить концентрированную серную кислоту. На границе двух слоев жидкости появляется фиолетовое окрашивание, подтверждающее наличие в муцине моносахаридов.
Вместо α-нафтола можно взять 1%-ный раствор тимола, образуется более отчетливое красное кольцо.
Контрольные вопросы
1. В чем суть качественной реакции на моносахариды муцина?
Работа 21. Гидролиз нуклеоиротеидов дрожжей (2часа)
Цель занятия - изучить химический состав нуклеопротеидов.
Содержапие работы. Провести кислотный гидролиз дрожжей и открыть продукты гидролиза - полипептиды, гетероциклические основания, углеводы и фосфорную кислоту.
Подготовка к занятиям. Знать строение сложных белков - протеидов нуклеиновых кислот, их роль в биосинтезе белков, передаче
наследственной.
Литература [2, С.164; 4, С. 91-94; 6, С. 99-108; 7, С.127-129: 8, С. 102-106].
Вопросы для самоконтроля
1. Какие белки относятся к нуклеопротендам?
2. Какие простые белки входят в состав нуклеопротендов?
3. Какие вещества образуются при полном гидролизе нуклеопро-теитов? Приведите схему гидролиза.
Аппаратура и реактивы: штатив с пробирками, пипетки, колба с обратным холодильником, воронка, спиртовка, фильтр, стакан химический на 100 мл, дрожжи прессованные, 5% -ный раствор серной кислоты, 10 %-ный раствор NaОН, 1% -ный раствор сульфата меди, молибденовокислый аммоний.
Ход работы
Проведение гидролиза. В колбу для гидролиза поместить 5 г дрожжей, добавить 15 мл 5%-ного раствора серной кислоты. Колбочку закрыть пробкой с обратным холодильником и осторожно кипятить в течение часа. После охлаждения гидролизат отфильтровать в химический стакан и использовать для анализа продуктов гидролиза.
Обнаружение простых белков. В пробирку налить 5 капель гидролизата. добавить 10 капель 10% -ною раствора NаОH и одну каплю 1%-ного раствора сульфата меди. Пробирку встряхнуть и наблюдать положительную биуретовую реакцию (розовая или фиолетовая окраска).
Открытие пентоз (рибозы и дезоксирибозы). В пробирку налить 5 капель гидролизата, добавить 5 капель раствора NаОН и 5 капель раствора сульфата меди до появления неисчезающего осадка гидроокиси меди Сu(ОН)2 Жидкость встряхнуть и нагреть до кипения. Наблюдать появление желтого или красного осадка.
Открытие фосфорной кислоты. В пробирку налить 10 капель молибденового реактива, добавить 5 капель гидролизата и кипятить на пламени горелки. В присутствии фосфорной кислоты жидкость окрашивается в лимонно-желтый цвет. Пробирку охладить под струей холодной воды и наблюдать выпадение желтого кристалического осадка комплексного соединения фосфорно-молибденового аммония:
12(NH4)2МgO4 + Н3РO4+ 21НNO3 → 21NН4NO3 + (NН4)3PO ∙ 12H2O + 12Н2O
Контрольные вопросы.
1 .В чем суть биуретовой реакции?
2.Какие азотистые основания образуются при гидролизе нуклео-протеидов?
3.Какие ткани богаты дезоксирибокуклеопротеидами?
Работа № 22. Получение мочевой кислоты из помета голубей и изучение ее свойств (3 часа)
Цель занятия - получить мочевую кислоту из голубиного помета, изучить ее свойства.
Содержание работы. Выделить мочевую кислоту из помета голубей, рассмотреть кристаллы мочевой кислоты под микроскопом, проделать качественную реакцию на мочевую кислоту и изучить ее свойства.
Подготовка к занятию. Изучить конечные продукты белкового обмена у птиц, рептилий, млекопитающих, химическое строение и свойства мочевой кислоты.
Литература [2, с. 134-138; 4, с. 282].
Вопросы для самоконтроля
1. Напишите структурную формулу мочевой кислоты.
2. Почему у птиц и рептилий конечным продуктом белкового обмена является мочевая кислота, а не мочевина?
3. Что такое подагра?
Аппаратура и реактивы: штатив с пробирками, ступка с пестиком, воронка, ватный и бумажный фильтры, плитка, кипящая водяная баня, микроскоп, предметные стекла, углекислый калий, соляная кислота (1 : 15). 0,1 н. раствор щелочи, серный эфир, сульфат меди, концентрированная азотная кислота, концентрированный раствор аммиака.
Ход работы
Отвесьте 2 г сухого голубиного помета и тщательно разотрите его в порошок в фарфоровой ступке. Перенесите порошок в колбу на 250 мл, добавьте 2 г углекислого калия (К2СO3) и 60 мл дистиллированной воды. Прокипятите смесь, горячую жидкость с помощью воронки и ватного фильтра профильтруйте в другую колбу, в которую предварительно влейте 50 мл раствора соляной кислоты (1 часть кислоты в 15 частях воды). Дайте жидкости отстояться в течение 30 мин. Отфильтруйте осадок с помощью бумажного фильтра. Осторожно промойте осадок холодной водой. Осторожно возьмите стеклянной палочкой часть осадка с фильтра, поместите его в кайлю дистиллированной воды на предметное стекло и рассмотрите в микроскоп. Зарисуйте увиденное.под микроскопом. Оставшийся осадок перенесите и фарфоровую чашечку и высушите на кипящей бане. С чистой мочевой кислотой заводского приготовления проделайте следующие реакции: на растворимость ее в различных растворителях, на восстановление и мурексидную пробу.
Контрольные вопросы
1. Почему для выделения мочевой кислоты Вам был предложен помет голубей, а не моча крупного рогатого скота?
2. Что можно сказать о растворимости мочевой кислоты в различных растворителях?
3. Для чего нужен К2СО3 при выделении мочевой кислоты из помета голубей'.'
4. На основании чего Вы можете заключить, что полученное Вами вещество является мочевой кислотой?
5. Почему у вегетарианцев меньше шансов заболеть подагрой?
Работа № 23. Патологические составные части мочи (2 часа)
Цель занятия - изучить реакции обнаружения патологических составных частей мочи, исследовать образец мочи животного и сделать вывод о состоянии его здоровья.
Содержание работы: проделать реакции обнаружения в моче белка, сахара, ацетона, желчных пигментов.
Подготовка к занятию: изучить по литературе химический состав мочи и ее патологические составные части.
Литература [2, с. 460-466; 4, с. 330-332; 7. с. 206-209].
Вопросы для самоконтроля
1. Какие вещества относятся к патологическим частям мочи?
2. Какие состояния принято называть альбуминурией, глюкозу-рией, кетонурией?
3. Что является причиной альбуминурии, глкжозурии, кетонурии?
4. Что является причиной повышенного содержания в моче уробилина?
Аппаратура и реактивы: спиртовка, штатив с пробирками (6 шт.) воронка, фильтр, синяя лакмусовая бумага, глазные пипетки. 2%-ный раствор уксусной кислоты, 50%-ный раствор НNO3, 10%-ный раствор NaОН, 5%-ный раствор СиSO4, раствор йода в йодистом калии.
Ход работы
К патологическим составным частям мочи относятся; белок сахар, ацетоновые тела, желчные пигменты, кровь и другие вещества.
1. Обнаружения белка
Проба с кипячением. В пробирку взять 3-5 мл мочи. При помощи синей лакмусовой бумажки определить ее реакцию. Если моча щелочная, довести ее реакцию до слабокислой путем осторожного при-ливания 2%-ного раствора уксусной кислоты (пользуйтесь синей лакмусовой бумагой). Содержимое пробирки взболтать и подогреть до кипения на спиртовке. При наличие в моче белка, в зависимости от его количества в нагретой части образуются: опалесценция, муть или хлопья от коагулированного белка.
Проба с азотной кислотой. В пробирку налить 1-2 мл 50%-ного раствора азотной кислоты, на которую осторожно наслоить, приливая по стенке пробирки, профильтрованную мочу так, чтобы получилось два несмешивающихся слоя: внизу - азотная кислота, наверху - моча. По линии соприкосновения жидкостей при наличии в моче белка образуется мутный белый слой или, как его обыкновенно называют, белое кольцо, состоящее из свернувшегося белка.
Если состав мочи в норме, то на границе жидкостей может появиться красное кольцо в результате изменения мочевых пигментов под влиянием азотной кислоты. Иногда мутное кольцо появляется выше границы. Такое явление может зависеть от выпадения осадков кислых, мочекислых солей, или муцина мочи.
2. Обнаружение сахара с помощью качественной пробы Троммера
В пробирку налить 2-3 мл мочи, прибавить равный объем 10%-ного раствора едкого натра и затем осторожно по каплям 5% -ный раствор сернокислой меди до появления небольшой, неисчезающей при взбалтывании голубой мути - гидрата окиси меди. Затем жидкость в верхней части пробирки нагреть до кипения.
Реакцию на сахар считать положительной при появлении желтого осадка гидроксида меди (I) или красного осадка оксида меди (I) не позже, чем через минуту после прекращения нагревания.
3. Обнаружения ацетона
В пробирку налить 2-3 мл мочи, прибавить несколько капель 10%-ного раствора едкого натра и затем по каплям раствор йода в йодистом калии. При наличии ацетона жидкость делается мутной, вследствие выделения бледно-желтого кристаллического осадка йодоформа, обладающего характерным запахом:
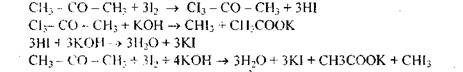
4. Обнаружение желчных пигментов с помощью пробы Гмелина
В пробирку налить 1-2 мл концентрированной азотной кислоты и осторожно прибавить из пипетки по стенке пробирки исследуемую мочу так, чтобы жидкости не смешивались; в месте их соприкосновения образуется ряд цветных колец. Характерным для желчных пигментов является образование верхнего зеленого кольца и одновременно с ним синего или фиолетового. Нижерасположенное желтое и красное кольца получаются и с нормальной мочой. Проделав все указанные реакции с образцом исследуемой мочи, сделайте вывод о состоянии здоровья животного.
Вопросы для самоконтроля
1. Объясните химизм качественной пробы Троммера на сахара.
2. Что происходит с белком, содержащимся в моче, при кипячении, с добавлением концентрированной азотной кислоты?
ЛИТЕРАТУРА
1. Болдырев А.С. Физколлоидная химия. - М., 1983.
2. Кононский А.И. Биохимия животных. - М., 1993.
3. ЛенинджерЛ. Основы биохимии. -М'., 1985.
4. Малахов А.Г., Вишняков СИ. Биохимия сельскохозяйственных животных. - М., 1984.
5. Николаев А.Я. Биологическая химия. - М., 1989.
6. Савронь Е.С. Биохимия животных. - М, 1966.
7. Савронь Е.С. и др. Практикум по биохимии животных. - М., 1967.
8. Фердман Д.А. Биохимия. - М. 1966.
9. Нечеткий А.В. и др. Биохимия животных. - VI.,1982.
10. Уайт А. и др. Основы биохимии. - М„ 1985.
СОДЕРЖАНИЕ
Введение...................................................................................... 3
Рекомендации но выполнению лабораторных работ и составлению отчета. 3 Работа 1 Определение активной кислотности и буферных свойств
некоторых биологических жидкостей 4
Работа 2. Сравнительное действие неорганических катализаторов и
ферментов....................................................................... 6
Работа 3. Специфичность действия ферментов..................................... 7
Работа 4. Термолабильность ферментов.......................................... 9
Работа 5. Влияние рН на действие ферментов......................................... 11
Работа 6. Активирование и торможение действия фермента амилазы.... 12
Работа 7 Качественные реакции на витамины А и С................................ 14
Работа 8 Качественные реакции на витамин Д...................................... 16
Работа 9 Качественные реакции на никотиновую кислоту........................ 17
Работа 10 Качественные реакции на адреналин................................... 18
Работа 11 Качественные реакции на дисахариды.................................... 19
Работа 12 Качественные реакции на полисахариды.................................. 21
Работа 13 Растворение и эмульгирование жиров. Исследование
молока под микроскопом .. ....................................................... 22
Работа 14 Качественные реакции на желчные кислоты............................. 24
Работа 15 Качественные реакции на желчные пигменты........................... 25
Работа 16 Холестерин и определение его в желчи с помощью
реакции Сальковского........................................................... 26
Работа 17 Белки молока................................................................. 27
Работа 18. Выделение альбуминов и глобулинов из белка куриного яйца. 29
Работа 19. Щелочной гидролиз белка................................................. 30
Работа 20. Выделение муцина из слюны и изучение его свойств................ 31
Работа 21. Гидролиз нуклеопротеидов дрожжей.................................... 32
Работа 22. Получение мочевой кислоты из помета голубей и
изучение ее свойств.................................................................... 34
Работа 23 Патологические составные части мочи................................... 35
Литература................................................................................... 38