ПРИГОТОВЛЕНИЕ СУСПЕНЗИЙ ИЗ ВЕЩЕСТВ С ГИДРОФОБНЫМИ СВОЙСТВАМИ
Различают 2 группы веществ:
I. С нерезко выраженными гидрофобными свойствами: терпингидрат, фенилсалицилат, сульфаниламидные препараты и др.
II. С резко выраженными гидрофобными свойствами: камфора, ментол, тимол, сера и др.
Для приготовления суспензий из гидрофобных веществ необходимо использовать стабилизатор. Количество используемого стабилизатора зависит от степени гидрофобности веществ (таблица 14.2).
Таким образом, в зависимости от природы диспергируемого гидрофобного вещества, защитного ВМС берется половинное или равное количество.
Таблица 14.2. - Характеристика стабилизаторов суспензий
| Стабилизатор | Количество на 1,0 лек вещества | |
| I | II | |
| Желатоза | 0,5 | 1,0 |
| Аравийская камедь (Гуммиарабик) | 0,5 | 1,0 |
| Абрикосовая камедь | 0,25 | 0,5 |
| Метилцеллюлоза в виде 5% раствора | 0,5 | 1,0 |
Камфора - вещество с резко выраженными гидрофобными свойствами. Для приготовления суспензии требуется добавление стабилизатора. Если используют 5% раствор метилцеллюлозы, то на 1.0 камфоры его берут 1,0 г, на 1,5 г камфоры - 1,5 г раствора. Содержание веществ до 3%, поэтому готовят суспензию массо-объемным методом. Отмеривают в подставку 140 мл воды, прибавляют 10 мл раствора натрия бромида (1:5). Отвешивают и помещают в ступку 1,5 камфоры и на пергаментную капсулу 1,5 г 5%-го раствора метилцеллюлозы. Камфору измельчают в ступке в присутствии 15 капель спирта и, не дожидаясь его улетучивания, добавляют 1,5 г раствора. Перемешивают и прибавляют воду очищенную в половинном количестве от суммы камфоры и раствора МЦ(~ 1,5). Растирают пестиком до характерного потрескивания (образование пульпы). Полученную пульпу разбавляют водой и переносят во флакон для отпуска. Добавляют 10 мл адонизида. Оформляют к отпуску. Этикетка "Внутреннее", "Перед употреблением взбалтывать". Суспензии хранят в аптеке 3 суток.
В настоящее время разработаны составы и технология 2% суспензий сульфамоно- и сульфодиметоксина - веществ с нерезко выраженными гидрофобными свойствами. В качестве стаблизатора используют твин-80 и поливинол. На 2,0 сульфади- и сульфомонометоксина берут стабилизаторов соответственно 0,2, 2,0 и 0,05, 1,0 в 100 мл суспензии. Срок хранения 3 месяца.
Для сульфаниламидных препаратов было установлено, что устойчивые суспензии образуются при добавлении 30% сахарного сиропа, но такое добавление нежелательно, так как происходит изменение терапевтической активности. Разрешается готовить суспензию без стабилизатора, если в рецепте прописан сахарный сироп. Добавление стабилизатора не требуется, если в рецепте прописан спирт строго определенной концентрации:Для этазола не менее 43% Для норсульфазола не менее 24% Для сульфадимезина не менее 18% Для ксероформа не менее 20%
При изготовлении суспензий гидрофобных веществ с резко выраженными свойствами рекомендовано добавление спирта при диспергировании. Если этанол добавлен в количестве, достаточном для растворения вещества, то при его испарении происходит явление рекристализации, и вещество распределяется в виде мельчайших частичек.
Особого подхода требует изготовление суспензии серы. Применения для стабилизации серы общепринятых стабилизаторов нецелесообразно, так как они уменьшают фармакологическую активность серы. В качестве стабилизатора суспензии серы для наружного применения рекомендуют мыло медицинское в количестве 0,1-0,2 на 1,0 серы. С медицинской точки зрения добавление мыла целесообразно, так как оно разрыхляет поры кожи, являясь ПАВ, и способствует глубокому проникновению серы, которую используют при лечении чесотки и других кожных заболеваний. Мыло в качестве стабилизатора рекомендуется применять только по указанию врача.
В рецептах с серой часто прописывают глицерин и спирт (концентрация должна быть выше 54%), которые являются стабилизаторами суспензии.
Билет №14
1.Теоретические основы растворения. Тепловой эффект растворения. Понятие «растворимость веществ» (ГФ РБ).
Большинство твердых веществ являются кристаллическими веществами. Процесс растворения кристаллического вещества состоит из двух одновременно протекающих процессов: сольватации (гидратации) частиц и разрушения кристаллической решетки.
Для эффективности растворения важно, чтобы силы сцепления между молекулами растворителя и частицами растворяемого вещества были больше сил взаимного притяжения этих частиц между собой. Вода по сравнению с другими растворителями обладает огромной полярностью (самое высокое значение диэлектрической постоянной). Именно этим свойствам обусловливаются высокая ионизирующая способность воды и ее разрушительное действие на кристаллические решетки многих полярных соединений.
При растворении веществ наблюдается поглощение или выделение теплоты. Поглощение теплоты указывает на затрату энергии. Объясняется это тем, что на перевод вещества из твердого состояния в жидкое, т.е. на разрушение кристаллической решетки, обязательно расходуется энергия. После же растворения ионы получают возможность относительно свободно двигаться внутри раствора, для чего необходимо увеличение их кинетической энергии. Увеличение ее происходит за счет отнятия энергии у растворителя в форме тепла, в результате чего происходит охлаждение раствора. Чем прочнее кристаллическая решетка, тем значительнее охлаждение раствора.
Выделение тепла при растворении веществ всегда указывает на активно протекающую сольватацию, т.е. образование соединений между растворимым веществом и растворителем.
Конечный тепловой эффект растворения (Q) нужно рассматривать как сумму двух слагаемых - положительного теплового эффекта сольватации (g) и отрицательного теплового эффекта разрушения кристаллической решетки (-с):
Q = g + (-с)
Знак теплового эффекта растворения будет зависеть от того, какое слагаемое преобладает. Если кристаллическая решетка прочна, то слагаемое (-с) численно больше g; в этом случае растворение вещества будет проходить с поглощением тепла. Наоборот, у веществ с непрочной кристаллической решеткой и сильно сольватируемых (гидратируемых) превалирует слагаемое g; при этом растворение будет проходить с выделением тепла. Часто положительный и отрицательный тепловые эффекты растворения оказываются одинаковыми или очень близкими друг к другу; в таких случаях при растворении мы не замечаем охлаждения или разогревания раствора.
Растворимость - это способность веществ растворяться в воде или других растворителях. Для обозначения растворимости веществ ГФ РБ (Т. I, С. 19-20) приняты описательные термины, которые имеют смысл в температурном интервале от 15 до 25оС (таблица 6.1.).
| Условные термины | Примерное количество растворителя (мл), необходимое для растворения 1 г вещества |
| Очень легко растворим Легкорастворим Растворим Умеренно растворим Малорастворим Очень мало растворим Практически не растворим | До 1 От 1 до 10 От 10 до 30 От 30 до 100 От 100 до 1000 От 1000 до 10 000 Более 10 000 |
| Частично растворим | Термин используется для характеристики смесей, содержащих как растворимые, так и нерастворимые компоненты |
| Смешивается с….. | Термин используется для характеристики жидкостей, смешивающихся с указанным растворителем во всех соотношениях |
Конденсационный метод изготовления суспензий: характеристика, область и особенности применения. Правила добавления к водным растворам Нашатырно-анисовых капель, настоек, жидких экстрактов и спиртовых растворов ЛВ.
В основе метода лежит принцип соединения молекул в более крупные частицы - агрегаты, имеющие размеры, типичные для суспензий.
Он включает:
I. метод замены растворителя;
II. метод химического диспергирования.
Метод замены растворителя: суспензия образуется при добавлении к водным растворам настоек, жидких экстрактов, других галеновых препаратов, спиртовых растворов, лекарственных средств, содержащих эфирные масла. При добавлении этанольных растворов к водным происходит выделение нерастворимых в воде веществ. Экстракционные средства добавляют в последнюю очередь. Замена растворителя осуществляется в большом объеме раствора, происходит резкое изменение концентрации этанола, в результате чего образуется много центров кристаллизации. Получается мелкодисперсная взвесь, которая длительно находится во взвешенном состоянии, легко дозируется.
По методу замены растворителя получаются более тонкие суспензии, чем при механическом диспергировании. Внешне это муть (размер частиц 0,1-1 мкм).
Приготовление суспензий этим методом включает стадии: приготовление раствора сухих веществ, процеживание в склянку для отпуска, добавление спиртосодержащих жидких лекарственных средств в следующей последовательности: - все водные не пахучие и нелетучие жидкости; спиртосодержащие по мере увеличения крепости спирта.
Метод химического диспергирования - основан на реакции химического взаимодействия двух и более веществ, хорошо растворимых в воде в отдельности, а при совместном присутствии в растворе образующих соединения, не растворимое в воде.
Различают два способа приготовления суспензий этим методом:
а) Растворитель делят на равные части, растворяют вещества по отдельности и оба раствора процеживают во флакон для отпуска через разные фильтры.
б) В ступку помещают вещества, добавляют минимальное количество растворителя. Образовавшуюся суспензию разбавляют водой и переносят во флакон для отпуска. Предупреждение кристаллизации и увеличения степени дисперсности достигаются путем растирания веществ.
Билет №15
1. Вода как растворитель, требования в соответствии с ГФ и другими нормативными документами. Основные процессы водоподготовки.
Вода очищенная - Aqua purificata Требования к качеству, ГФ РБ, т.2, с. 99:
общее содержание примесей (сухой остаток) не должно превышать 0,001%, Общий орг. углерод – не более 0,5 мг/л Нитратов - не более 0,00002% (0,2ррм), алюминия – не более 0,000001% (10 мкг/л), солей тяжелых металлов – не более 0,00001% (0,1 ррм) Ограничения в содержании других примесей (см. ГФ РБ) Электропроводность: при 20°С мкСм▪см Суммарное количество микроорганизмов (аэробов) – не более100/мл
Водоподготовка
Устранение механических (нерастворимых) примесей: частиц железа, песка речного, кремнекислых и кальциевых коллоидов. Отстаивание. Фильтрация
Устранение примесей органических веществ окисление: добавляют 1% раствор калия перманганата из расчета 25 мл на 10 л воды, перемешивают и отстаивают в течение 6-8 часов. 2КМnО4 + Н2О → 2КОН + ↓2МnО2 + 3О·, органические примеси + О· → Н2О + СО2 Затем воду сливают и фильтруют
Устранение микроорганизмов
Устранение растворимых неорганических веществ
аммиака: 2KAI(SO4)2 + 6NH4OH → 3(NH4)2 SO4 + K2SO4 +↓2AI(OH)3
временной жесткости: Са(НСО3)2 → ↓СаСО3 + Н2О + ↑СО2 (при нагревании образ. накипь)
Са(НСО3)2 + Са(ОН)2 → 2СаСОз ↓+ 2Н2О
Mg(НСО3)2 + Са(ОН)2 → СаСОз ↓+ MgСО3↓ + 2Н2О
декарбонизация: СО2 + Са(ОН)2 = ↓ СаСО3 + Н2О
постоянной жесткости: СаСI2 + Nа2СО3 → ↓СаСО3 + 2 NаСI
МgSО4 + Nа2СО3 → ↓МgСО3 + Nа2SО4
2. Характеристика и свойства коллоидных растворов. Термодинамическая, электростатическая и агрегативная лабильность. Изменения, наблюдаемые в коллоидных растворах под воздействием внешних факторов и при хранении.
Коллоидный раствор – это жидкая лекарственная форма, представляющая собой ультрамикрогетерогенную систему, структурной единицей которой являются мицеллы.
Суспензия – это жидкая лекарственная форма, в которой твердое вещество взвешено в жидкости, предназначенная для внутреннего, наружного и инъекционного применения.
Эмульсия – это жидкая лекарственная форма, состоящая из двух взаимно нерастворимых тонкодиспергированных жидкостей, предназначенная для внутреннего, наружного и инъекционного применения.
Все три лекарственные формы объединяет одно общее свойство. Эти системы гетерогенны. Растворы коллоидов, суспензии и эмульсии мутные не только при боковом освещении, но и в проходящем свете. Они дают конус Тиндаля. В них отсутствует осмотическое давление и диффузия. Броуновское движение выражено слабо. От броуновского движения зависит устойчивость среды. Коллоидные растворы, суспензии, эмульсии неустойчивы.
Гетерогенные системы характеризуются кинетической (седиментационной) и агрегативной (конденсационной) неустойчивостью.
Кинетическая устойчивость - это способность системы сохранять равномерное распределение частиц по всему объему. Суспензии и эмульсии - кинетически неустойчивые системы. Скорость оседания частиц в них описывается формулой Стокса (а устойчивость – это величина, обратная скорости оседания):
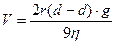 ;
; 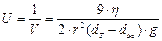 , где r – радиус частиц,dТ - плотность фазы, dЖ - плотность среды,η - вязкость среды,g - ускорение свободного падения.
, где r – радиус частиц,dТ - плотность фазы, dЖ - плотность среды,η - вязкость среды,g - ускорение свободного падения.
Скорость оседания частиц снижается, если разница плотностей дисперсной фазы и дисперсионной среды минимальна. Однако в аптечных условиях применять этот фактор невозможно, так как среда и фаза обозначены прописью рецепта.
Скорость оседания частиц обратно пропорциональна вязкости среды. Для повышения устойчивости системы необходимо вводить вещества с высокой вязкостью - глицерин, сахарный сироп.
Кроме того, скорость оседания частиц можно снизить, уменьшив размер частиц. При этом достигается и максимальный терапевтический эффект лекарственной формы.Уменьшение размера частиц приводит к увеличению суммарной поверхности и свободной поверхностной энергии:  , где: DF – изменение свободной поверхностной энергии, DS – изменение поверхности,s – поверхностное натяжение.
, где: DF – изменение свободной поверхностной энергии, DS – изменение поверхности,s – поверхностное натяжение.
Согласно следствию из 2-го закона термодинамики, система является неустойчивой. Она стремится к минимуму свободной поверхностной энергии. Это уменьшение может быть достигнуто агрегацией частиц.
Агрегативная устойчивость – это способность частиц дисперсной фазы противостоять слипанию.
В суспензиях может проходить процесс флоккуляции (от лат. floke - хлопья). То есть, нарушение агрегативной устойчивости приводит к нарушению кинетической устойчивости. Хлопья могут всплывать или оседать. Осадок может иметь плотную, творожистую, хлопьевидную, волокнистую, кристаллоподобную структуру.
В эмульсиях может наблюдаться явление коалесценции – капельки сливаются, эмульсия расслаивается.
Задачей технолога является обеспечение агрегативной устойчивости гетерогенных лекарственных форм. При этом будет достигнут максимально большой контакт действующего вещества с тканями организма и максимальный терапевтический эффект.
Агрегативная устойчивость обеспечивается наличием заряда на поверхности частиц (диссоциация частиц, адсорбция одноименных ионов), сольватным слоем, оболочкой из ВМС, ПАВ. Вокруг ПАВ тоже образуется сольватный слой. Все эти факторы препятствуют слипанию частиц.
ПАВ – это вещества, способные адсорбироваться на границе раздела фаз. По международной классификации их называют тензидами (от лат. tension - натяжение). Им присуща дифильность. В своей структуре они содержат полярные и неполярные группы. От их соотношения зависит характер поверхностно-активных свойств тензидов. Это соотношение называется гидрофильно-липофильным балансом (ГЛБ).
Значение ГЛБ различных ПАВ определяют экспериментально или рассчитывают по специальным формулам. В 1949 Griffin предложил специальную шкалу. В соответствии со шкалой Гриффина, значение ГЛБ всех известных ПАВ лежит в пределах от 1 до 40. Чем больше в молекуле ПАВ гидрофильных групп, тем выше значение ГЛБ. Самое низкое значение ГЛБ (1) имеет олеиновая кислота, самое высокое (40) - натрия лаурилсульфат. Значения ГЛБ всех остальных ПАВ находятся в пределах от 1 до 40.
Число 10 является границей между липофильными и гидрофильными ПАВ. Малорастворимые ПАВ, дающие эмульсии В/М, имеют ГЛБ менее 10. Чем выше число ГЛБ, тем больше склоннность к образованию эмульсии М/В.
В медицинской практике применяют лекарственные формы защищенных коллоидов. Защищенные коллоиды - это комбинированные средства. Они состоят из высокодисперсного гидрофобного коллоидного компонента и сильногидрофильного высокомолекулярного вещества-стабилизатора.
Адсорбируясь на коллоидной частице, стабилизаторы резко уменьшают поверхностную энергию и тем самым способствуют агрегативной устойчивости коллоидной системы. Благодаря защите, коллоидные растворы приобретают очень ценные свойства - спонтанность растворения и обратимость. В медицинской практике нашли довольно широкое применение 3 коллоидных вещества: протаргол, колларгол, ихтиол.