
Категории:
АстрономияБиология
География
Другие языки
Интернет
Информатика
История
Культура
Литература
Логика
Математика
Медицина
Механика
Охрана труда
Педагогика
Политика
Право
Психология
Религия
Риторика
Социология
Спорт
Строительство
Технология
Транспорт
Физика
Философия
Финансы
Химия
Экология
Экономика
Электроника
Опыт № 2. Влияние температуры на скорость реакции
Лабораторная работа № 1.
Общие закономерности химических реакций.
Цель работы: изучение влияния концентрации, температуры и катализатора на скорость реакций, а также влияния изменения температуры и концентрации реагирующих веществ на химическое равновесие.
Реактивы: тиосульфат натрия, серная кислота, дистиллированная вода, роданид железа, хлорид железа, роданид аммония.
Оборудование: колбочки, мензурка, секундомер, пробирки.
Теоретические основы (к первой части).
Скорость химической реакции - зависимость изменения концентрации одного из реагирующих веществ от времени.
Закон действия масс – скорость реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные соответствующим коэффициентам в уравнении реакции.
Правило Вант-Гоффа – при повышении температуры на каждые 10°C скорость химической реакции возрастает в 2-4 раза.
Катализатор –вещество, которое изменяет скорость химической реакции, причем его состав в конце процесса остается неизменным.
Катализ
 |  |
Гомогенный Гетерогенный
(катализатор и реагирующие (катализатор и реагирующие
вещества образуют однородную вещества находятся в разных
систему) фазах)
Катализ – явление изменения скорости химической реакции в присутствии веществ (катализаторов) состояние и количество которых после реакции не изменяется.
H < 0 – реакция экзотермическая, H > 0 - эндотермическая.
Опыт № 1. Влияние концентрации на скорость реакции.
Ход работы: В трех колбочках приготовили раствор тиосульфата натрия различной концентрации, методом варьирования количества и добавлением дистиллированной воды (3-я колбочка). После в каждую из колбочек добавили одинаковое количество серной кислоты. Растворы в пробирках помутнели в разные промежутки времени.
Уравнение реакции: Na2S2O3+ H2SO4 = Na2SO4 +H2O + SO2 + S
| Номер колбы | Объем, см3 | Относительная концентрация Na2S2O3 | Промежуток времени от начала отсчета до помутнения t, c | Относительная скорость реакции V= 1/t | ||
| Раствора Na2S2O3 | H2O | Раствора H2SO4 | ||||
| 0,05 | ||||||
| 0, 018 | ||||||
| 0, 005 |
 График.
График.
 V
V
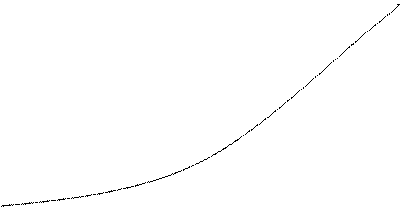 |
 0,05
0,05
0,018
0,005
C
Вывод:С увеличением концентрации возрастает скорость реакции.
Опыт № 2. Влияние температуры на скорость реакции.
Ход работы: Для данного опыта используются та же реакция, разве что концентрация во всех трех колбочках и тиосульфата и серной кислоты одинакова, различна лишь температура, при которой проходила каждая из реакций.
Уравнение реакции: Na2S2O3+ H2SO4 = Na2SO4 +H2O + SO2 + S
| Номер опыта | Температура опыта, °С | Промежуток времени от начала отсчета до помутнения t, c | Относительная скорость реакции V= 1/t |
| 0,01 | |||
| 0,02 | |||
| 0,03 |
Вывод: При повышении температуры на каждые 10 °С скорость реакции возрастает.