
Категории:
АстрономияБиология
География
Другие языки
Интернет
Информатика
История
Культура
Литература
Логика
Математика
Медицина
Механика
Охрана труда
Педагогика
Политика
Право
Психология
Религия
Риторика
Социология
Спорт
Строительство
Технология
Транспорт
Физика
Философия
Финансы
Химия
Экология
Экономика
Электроника
Стандартизация раствора комплексона III
Лабораторная работа № 12
Цель работы – установить точную концентрацию раствора комплексона III.
Сущность работы. Основным рабочим раствором комплексонометрии является раствор комплексона III (ЭДТА, трилон Б). Для его приготовления применяют динатриевую соль этилендиаминтетрауксусной кислоты Na2C10H14O8N2·2H2O. Обычно его точную концентрацию устанавливают по раствору соли цинка. Определение основано на реакции взаимодействия комплексона III с ионами цинка в среде аммиачного буфера. К. т. т. фиксируется с помощью индикатора эриохрома черного Т:
Zn2+ + H2Y2– = ZnY2– + 2H+.
Лабораторная посуда: мерная колба; бюретка, пипетка Мора, мерный цилиндр, конические колбы.
Реактивы: ~0,05 н. раствор комплексона III (трилона Б); кристаллический ZnSO4, х.ч.; аммиачный буфер с рН 9; индикатор эриохром черный Т в смеси с NaCl 1:100.
Выполнение работы.
Рассчитывают ориентировочную массу установочного вещества – ZnSO4, необходимую для приготовления 100,0мл 0,05 н. раствора;
mтеор = C·V·M·fэкв =
Навеску ZnSO4 в количестве, отличающемся не более чем на 10 % от расчетного, взвешивают в тигле на технических, а затем на аналитических весах. Навеску аккуратно пересыпают через сухую воронку в мерную колбу и струей дистиллированной воды смывают ее в колбу. Тигель с оставшимися на стенках частицами ZnSO4 снова взвешивают на аналитических весах. По разности двух взвешиваний находят массу вещества, перенесенного в колбу:
mт+в-во = mт = mв-ва = mт+в-во – mт =
Заполняют колбу на 2/3 объема дистиллированной водой. Снимают с колбы воронку и, перемешивая ее содержимое плавными круговыми движениями, добиваются полного растворения. Разбавляют раствор до метки дистиллированной водой и тщательно перемешивают содержимое колбы, многократно перевертывая и встряхивая ее. Вычисляют молярную концентрацию эквивалента С(1/2 ZnSO4) с точностью до 4 значащих цифр.
С(1/2 ZnSO4) = 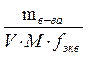 =
=
В колбу для титрования переносят аликвотную часть (10мл) приготовленного стандартного раствора ZnSO4, добавляют 20 – 25 мл аммиачного буфера и индикатор (эриохром черный Т) на кончике шпателя до яркойкрасно-сиреневой окраски.
Промывают и заполняют бюретку раствором Трилона Б и устанавливают уровень жидкости на нуле. Титруют этим раствором до перехода красно-сиреневой окраски раствора в синюю.
Титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые. Рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл:
V1 = V2 = V3 = Vср =
Далее рассчитывают точную концентрацию раствора комплексона III (трилона Б, ЭДТА):
С(1/2ЭДТА) = 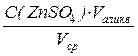 =
=
Анализ выполнил(а):
| Студент(ка) | |
| Фак-т, курс, № гр. |
Дата выполнения: «___» ___________ 20__ г. Подпись преподавателя: ____________
Дата защиты: «___» ___________ 20__ г.