КЛИНИЧЕСКАЯ КАРТИНА И ТЕЧЕНИЕ
Характер и выраженность клинических проявлений И. м. в значительной мере определяются массой некротизированного миокарда и локализацией очага некроза.
Крупноочаговый инфаркт миокарда характеризуется обычно наиболее полной клинической картиной и наибольшей выраженностью симптомов, отражающих определенные периоды в развитии заболевания. В типичном течении крупноочагового И. м. выделяют пять периодов: продромальный, острейший, острый, подострый и послеинфарктный.
Продромальный период, или так называемое предынфарктное состояние, наблюдается более чем у половины больных. Клинически он характеризуется возникновением или значительным учащением и усилением тяжести приступов стенокардии (Стенокардия) (так называемая нестабильная стенокардия), а также изменениями общего состояния (слабость, утомляемость, снижение настроения, тревога, нарушение сна). Действие антиангинальных средств у больных, их получающих, становится, как правило, менее эффективным.
Острейший период (время от возникновения ишемии миокарда до первых проявлений его некроза) продолжается обычно от 30 мин до 2 ч. Для этого периода характерен длительный приступ крайне интенсивной боли за грудиной (status anginosus), реже боль локализуется в других отделах грудной клетки, преимущественно в области ее передней стенки либо в эпигастрии (status gastralgicus). Боль может иррадиировать в руку, плечо, надплечье, ключицу (в большинстве случаев левые, но иногда и правые), в шею, нижнюю челюсть, в межлопаточное пространство (почти никогда — под лопатку), изредка — в левую подвздошную область или левое бедро. Иногда максимально интенсивную боль больной ощущает не в груди, а в месте иррадиации, например в области шеи, нижней челюсти. Многие больные не в состоянии точно описать характер боли; одни определяют ее как жгучую, другие как ломящую, третьи — как чувство сдавливания или, напротив, распирания сердца. Максимальной интенсивности боль достигает в течение нескольких минут и продолжается несколько часов, иногда она волнообразно усиливается и ослабевает. Многочасовая боль (в ряде случаев ангинозный статус продолжается более суток) свидетельствует либо о пролонгированном течении И. м., когда некроз постепенно захватывает все новые участки миокарда, либо о присоединении эпистенокардиального перикардита. В редких случаях боль сравнительно слабая и больной может не обратить на нее внимания. Чаще это бывает у больных в состоянии сильного психоэмоционального напряжения, алкогольного опьянения, а также во время или вскоре после аортокоронарного шунтирования. Исключительно редко боль отсутствует.
В острейшем периоде И. м. больные испытывают резкую слабость, чувство нехватки воздуха, страх смерти, обычно отмечаются профузный пот, одышка в покое, нередко (особенно при И. м. нижней локализации) также тошнота и рвота. При осмотре больного определяются бледность кожи и симптомы, связанные с интенсивной болью (страдальческое выражение лица, двигательное беспокойство или скованность, холодный липкий пот). В первые минуты АД повышается, затем прогрессивно снижается как проявление развивающихся сердечной и рефлекторной острой сосудистой недостаточности. Резкое снижение АД обычно связано с развитием кардиогенного шока.
Поскольку сердечная недостаточность развивается прежде всего как левожелудочковая, наиболее ранние ее проявления — одышка и снижение пульсового АД, в тяжелых случаях — Сердечная астма или отек легких (Отёк легких), который нередко сочетается с развитием кардиогенного шока. Практически у всех больных (кроме случаев поражения синоатриального или атриовентрикулярного узлов) выявляется тахикардия и определяются различные нарушения сердечного ритма и проводимости.
Температура кистей и стоп снижается. Пальпаторно определяется ослабление верхушечного толчка сердца. Границы сердца, по данным перкуссии, могут быть расширены влево. При аускультации сердца, кроме тахикардии и возможных нарушений ритма, обнаруживаются значительное ослабление громкости сердечных тонов, особенно I тона; при выраженной левожелудочковой недостаточности появляется ритм галопа (см. Галопа ритм), расцениваемый как прогностически неблагоприятный признак. Аускультативная картина над легкими зависит от степени острой левожелудочковой недостаточности. При небольшом застое крови в легких определяется усиленное везикулярное или жесткое дыхание; влажные хрипы (вначале мелкого, а затем все более крупного калибра) появляются при развитии отека легких. Интерстициальная фаза отека легких во многих случаях может быть обнаружена при рентгенологическом исследовании легких.
Острый период наступает непосредственно по окончании острейшего периода и продолжается около 2 сут. — до окончательного отграничения очага некроза (в этот период одна часть миоцитов, расположенных в периинфаркислотной зоне, погибает, другая восстанавливается). При рецидивирующем течении И. м. продолжительность острого периода может удлиняться до 10 и более дней.
В первые часы острого периода исчезает ангинозная боль. Сохранение болевых ощущений возможно при развитии эпистенокардиального перикардита, а также при продолженном или рецидивирующем течении И. м. Сердечная недостаточность и артериальная гипотензия, как правило, остаются и могут даже прогрессировать, а в некоторых случаях они возникают уже по окончании острейшего периода. Нарушения ритма и проводимости сердца определяются у подавляющего большинства, а при мониторном наблюдении (Мониторное наблюдение) практически у всех больных. Резорбционный синдром, развивающийся в остром периоде И. м., характеризуется возникновением лихорадочной реакции (при этом температура тела лишь в редких случаях превышает 38,5 °), появлением нейтрофильного лейкоцитоза. Нарушается соотношение белковых фракций крови: содержание альбуминов уменьшается, а глобулинов и фибриногена увеличивается; в крови определяется патологический С-реактивный белок. Как правило, отмечается анэозинофилия, которую, как и умеренное повышение в крови содержания глюкозы, относят к проявлениям острой стрессовой реакции. В результате распада кардиомиоцитов в плазме крови и в моче появляется свободный миоглобин и повышается активность ряда ферментов плазмы крови; уже в первые часы заболевания возрастает активность креатинфосфокиназы (особенно ее МВ-фракции), несколько позже и лактатдегидрогеназы (преимущественно за счет ее первого изоэнзима), а примерно к концу первых суток заболевания начинает существенно повышаться активность аспарагиновой и в меньшей степени аланиновой трансаминаз (аминотрансфераз).
Подострый период, соответствующий интервалу времени от полного отграничения очага некроза до замещения его нежной соединительной тканью, продолжается примерно в течение 1 мес. Клинические симптомы, связанные с уменьшением массы функционирующего миокарда (сердечная недостаточность) и его электрической нестабильностью (аритмии сердца), в этот период проявляются по-разному. Они могут постепенно регрессировать, оставаться стабильными или нарастать, что зависит в основном от обширности очаговых изменений и развития такого осложнения, как аневризма сердца. В среднем частота и тяжесть нарушений сердечного ритма в подостром периоде постепенно уменьшаются; через 2—3 нед. нередко восстанавливается нарушенная в острейшем периоде И. м. проводимость, но у многих больных возникшая блокада сердца стойко сохраняется. Общее самочувствие больных, как правило, улучшается. Одышка в покое, а также аускультативные и рентгенологические признаки застоя крови в легких при отсутствии аневризмы сердца и недостаточности митрального клапана уменьшаются или исчезают. Звучность сердечных тонов постепенно повышается, но полностью у большинства больных не восстанавливается. Систолическое АД у большинства больных постепенно повышается, хотя и не достигает исходной величины. Если И. м. развился на фоне артериальной гипертензии, систолическое АД остается значительно более низким, чем до И. м., тогда как диастолическое существенно не изменяется («обезглавленная» артериальная гипертензия).
Проявления резорбционного синдрома постепенно уменьшаются. В течение первой недели И. м. обычно нормализуется температура тела и число лейкоцитов в крови, но повышается СОЭ; активность аминотрансфераз, креатининфосфокиназы и лактатдегидрогеназы постепенно возвращается к обычному уровню. В крови появляются эозинофилы; содержание в ней глюкозы нормализуется. Более длительное сохранение повышенной температуры тела и лейкоцитоза свидетельствует либо о пролонгированном или рецидивирующем течении заболевания (в этих случаях остается длительно повышенной и активность ферментов), либо о возникновении таких осложнений, как тромбоэндокардит, Постинфарктный синдром, или присоединении сопутствующих воспалительных заболеваний (пневмонии, тромбофлебита и др.).
Приступы стенокардии могут отсутствовать; их исчезновение у больного, страдавшего стенокардией до И. м., свидетельствует о полной закупорке артерии, в бассейне которой до инфаркта периодически возникала ишемия миокарда. Сохранение или появление приступов стенокардии в подостром периоде указывает либо на «незавершенность» инфаркта (неполную окклюзию артерии), либо на многососудистое поражение с плохим развитием коллатералей, что прогностически неблагоприятно из-за сохраняющейся опасности рецидивирования или развития повторного инфаркта.
Послеинфарктный период, следующий за подострым, завершает течение И. м., поскольку в исходе этого периода предполагается окончательное формирование в зоне инфаркта плотного рубца. Принято считать, что при типичном течении крупноочагового И. м. послеинфарктный период заканчивается в срок, соответствующий примерно 6 мес. с момента возникновения очага некроза. В этот период постепенно развивается компенсаторная гипертрофия сохранившегося миокарда, благодаря которой сердечная недостаточность, если она возникла в более ранние периоды И. м., у части больных может ликвидироваться. Однако при больших размерах поражения миокарда полная компенсация не всегда возможна, и признаки сердечной недостаточности сохраняются или нарастают.
Двигательная активность и толерантность к физической нагрузке у больных без сердечной недостаточности в послеинфарктном периоде, как правило, постепенно возрастают. Частота сердечных сокращений приближается к нормальной. Аритмии сердца, в первую очередь желудочковая экстрасистолия, отмечаются у большинства больных, но частота экстрасистол и их опасность для жизни больного обычно значительно уменьшаются. Нарушения проводимости, не исчезнувшие в подостром периоде заболевания, обычно сохраняются. Изменению показатели анализов крови в большинстве своем нормализуются; иногда в течение нескольких недель сохраняются некоторое повышение СОЭ и сдвиг белковых фракций крови.
Мелкоочаговый инфаркт миокарда по своим клиническим проявлениям отличается от крупноочагового менее четкой периодичностью течения и меньшей выраженностью симптомов в остром и подостром периодах. Хотя между обширностью поражения миокарда и интенсивностью болевого синдрома нет четкого параллелизма, ангинозная боль в острейшем периоде мелкоочагового И. м. в большинстве случаев также выражена слабее, чем при крупноочаговом. Значительно реже наблюдается рефлекторная и связанная с сердечной недостаточностью артериальная гипотензия. Умеренная тахикардия (обычно рефлекторная) наблюдается не у всех больных и чаще всего не связана с острой сердечной недостаточностью: звучность тонов сердца практически не меняется. Сердечная недостаточность развивается лишь в тех случаях, когда множественные очажки некроза возникают в уже измененном миокарде (обычно на фоне постинфарктного кардиосклероза). Нарушения ритма и проводимости встречаются значительно реже, чем при крупноочаговом И. м., хотя при неблагоприятной локализации очага некроза могут носить крайне тяжелый характер (полная атриовентрикулярная блокада, «злокачественные» желудочковые аритмии). Предпосылки для формирования аневризмы сердца отсутствуют. При наиболее часто встречающейся субэндокардиальной локализации некроза возможно повреждение эндокарда с развитием пристеночного тромба и тромбоэмболических осложнений, которые, однако, возникают непосредственно реже, чем при крупноочаговом трансмуральном И. м. Изменения лабораторных показателей сравнительно невелики; число лейкоцитов в крови может не выходить за пределы нормальных значений; активность ферментов повышается значительно меньше, чем при крупноочаговом И. м. Мелкоочаговый И. м. иногда предшествует развитию крупноочагового.
Атипичные формы инфаркта миокарда характеризуются отсутствием симптома боли в острейшем периоде или полной ее нетипичностью (по выраженности, локализации, иррадиации). Заболевание может начинаться с возникновения острой левожелудочковой недостаточности или развития кардиогенного шока. Первыми проявлениями И. м. могут быть также желудочковая тахикардия, фибрилляция желудочков, полная атриовентрикулярная блокады с Морганьи — Адамса — Стокса синдромом (Морганьи — Aдамса — Cтокса синдром). Иногда И. м. или послеинфарктный кардиосклероз выявляется лишь при случайном электрокардиографическом исследовании.
Повторный инфаркт миокарда примерно в 1/3 случаев развивается на протяжении 3 лет после предыдущего. По клинической картине он обычно мало отличается от первичного, но чаще наблюдается безболевое начало, и течение чаще осложняется острой сердечной или сердечно-сосудистой недостаточностью, нарушениями проводимости и ритма сердца. Изменения лабораторных показателей при повторных И. м. носят такой же характер, как и при первичных. Повторные мелкоочаговые некрозы миокарда у некоторых больных наблюдаются при первичном мелкоочаговом поражении. Однако наблюдаются случаи, когда при тяжелой стенокардии они бывают довольно частыми, сопровождая на протяжении многих месяцев или даже нескольких лет наиболее тяжелые и длительные ангинозные приступы. Подобное течение заболевания постепенно ведет к развитию левожелудочковой недостаточности, нередко сопровождается тяжелыми нарушениями проводимости и ритма сердца. Если повторные мелкоочаговые некрозы миокарда сочетаются с такими нарушениями ритма сердца, как Пароксизмальная тахикардия, определить причинно-следственные отношения между ними бывает очень трудно, поскольку выраженная тахикардия при наличии стеноза коронарной артерии может привести к развитию мелкоочаговых некрозов.
ОСЛОЖНЕНИЯ
Большинство прогностически неблагоприятных осложнений развивается в острейшем и остром периодах И. м. Они характеризуются как нарушениями деятельности самого сердца и развитием в нем вторичных патологических процессов (например, тромбоза в желудочках), так и поражением других органов вследствие общих нарушений кровообращения и расстройств микроциркуляции. С последними связаны, в частности, развитие острого эрозивного гастрита, панкреатита, парезы желудка и кишечника, часть наблюдаемых нервных и психических расстройств. Ряд осложнений развивается в относительно поздние периоды течения заболевания. К ним относятся, например, осложнения, связанные с сенсибилизацией организма продуктами распада некротизированного миокарда (синдром Дресслера, синдром передней грудной стенки и др.), объединяемые понятием Постинфарктный синдром, а также иногда постепенно развивающаяся хроническая сердечная недостаточность. Наибольшее значение имеют такие осложнения И. м., как кардиогенный шок, острая сердечная недостаточность, аритмии и блокады сердца, разрыв сердца, аневризма сердца, эпистенокардиальный перикардит, тромбоэмболии в артерии малого и большого кругов кровообращения, нервные и психические расстройства.
Кардиогенный шок — одно из наиболее грозных осложнений острейшего и острого периодов И. м., развивающееся в первые минуты или, реже, в первые часы заболевания. При продолженном или рецидивирующем течении И. м. кардиогенный шок может возникнуть позднее. Шоку обычно предшествует сильнейшая загрудинная боль, но иногда он служит первым или даже единственным клиническим проявлением развития И. м. Принято выделять рефлекторный шок (как реакцию на чрезмерное болевое раздражение), так называемый истинный шок, обусловленный нарушением сократительной функции пораженного миокарда, аритмогенный шок (связанный с аритмией сердца) и ареактивный шок — тяжелейшее состояние с глубоким коллапсом и анурией, не поддающееся терапии. Характерен внешний вид больного: заостренные черты лица, кожа бледная с серовато-цианотичным оттенком, холодная, покрыта липким потом. При продолжительном шоке кожа приобретает мраморный вид в связи с появлением на ней цианотичных полос и пятен. Больной адинамичен, почти не реагирует на окружающее. Пульс частый, нитевидный. Систолическое АД резко снижено (обычно ниже 80 мм рт. ст.), но у больных с тяжелой исходной артериальной гипертензией симптомы шока могут появиться уже при систолическом АД порядка 110—120 мм рт. ст. При глубоком (ареактивном) шоке АД часто не определяется, развивается стойкая анурия, чаще всего свидетельствующая о необратимости шока.
Острая сердечная недостаточность в подавляющем большинстве случаев развивается как левожелудочковая вследствие поражения стенок левого желудочка или (особенно) сосочковых мышц. Проявляется снижением систолического и пульсового АД, одышкой, сердечной астмой или отеком легких, резким приглушением I тона сердца, иногда ритмом галопа.
Приступ сердечной астмы начинается с нарастающего ощущения нехватки воздуха, переходящего в удушье. Дыхание учащено, при вдохе раздуваются крылья носа; больной стремится принять сидячее положение (ортопноэ). Над легкими аускультативно определяется усиленное везикулярное или жесткое дыхание, иногда в задненижних отделах выслушиваются непостоянные мелкопузырчатые хрипы.
С нарастанием левожелудочковой недостаточности развивается отек легких: появляется цианоз, резко учащается дыхание, в котором принимают участие вспомогательные мышцы. Перкуторный звук над легкими притупляется. Характерно возникновение в легких вначале мелко- и среднепузырчатых, затем громких, крупнопузырчатых клокочущих хрипов, слышимых на расстоянии. Появляется кашель с пенистой мокротой, которая содержит прожилки крови или имеет розоватый оттенок (примесь крови).
Правожелудочковая недостаточность редко осложняет И. м. в остром периоде. Ее развитие заставляет предполагать такие осложнения, как тромбоэмболия легочных артерий (Тромбоэмболия лёгочных артерий), образование аневризмы межжелудочковой перегородки с резким уменьшением объема полости правого желудочка, разрыв межжелудочковой перегородки. Правожелудочковая сердечная недостаточность возникает закономерно, если некроз распространяется на правый желудочек или развивается изолированный инфаркт правого желудочка. Клинически острая правожелудочковая сердечная недостаточность проявляется набуханием вен, особенно заметным на шее, их видимой пульсацией, быстрым увеличением печени, сопровождающимся болью в правом подреберье из-за растяжения глиссоновой капсулы, появлением акроцианоза.
Нарушения сердечного ритма и проводимости осложняют почти все случаи крупноочагового И. м. и нередко встречаются при мелкоочаговых инфарктах. По данным мониторного наблюдения, нарушения начинают постепенно уменьшаться уже в остром периоде заболевания.
Наиболее распространенный вид аритмий сердца у больных И. м. — желудочковая Экстрасистолия. Считают, что политопная, групповая и так называемая ранняя желудочковая экстрасистолия служат предвестниками желудочковой тахикардии и фибрилляции желудочков сердца (Фибрилляция желудочков сердца). Ранними называют желудочковые экстрасистолы, зубец R которых на ЭКГ совпадает с вершиной зубца Т предыдущего желудочкового комплекса. Однако фибрилляция желудочков при И. м. может развиться и без всяких предвестников.
Желудочковая тахикардия, по разным данным, наблюдается в 10—30% случаев острого И. м. Она может трансформироваться в наиболее грозные аритмии — трепетание и фибрилляцию (мерцание) желудочков. Различают первичную фибрилляцию желудочков вследствие функциональной электрической нестабильности миокарда, и вторичную фибрилляцию, связанную с обширным некротическим и периинфарктным поражением миокарда. Первичная фибрилляция в течение первых 3—4 мин после ее возникновения устраняется разрядом дефибриллятора; в дальнейшем на фоне противоаритмической лекарственной терапии удерживается исходный ритм сердца. При вторичной фибрилляции ритм сердца или вообще не удается восстановить, или восстановленный ритм сохраняется лишь несколько секунд.
Сравнительно нечасто возникают и обычно представляют меньшую опасность, чем проявления желудочковой эктопической активности, наджелудочковые нарушения ритма сердца. Предсердная экстрасистолия регистрируется примерно у 1/4 больных, мерцательная аритмия — еще реже. Мерцательная тахиаритмия, а также наблюдающиеся у некоторых больных пароксизмы предсердной или атриовентрикулярной тахикардии могут способствовать развитию сердечной недостаточности, а иногда и аритмогенного коллапса.
При И. м. могут развиться все виды нарушений проводимости (см. Блокада сердца). Чаще всего они возникают в острейшем или остром периодах заболевания. Наиболее опасна полная предсердно-желудочковая блокада, а также неполная блокада высокой степени, для которых характерна резкая брадикардия, часто проявляющаяся синдромом Морганьи — Адамса — Стокса. Прогностически неблагоприятна также полная блокада правой ветви атриовентрикулярного пучка, возникшая при И. м. передней локализации. Если блокада сердца не исчезает в течение первых 10 дней заболевания, наиболее вероятно, что она необратима.
Разрыв сердца может возникнуть при трансмуральном И. м. между вторым и десятым днями болезни. Нередко ему предшествует резчайшая загрудинная боль. После разрыва стенки левого желудочка больной погибает обычно через несколько секунд или минут от тампонады сердца (Тампонада сердца), приводящей к асистолии. При небольших надрывах сердца тампонада развивается в течение нескольких часов. При редко наблюдаемом разрыве межжелудочковой перегородки появляется грубый систолодиастолический шум, выслушиваемый в третьем-четвертом межреберных промежутках и проводящийся слева направо. Если размеры перфорационного отверстия велики, развивается острая правожелудочковая сердечная недостаточность; небольшие надрывы сопровождаются постепенным прогрессированием недостаточности правого желудочка. Разрыв сосочковой мышцы при И. м. также наблюдается редко и распознается по внезапному появлению на верхушке сердца грубого шума недостаточности митрального клапана (шум проводится в левую подмышечную область) и развитию острой левожелудочковой недостаточности, резистентной к лечению; нередко развивается кардиогенный шок.
Аневризма сердца — осложнение обширного трансмурального И. м. В остром периоде заболевания выпячивание стенки сердца в области очага некроза характерно практически для всех случаев трансмурального инфаркта. В дальнейшем, при формировании рубца, это выпячивание чаще всего исчезает. Возникновению хронической аневризмы сердца (Аневризма сердца) способствуют артериальная гипертензия и грубые нарушения двигательного режима в первые дни заболевания. Аневризма сердца, локализующаяся в стенке левого желудочка, предрасполагает к образованию массивных внутрижелудочковых тромбов и развитию левожелудочковой недостаточности. Существует мнение, что формирование пристеночных тромбов при аневризме носит компенсаторный характер, поскольку они, организуясь, уменьшают полость левого желудочка и восстанавливают ее форму, закрывая аневризматическое выпячивание. Аневризма левого желудочка, особенно передней локализации, диагностируется путем сопоставления клинических и электрокардиографических данных. Аневризма межжелудочковой перегородки, сильно выпячивающаяся в полость правого желудочка (в связи с тем, что давление в левом желудочке значительно выше, чем в правом) может служить причиной правожелудочковой недостаточности.
Эпистенокардиальный перикардит — асептический Перикардит, почти во всех случаях осложняющий течение трансмурального И. м. Единственным надежным клиническим признаком эпистенокардиального перикардита служит шум трения перикарда, выслушать который удается лишь при передней локализации И. м. Шум слышен в пятой точке аускультации, иногда над верхушкой сердца, на протяжении немногих часов. С появлением экссудата он исчезает. Предположить развитие перикардита позволяют изменение первоначального характера боли (боль при эпистенокардиальном перикардите описывают как режущую или колющую) и большая ее продолжительность (1 сут. и более), а также связь боли с дыхательными движениями, если одновременно развивается реактивный плеврит.
Тромбоэмболические осложнения благодаря широкому применению тромболитических средств, антикоагулянтов и антиагрегантов, а также в связи с ранней активизацией больных стали встречаться примерно в 10 раз реже, чем в период, когда антикоагулянты не применялись. Источником тромбоэмболий при И. м. обычно служит внутриполостной тромбоз (чаще в левом желудочке сердца), иногда сопутствующий Тромбофлебит. Чаще всего внутриполостной Тромбоз и Тромбоэмболия в артерии системы большого круга кровообращения наблюдаются при аневризме сердца, а также при асептическом воспалении пристеночного тромба (тромбоэндокардит).
Нервные и психические расстройства при И. м., связаны в значительной степени с нарушением мозгового кровообращения (Мозговое кровообращение), чаще функционального характера, а иногда вследствие тромбоза или тромбоэмболии мелких сосудов головного мозга. Неврологические расстройства в таких случаях могут стать ведущими клиническими проявлениями острого периода, особенно при наличии очаговой неврологической симптоматики и угнетении сознания. Существенную патогенетическую роль могут играть Гипоксия мозга вследствие развивающейся при И. м. сердечной недостаточности и токсическое воздействие на головной мозг продуктов распада очага некроза в мышце сердца.
Психические нарушения чаще встречаются у лиц старших возрастных групп, особенно после 60 лет. Уже в острейшем периоде И. м. может появляться страх смерти, сопровождающийся беспокойством, тревогой, тоской. Некоторые больные молчаливы, неподвижны, другие, напротив, крайне раздражительны. Психические расстройства, наблюдаемые в дальнейшем течении И. м., можно разделить на две группы: непсихотические и психотические. Первая группа включает астенические и неврозоподобные состояния, а также аффективные синдромы — депрессивный, тревожно-депрессивный, эйфорический. Вторую группу составляют различные расстройства сознания — оглушенность, сопор, делириозные и сумеречные состояния.
В клинике психопатологических нарушений при И. м. большое место занимают эмоциональные расстройства. В первые дни И. м. чаще всего обнаруживается тревожно-депрессивный синдром. Страх смерти, тоска, тревога, тревожная депрессия могут сменяться психомоторным возбуждением. Больные в таком состоянии пытаются встать с постели, ходить, много говорят. Тревожная депрессия, сопровождающаяся устойчивой и длительной тоскливостью, может явиться причиной суицидальных действий. При ухудшении соматического состояния, нарастании гипоксии депрессия может сменяться эйфорией, а при улучшении соматического состояния вновь может появиться депрессия. Редко в остром периоде И. м. развиваются психотические состояния с изменением сознания, обычно кратковременные (продолжаются от 1 мин до 5—6 сут.). При тяжелом течении И. м. у больных старше 60 лет иногда наблюдается состояние оглушенности, которое может переходить в сопор. Длительная интенсивная боль (ангинозный статус), состояние клинической смерти, гипоксия, тяжелые нарушения ритма приводят в некоторых случаях к появлению различных по глубине сумеречных состояний сознания, иногда к развитию делирия. Реактивные состояния чаще всего наблюдаются в период между 2-м и 15-м днями болезни. В более позднем периоде в состоянии больных доминирует астения разных оттенков, могут появляться ипохондрия, истериформные реакции, состояния навязчивости.
Неврозоподобные синдромы при И. м. отличаются разнообразием симптоматики. Навязчивости и ипохондрические состояния носят характер либо преувеличения, либо патологической прикованности внимания к имеющимся ощущениям.
В послеинфарктном периоде психотические состояния наблюдаются редко. Часто отмечаются нарушения сна и астения, а у больных с церебральным атеросклерозом возможны оглушенность и спутанность сознания. В этот период возможен «уход» больных в болезнь с тяжелыми невротическими реакциями, истерией и фобиями.
ДИАГНОЗ
На догоспитальном этапе врач обязан предположить развитие И. м во всех случаях впервые возникшей или прогрессирующей стенокардии, особенно при длительности приступа боли свыше 30 мин или при впервые выявленной во время приступа аритмии сердца. В пользу диагноза инфаркта миокарда в таких случаях должны интерпретироваться и изменения ЭКГ, регистрируемой на месте, даже если они ограничены только признаками ишемии миокарда.
При типичном течении И. м. диагноз не представляет трудностей, т.к. основывается на достаточно специфичной совокупности симптомов. Наиболее характерны развившаяся в течение нескольких минут длительная интенсивная загрудинная боль, не купируемая приемом нитроглицерина, повышение АД в первые минуты болевого приступа, сменяющееся артериальной гипотензией, тахикардия, приглушенность тонов сердца.
Поскольку все больные с подозрением на развитие И. м. подлежат экстренной госпитализации, полное обоснование диагноза осуществляется уже в стационаре. К наиболее ранним признакам, объективно подтверждающим диагноз И. м., относятся характерные изменения ЭКГ, появление в плазме крови и в моче свободного миоглобина (уже в первые часы болезни) и повышение активности в крови МВ-фракции креатинфосфокиназы, а в последующем также лактатдегидрогеназы и аспарагиновой аминотрансферазы. Диагностическое значение имеют также повышение температуры тела и характерные изменения крови: лейкоцитоз со сдвигом влево и анэозинофилией, возникающий в первый день и постепенно уменьшающийся с 3—4-го дня, когда начинает повышаться СОЭ, достигая максимума к концу первой недели болезни уже при нормальном количестве лейкоцитов в крови (симптом «ножниц», или «перекреста» в динамике лейкоцитоза и СОЭ).
При атипичной клинической картине диагноз И. м. предполагается, как правило, в тех случаях, когда начало болезни проявляется сердечной астмой, отеком легких, кардиогенным шоком, нарушениями ритма и проводимости сердца, если по анамнезу и данным обследования их нельзя достоверно связать с другим заболеванием.
При атипичной локализации болей о развитии И. м. следует думать, если боли сопутствуют резкая слабость, холодный пот, адинамия или психомоторное возбуждение, приглушенность тонов сердца, кратковременная артериальная гипертензия, сменяющаяся гипотензией, тахикардия. Малейшее подозрение на наличие И. м. требует срочного электрокардиографического исследования и определения активности ферментов крови, свободного миоглобина в плазме крови и моче. Распознать И. м. при клинически бессимптомном течении можно лишь ретроспективно на основании обнаружения электрокардиографических признаков очагового поражения, давность которого редко удается выяснить.
Электрокардиографическая диагностика. Основным методом уточнения диагноза И. м., его локализации и обширности, а также определения вида таких осложнений И. м., как нарушения ритма и проводимости сердца, является электрокардиографическое исследование. ЭКГ регистрируют в 12 общепринятых отведениях, но в некоторых случаях, особенно при неопределенности выявляемых изменений ЭКГ, используют и другие системы отведений. Характерные изменения ЭКГ в разные сроки развития инфаркта при очаговой дистрофии миокарда и стенокардии.
Наиболее характерные изменения электрокардиограммы при стенокардии, очаговой дистрофии миокарда, мелкоочаговом и крупноочаговом инфарктах миокарда различной локализации (таблица иллюстрирована схематическим изображением изменений ЭКГ.
------------------- 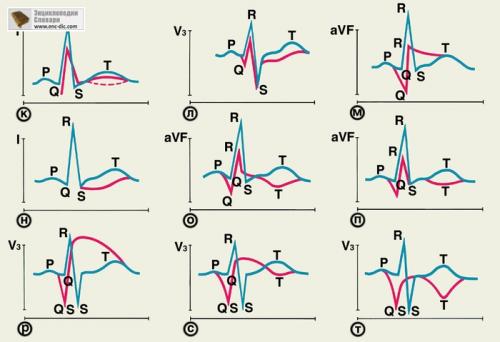 ---------------------------------------------------------------------------------------------------------------------------- Рис. 9(к—т). Схематическое изображение изменений ЭКГ при стенокардии, очаговой дистрофии и инфаркте миокарда разной локализации (иллюстрации к табл. 1): синяя кривая — нормальная ЭКГ, красные кривые — патологически измененные ЭКГ.
---------------------------------------------------------------------------------------------------------------------------- Рис. 9(к—т). Схематическое изображение изменений ЭКГ при стенокардии, очаговой дистрофии и инфаркте миокарда разной локализации (иллюстрации к табл. 1): синяя кривая — нормальная ЭКГ, красные кривые — патологически измененные ЭКГ.
-----------------------------
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Радионуклидная диагностика основана на способности ряда радиофармацевтических препаратов накапливаться в очаге инфаркта либо на оценке состояния кровотока в миокарде по распределению изотопа в сердце, которое зависит от перфузии миокарда. Используется несколько методик, из которых наиболее распространены сцинтиграфия миокарда с накапливающимися в очаге некроза 99mTc-пирофосфатом или меченными моноклональными антителами к поврежденным кардиомиоцитам (иммуносцинтиграфия), а также перфузионная сцинтиграфия миокарда с 201Tl-хлоридом.
Метод сцинтиграфии с 99mTc-пирофосфатом позволяет визуализировать зону инфаркта миокарда по включению в поврежденную область этого препарата, способного, как считают, связываться с отложениями фосфата кальция и кристаллами гидрооксиапатита в митохондриях необратимо поврежденных ишемией клеток, а также захватываться лейкоцитами, участвующими в воспалительной реакции поврежденной ткани и мигрирующими к периферии очага некроза. Метод чувствителен только в период с начала развития некротических изменений и до завершения резорбции и появления процессов репарации в очаге, т.е., не ранее чем через 12 ч и не позже, чем через 2 нед. с момента развития заболевания. Поскольку в областях рубцовых изменений накопления препарата не происходит, метод отличается достаточно высокой специфичностью.
Для осуществления сцинтиграфии больному внутривенно вводят раствор 99mTc-пирофосфата (10—15 мКи) и через 11/2—2ч производят полипозиционную сцинтиграфию области сердца в трех стандартных проекциях: передней, передней левой косой (под углом 45°) и левой боковой. При компьютерной обработке сцинтиграмм на экране дисплея определяют также зоны включения радионуклида в грудине и в одном из ребер. Подсчитывают число импульсов в каждой зоне и проводят их количественное сопоставление. При анализе сцинтиграмм учитывают очаговый или диффузный характер накопления, его локализацию и распространенность. Диффузное накопление наблюдается после приступов стенокардии, при кардиомиопатиях, стенозирующем коронарном атеросклерозе. Интенсивность накопления радионуклида в миокарде оценивают путем сопоставления активности очагов его включения в миокарде с активностью накопления в грудине и ребрах. С большой степенью достоверности острый инфаркт миокарда диагностируют в случае очагового накопления препарата в миокарде по интенсивности равном или превышающем включение в грудину. Диагноз И. м. сомнителен при диффузном характере накопления радионуклида или при интенсивности накопления, равной включению в ребра и менее.
Визуальная оценка сцинтиграмм в разных проекциях позволяет определить локализацию и распространенность инфаркта (рис. 12).
Метод практически не имеет противопоказаний и рекомендуется во всех случаях затрудненной диагностики острого И. м., в частности при повторных инфарктах и при развитии И. м. на фоне блокады левой ножки пучка Гиса. Исследования в динамике через 7—14 дней позволяют прогнозировать дальнейшее течение заболевания, развитие аневризмы.
Метод иммуносцинтиграфии начинает развиваться благодаря внедрению радиофармацевтических препаратов с мечеными моноклональными антителами. Для диагностики И. м. предложен препарат Миосцинт, содержащий меченые антитела к сердечному миозину и накапливающийся только в области инфаркта, не включаясь, в отличие от 99mTc-пирофосфата, в костную ткань. Этот метод из всех других методов радионуклидной диагностики И. м. отличается наибольшей специфичностью.
Метод перфузионной сцинтиграфии миокарда с 201Tl-хлоридом позволяет выявить по сцинтиграммам, выполненным в стандартных проекциях, область инфаркта миокарда, которая представляется участком с отсутствием микроциркуляции, соответствующим размерам И. м. (рис. 13). Результаты исследования недостаточно специфичны, поскольку перфузионные дефекты могут быть связаны с рубцовыми изменениями миокарда и имеют диагностическое значение лишь в сопоставлении с клиническими данными. Однако метод может дать ценную диагностическую информацию в самые ранние сроки развития И. м., когда еще не сформировались характерные изменения на ЭКГ.
Рентгенологическая диагностикавозможна лишь в подострой стадии И. м., когда состояние больного позволит достаточно длительно пребывать ему в положении стоя. Рентгеноскопия иногда выявляет зоны гипокинезии или акинезии по контуру тени левого желудочка сердца или так называемую парадоксальную пульсацию, т. е. выпячивание пораженной области в период систолы. Особенно четко выявляют парадоксальную пульсацию рентгено- или электрокимография, с помощью которых лучше определяются и зоны гипо- и акинезии передней, боковой и верхушечной локализации (при другой локализации И. м. рентгенологическое исследование неинформативно). В связи с расширяющимся применением тромболитической терапии и попытками хирургического лечения И. м. в остром периоде для определения локализации тромбоза венечных артерий в первые часы развития И. м. стали применять селективную коронарографию.
Ультразвуковая диагностика не имеет ограничений применения в разные сроки развития И. м., так как Эхокардиография может быть произведена у постели больного. Исследование дает ценную информацию для уточнения локализации и обширности И. м., для распознавания ряда его осложнений. Существенное значение имеет возможность определения размеров полостей сердца и оценки его сократительной способности. С помощью эхокардиографии в области некроза выявляют зоны акинезии, в периинфарктной области — гипокинезии. Метод дает возможность визуализировать внутриполостные свободные и пристеночные тромбы, жидкость в полости перикарда. Ультразвуковая допплерография выявляет регургитацию при осложнении И м. недостаточностью левого атриовентрикулярного клапана (например, вследствие инфаркта папиллярной мышцы), сброс крови из левого желудочка в правый при перфорации межжелудочковой перегородки.
Дифференциальный диагноз. На догоспитальном этапе дифференциальная диагностика И. м. с другими заболеваниями проводится в минимальном объеме, т.к. в сомнительных случаях предпочтение отдается предположению о возникновении И. м., и больной срочно госпитализируется. Ошибки чаще возникают при атипичном течении И. м. Так, острую левожелудочковую недостаточность при безболевом И. м., если она возникает на фоне повышения АД, иногда ошибочно расценивают как проявление кардиального гипертензивного криза (при гипертонической болезни, хромаффиноме), Во избежание такой ошибки следует помнить, что острая левожелудочковая недостаточность при отсутствии первичной патологии сердца у больных гипертонической болезнью развивается лишь при крайне высоком АД (всегда выше 220/120мм рт. ст. — см. Гипертонические кризы), а хромаффиному (Хромаффинома) можно предположить в случае пароксизмального подъема АД, сопровождающегося другими симптомами генерализованного возбуждения адренорецепторов. Во всех подобных случаях для исключения И. м. необходима регистрация ЭКГ. Кардиогенный шок при И. м., когда он сопровождается сопорозным состоянием, может быть причиной ошибочного диагноза комы другого происхождения, если тяжелые нарушения гемодинамики неверно оцениваются как симптомы комы, а не шока.
Весьма сложна дифференциальная диагностика И. м. при атипичной локализации боли. Гастралгическую форму И. м., особенно если он сопровождается тошнотой и рвотой, часто принимают за пищевое отравление, перфоративную язву желудка или двенадцатиперстной кишки, острый холецистит. Поэтому при интенсивной боли в эпигастрии и рвоте, особенно если они сопровождаются падением АД без четких симптомов острого живота (Острый живот), необходимо электрокардиографическое исследование, до получения результатов которого следует воздержаться от таких манипуляций, как промывание желудка. Первичная локализация боли в местах, куда она обычно иррадиирует, может обусловить неправильный диагноз Плексита или Остеохондроза с корешковым синдромом. В отличие от этих заболеваний И. м. практически всегда сопровождается симптомами общего характера (слабость, адинамия, тахикардия, изменения АД). Боль при невралгиях обычно бывает продолжительной, нередко поверхностной, связанной с позой тела; часто выявляются болевые точки по ходу межреберий, в околопозвоночной и позвоночной областях, изменения на ЭКГ отсутствуют. Иногда ошибочный диагноз И. м. ставят больным с опоясывающим лишаем, особенно в период, когда еще нет герпетических высыпаний на коже (обычно по ходу межреберного нерва); диагноз уточняют тщательным анализом жалоб с учетом отсутствия изменений на ЭКГ.
Весьма трудной бывает иногда дифференциация И. м. и тромбоэмболии легочных артерий (Тромбоэмболия лёгочных артерий). Боль в грудной клетке при эмболии ветвей легочного ствола обычно локализуется не загрудинно, однако нередко наблюдается коллапс, изменения ЭКГ в ряде случаев напоминают картину И. м. нижней локализации, отличаясь от нее признаками острой перегрузки правых отделов сердца. При массивной эмболии крупных ветвей легочного ствола, как правило, развивается острая правожелудочковая недостаточность, редко осложняющая течение И. м. Важный, но непостоянный и часто поздний (на 2—3-й сутки) симптом тромбоэмболии — кровохарканье. В дифференциальной диагностике учитывают, что тромбоэмболия чаще возникает в послеоперационном и послеродовом периодах, при тромбофлебите, флеботромбозе, но принимают также во внимание, что она может быть и осложнением острого И. м. В ряде случаев уточнению диагноза способствуют рентгенологическое и радионуклидное исследования, а также определение активности ферментов крови (для эмболии не характерно значительное повышение активности МВ-фракции креатинфосфокиназы, аминотрансфераз, повышается не первый, а второй изофермент лактатдегидрогеназы).
Отсутствие изменений ЭКГ и специфичного для И. м. повышения активности ферментов крови при резких болях в груди может быть обусловлено развитием расслаивающей аневризмы аорты (Аневризма аорты). Для подтверждения или исключения последней применяют методы, позволяющие визуализировать аорту, — ультразвуковое исследование, компьютерную рентгенотомографию, грудную аортографию.
Иногда И. м. приходится дифференцировать с острым, в частности вирусным, перкардитом, при котором боль в области сердца может быть интенсивной и длительной. Его легче предположить, если боль связана с дыханием и отсутствуют тяжелые осложнения, присущие И. м. Шум трения перикарда выслушивается у большинства больных вирусным перикардитом, но он может быть связан и с эпистенокардиальным перикардитом при И. м. Изменения ЭКГ, если они выявляются, нередко имеют черты сходства с наблюдаемыми при И. м., поэтому важное значение имеет динамическое электрокардиографическое наблюдение. В трудных случаях диагноз уточняют исследованием активности креатинфосфокиназы в крови (у больных перикардитом она не повышена), определением свободного миоглобина в плазме крови и моче (при вирусном и бактериальном перикардите он не определяется), а также с помощью эхокардиографии (см. Перикардит).
Ошибочный диагноз И. м. при спонтанном пневмотораксе возможен только при недостаточно тщательном обследовании больного, даже если он находится в состоянии болевого шока. Для Пневмоторакса характерны выраженный тимпанит и отсутствие или резкое ослабление дыхательных шумов над соответствующей половиной грудной клетки.
Дифференциальный диагноз между И. м. и так называемыми некоронарогенными некрозами миокарда (могут вызываться разными факторами) сложен и проводится обычно в условиях стационара. В связи с тем, что дистрофия и воспаление миокарда любого происхождения могут трансформироваться в некроз, дифференциальный диагноз требует многостороннего обследования больного. Учитывают, что некоронарогенный некроз чаще бывает мелкоочаговым и развивается постепенно.
ЛЕЧЕНИЕ
При установленном диагнозе И. м., подозрении на его развитие, а также при появлении предвестников И. м. (впервые возникшая или прогрессирующая стенокардия) больной должен быть срочно госпитализирован, т.к. рано начатое адекватное лечение иногда позволяет предупредить развитие инфаркта или ограничить размеры очага некроза в миокарде. Желательна транспортировка больного специализированной кардиологической бригадой скорой помощи и госпитализация в специализированное кардиологическое отделение, располагающее палатами (блоками) интенсивной терапии. Такие палаты обеспечиваются высококвалифицированными медицинскими кадрами и оборудуются системами для мониторного наблюдения (Мониторное наблюдение) за рядом показателей жизненно важных функций и динамикой ЭКГ, а также аппаратурой для кардиологической реанимации. Ранняя госпитализация и лечение больного в специализированных блоках интенсивной терапии составляют два первых принципа оптимальной организации лечебного процесса для больных И. м.; третий принцип — проведение восстановительного лечения (реабилитации (Реабилитация)), которое начинают в стационаре и завершают в специализированном санатории и на дому.
Первоочередные лечебные мероприятия направлены на купирование болевого приступа, ограничение периинфарктной зоны (включая проведение тромболитической терапии) и борьбу с грозными осложнениями И. м. (кардиогенным шоком, отеком легких и др.).
Купирование боли — важнейшая и самая неотложная часть первой помощи больному, оказываемой на догоспитальном этапе лечения И. м. Интенсивная боль может вызвать рефлекторный шок, затрудняющий терапию, а также психомоторное возбуждение, отрицательно сказывающееся на течении заболевания. Больному немедленно дают нитроглицерин под язык (1—2 таблетки) и, если в течение 5 мин боль не купирована, внутривенно вводят 2 мл 1% раствора морфина (или омнопона) в сочетании с 0,5 мл 0,1% раствора атропина (в случае появления признаков угнетения дыхательного центра дополнительно вводят в вену 2—3 мл 25% раствора кордиамина) либо проводят нейролептаналгезию (Нейролептаналгезия) — внутривенное введение нейролептика дроперидола (2,5—5 мг) с анальгетиком фентанилом (0,05—0,1 мг).
Купирование боли с помощью перидуральной анестезии либо наркоза закисью азота достаточно эффективно, но не находит широкого применения из-за технических сложностей и необходимости применения специальной аппаратуры.
Стационарное лечение.
Лечение, направленное на уменьшение периинфарктной зоны, проводится уже в стационаре; оно может быть хирургическим или только медикаментозным. Последнее включает раннее применение тромболитической и антикоагулянтной терапии, а также внутривенное капельное введение 0,01% раствора нитроглицерина с начальной скоростью 25 мкг/мин, изменяемой в дальнейшем в зависимости от динамики АД и пульса: ее увеличивают, если повышенное АД не снижается, уменьшают при снижении АД или учащении сердечных сокращений более чем на 15—20%. Активность нитроглицерина резко снижается при контакте с емкостями и трубками из поливинилхлоридных пластмасс. При невозможности внутривенного введения дают нитроглицерин сублингвально (по 1 таблетке каждые 15 минут под контролем АД и частоты пульса). Нитроглицерин уменьшает нагрузку на сердце, снижая как общее периферическое сопротивление кровотоку, так и венозный возврат.
Попытки применения для уменьшения размеров периинфарктной зоны β-адреноблокаторов, верапамила, курантила, лидазы, средств, улучшающих трофику миокарда (АТФ, витаминов, анаболических стероидов), а также гипербарической оксигенации и вспомогательного кровообращения в виде контрапульсации пока не показали их убедительных преимуществ.
Тромболитическая и антикоагулянтная терапия при отсутствии к ней противопоказаний проводится как можно раньше. Она состоит в применении тромболитических средств, относящихся к протеолитическим ферментам (стрептазы, стрептокиназы, авелизина и др., а также отечественного иммобилизованного фермента стрептодеказы), гепарина и антиагрегантов (Антиагреганты) (средств, уменьшающих способность тромбоцитов к агрегации). Установлено, что лизировать тромб удается не только при внутрикоронарном введении ферментов, как предполагалось ранее, но и при их внутривенном введении.
Лечение тромболитическими средствами целесообразно начинать не позднее чем через 3—4 ч с момента развития И. м. По прошествии 4 ч от начала болевого приступа возможность лизиса тромба резко уменьшается, да и достижение тромболитического эффекта в эти сроки уже не оказывает благоприятного влияния, ограничивающего периинфарктную зону и размеры инфаркта. Состояние больного при позднем лизировании тромба обычно даже ухудшается, что связывают с развитием плазмо- и геморрагий в очаге поражения, где тяжелые некротические и дистрофические изменения распространяются и на стенки мелких сосудов.
Перед введением тромболитических ферментов (обычно стрептодеказы) с целью предотвращения аллергической реакции внутривенно вводят 240 мг преднизолона. Стрептодеказу вводят внутривенно капельно в дозе 300 000 ФЕ в 200 млизотонического раствора хлорида натрия. Если лизис тромба не наступил, тем же способом дополнительно вводят 240 000—270 000 ФЕ препарата. Лизирование внутрикоронарного тромба может быть документировано с помощью коронарографии (Коронарография), но чаще ориентируются на косвенные признаки восстановления коронарного кровотока, выражающиеся так называемым синдромом реперфузии миокарда. Этот синдром характеризуется возобновлением на несколько минут загрудинной боли, непродолжительным умеренным снижением АД, появлением частых желудочковых экстрасистол и «пробежек» желудочковой тахикардии (по данным ЭКГ) и других тяжелых нарушений ритма сердца, выраженность которых уже в первые минуты после восстановления коронарного кровотока начинает постепенно уменьшаться. Патогномоничным электрокардиографическим признаком синдрома реперфузии является быстрое, происходящее на глазах, полное возвращение сегмента ST на изоэлектрическую линию или существенное приближение к ней наряду с формированием отрицательных «коронарных» зубцов Т. Чем меньше времени прошло с момента образования тромба до момента его рассасывания, тем более четко выражена описанная динамика ЭКГ.
Одновременно с введением тромболитических ферментов начинают лечение гепарином. Первую дозу гепарина (10000—15000 ЕД) добавляют во флакон капельницы с раствором тромболитического фермента. В дальнейшем, в течение первой недели, продолжают лечение гепарином (внутривенно, внутримышечно 4 раза в сутки или подкожно в клетчатку околопупочной области 2 раза в сутки) в дозах, определяемых по динамике свертываемости крови (обычно 5000—10000 ЕД). Оптимальное время свертывания крови при лечении гепарином — около 20 мин; если оно превышает 20 мин, очередную инъекцию не делают. От широко распространенного в 50—60-х гг. лечения больных И. м. антикоагулянтами непрямого действия (подавляющими синтез протромбина печенью) практически отказались, главным образом в связи с недоказанностью их эффективности и большой частотой осложнений такой терапии.
С первого дня заболевания назначают антиагреганты, из которых обычно предпочитают ацетилсалициловую кислоту (аспирин) в дозе 0,125 г в сутки (за один прием). Лечение ацетилсалициловой кислотой больных, перенесших И. м., продолжают в течение года и более, а при наличии стенокардии — постоянно.
Применение тромболитических средств, гепарина и антиагрегантов противопоказано больным с предрасположенностью к кровотечениям (язва желудка или двенадцатиперстной кишки, эрозивный гастрит, патология свертывающей системы крови и др.).
Хирургическое лечение с целью реваскуляризации миокарда для уменьшения периинфарктной зоны и предотвращения увеличения очага некроза состоит в проведении в первые часы острого И. м. экстренных операций на венечных артериях сердца — аорто- или маммарокоронарного шунтирования, эндартериэктомии, баллонной ангиопластики (см. Ишемическая болезнь сердца). Убедительных данных о преимуществах хирургического лечения И. м. перед медикаментозным пока нет. Наиболее обнадеживающие результаты получены в случаях, когда хирургическое вмешательство проведено раньше, чем наступила полная окклюзия тромбом венечной артерии.
Лечение кардиогенного шока предполагает обязательное эффективное купирование болевого приступа, что при рефлекторном шоке может оказаться достаточным для восстановления АД и периферической гемодинамики. В случае стойкого снижения АД при истинном кардиогенном шоке вводят прессорные амины: на догоспитальном этапе — 1% раствор мезатона (0,5—1 мл подкожно или 0,1—0,5 мл в 10—20 мл изотонического раствора хлорида натрия медленно внутривенно), а в условиях стационара— дофамин или норадреналин капельно внутривенно (на изотоническом растворе хлорида натрия или 5% растворе глюкозы) под контролем АД, плазмозаменители (реополиглюкин, высокомолекулярный декстран и др.), преднизолон в дозе 90—120 мг. Сердечные гликозиды показаны в случае, если И. м. развился на фоне гипертрофии сердца или имеющейся сердечной недостаточности; применяют их с осторожностью под контролем динамики ЭКГ. Состояние больного иногда пытаются улучшить с помощью вспомогательного кровообращения, а также гипербарической оксигенации, однако эффективность их не постоянна, а при ареактивном кардиогенном шоке отсутствует, т.к. он связан с необратимой неспособностью сохраненной части миокарда левого желудочка обеспечить нагнетание необходимого минимума крови в артерии.
Основным в лечении аритмогенного шока является восстановление сердечного ритма или повышение темпа сокращений сердца при выраженной брадикардии (Брадикардия), обычно связанной с полной атриовентрикулярной блокадой.
Лечение нарушений ритма и проводимости сердца требуется не только при аритмогенном шоке и всегда проводится при аритмиях, угрожающих асистолией или развитием фибрилляции желудочков. Для купирования часто возникающих при И. м. прогностически неблагоприятных форм желудочковой экстрасистолии (политопные, групповые, ранние экстрасистолы) и «пробежек» желудочковой тахикардии обычно применяют лидокаин. Первую дозу лидокаина (100—150мг) на догоспитальном этапе целесообразно ввести внутримышечно. В условиях стационара ее вводят внутривенно струйно, после чего немедленно переходят к капельному вливанию лидокаина со скоростью 2—4 мг в 1 мин. Лидокаин не вызывает гипотензии и почти не оказывает влияния на проводимость; при капельном введении его действие прекращается сразу по окончании введения. Высокой антиаритмической активностью обладает новокаинамид, который применяют внутримышечно (5—10 мл 10% раствора) или перорально не менее 4 раз в сутки (по 0,75—1 г на прием). При внутривенном введении этого препарата нередко развивается коллапс. Лечение новокаинамидом проводят под электрокардиографическим контролем, т.к. препарат угнетает внутрижелудочковую и предсердно-желудочковую проводимость. Из средств, способных предупредить развитие фибрилляции желудочков, наиболее эффективны β-адреноблокаторы. Препараты этой группы при отсутствии противопоказаний (выраженная артериальная гипотензия, нарушение атриовентрикулярной проводимости I—II степени, синусовая брадикардия, острая левожелудочковая недостаточность) целесообразно назначать в небольших дозах всем больным И. м., поскольку первичная фибрилляция желудочков может возникнуть и в тех случаях, когда не выявляется высокая эктопическая активность желудочков. Наиболее распространенный препарат этой группы пропранолол (анаприлин, обзидан) применяют в дозе от 10 до 20 мг 4 раза в сутки под контролем изменений ЭКГ, т.к. он может отрицательно влиять на автоматизм синусового узла, внутрипредсердную и предсердно-желудочковую проводимость. В ряде случаев эффективен дифенин в суточной дозе 0,15—0,3 г. Почти все остальные противоаритмические средства, в частности этмозин, этацизин, хинидин, мекситил, аймалин и др., неспособны предупредить фибрилляцию желудочков или обладают побочными действиями, неприемлемыми при лечении больных острым инфарктом миокарда.
При резистентной к медикаментозному лечению желудочковой тахикардии как можно скорее проводят электроимпульсную терапию. Если больной находится в специализированном лечебном учреждении, ее используют как первое средство устранения желудочковой тахикардии, одновременно начав лечение лидокаином или увеличив скорость его инфузии.
Единственный метод борьбы с трепетанием и мерцанием желудочков — экстренная электрическая дефибрилляции сердца.
Приступ супрапвентрикулярной тахикардии чаще всего купируется внутривенным введением 10 мг верапамила (изоптин): реже эффективен новокаинамид. При тахисистолической форме мерцательной аритмии показано применение сердечных гликозидов (строфантина, коргликона), что при аритмии, осложнившей И. м., может привести к нормализации ритма сердца, а при постоянной форме мерцательной аритмии, существовавшей до развития И. м., уменьшает частоту сердечных сокращений и препятствует развитию сердечной недостаточности. Если медикаментозное лечение не дает эффекта, то при суправентрикулярной тахикардии и при мерцательной тахиаритмии, связанной с И. м. и осложненной нарастающей сердечной недостаточностью, прибегают к электроимпульсной терапии.
Лечение нарушений атриовентрикулярной проводимости, а также выраженной синусовой брадикардии начинают с введения 0,5—1 мл 0,1% раствора атропина внутримышечно или медленно внутривенно. На догоспитальном этапе при отсутствии условий для проведения инъекции больному с резко выраженной брадикардией в качестве кратковременной неотложной помощи можно дать сублингвально таблетку изадрина (0,005 г) или 1/2 таблетки (0,01) орципреналина сульфата. При полной атриовентрикулярной блокаде, а также при атриовентрикулярной блокаде высокой степени, отличающейся тяжелой брадикардией, наиболее эффективна электрическая стимуляция сердца.
Лечение острой сердечной недостаточности, проявляющейся сердечной астмой или отеком легких, начинают с введения морфина либо фентанила в сочетании с дроперидолом (так же, как при купировании болевого приступа). Если больной не находится в состоянии кардиогенного шока, для уменьшения нагрузки на сердце используют нитроглицерин, по возможности внутривенно (так же, как и для ограничения периинфарктной зоны). Для улучшения сократимости миокарда внутривенно вводят 40—80 мг фуросемида (при необходимости повторно) и применяют быстродействующие сердечные гликозиды (0,3—0,5 мл 0,05% раствора строфантина или 0,5—1 мл 0,06% раствора коргликона в 20 млизотонического раствора хлорида натрия медленно внутривенно). При альвеолярном отеке легких осуществляют ингаляцию паров 70—80% раствора этилового спирта, который заливают вместо воды в увлажнитель кислородного аппарата; пары спирта способствуют уничтожению пены в отечной жидкости.
Лечение острых психических нарушений. Для борьбы с психомоторным возбуждением в остром периоде И. м. используют транквилизаторы (обычно седуксен внутримышечно или внутривенно в дозе 10—20 мг), а также нейролептик дроперидол (2,5—5 мг внутримышечно или внутривенно медленно). При психотических расстройствах тактику лечения определяет психиатр.
Реанимация необходима в случае наступления у больного И. м. клинической смерти длительностью не более 4 мин и при условии, что причиной смерти не являются несовместимые с жизнью нарушения структуры органов (например, разрыв сердца с гемотампонадой). Если клиническая смерть наступила вне стационара, а у лица, оказывающего помощь, отсутствуют подручные средства, реанимацию начинают с непрямого массажа сердца (Массаж сердца) и искусственного дыхания рот в рот или рот в нос, что иногда позволяет вывести больного из состояния клинической смерти, а чаще не допустить развития биологической смерти до прибытия специализированной бригады скорой медицинской помощи или до госпитализации реанимируемого. При наличии специального оборудования, если отсутствует электрокардиографическая информация в момент клинической смерти, реанимацию начинают с электрической дефибрилляции (Дефибрилляция) сердца. В случае неэффективности первого дефибриллирующего разряда немедленно начинают непрямой массаж сердца и искусственное дыхание рот в рот или рот в нос. В это время налаживают регистрацию ЭКГ и аппаратную искусственную вентиляцию легких (Искусственная вентиляция лёгких). При фибрилляции желудочков проводят повторную дефибрилляцию разрядами более высокой энергии. Разряд дефибриллятора может восстановить сердечную деятельность и при асистолии, хотя иногда для этого достаточно резкого удара кулаком по нижней трети грудины реанимируемого с расстояния 20—30 см. Для повышения эффективности реанимации при асистолии в полость левого желудочка вводят адреналин (1 мл 0,1% раствора) и хлорид кальция (2—5 мл 10% раствора). При наличии технических условий (обычно в стационаре) с целью восстановления деятельности сердца при асистолии может быть применена эндокардиальная электрическая стимуляция сердца.
Реанимацию продолжают до восстановления кровообращения и самостоятельного дыхания или до появления достоверных признаков биологической смерти. Реанимированных больных помещают в отделение реанимации, где корригируют нарушения кислотно-щелочного баланса и осуществляют интенсивную терапию других возникших осложнений.
Восстановительная терапия, направленная на мобилизацию компенсаторных возможностей организма, психическую и физическую реабилитацию больного, профилактику возможных и устранение развившихся осложнений, начинается с первого дня поступления больного в стационар и продолжается в постинфарктном периоде, а при необходимости и в более поздние сроки болезни. В разные периоды течения И. м. комплекс средств восстановительной терапии видоизменяется; наиболее постоянными его составляющими являются диета, психотерапия, медикаментозные средства профилактики и коррекции нарушенных функций, лечебная физкультура (физическая реабилитация), которые на послебольничном этапе ведения больного могут сочетаться с санаторно-курортным лечением.
Диета в первые 2 дня болезни ограничивается подогретой водой (например, дегазированной минеральной), теплым слабым чаем, неохлажденными фруктовыми соками. С 3—4-го дня включают небольшие порции изделий из мясного фарша, молочнокислых продуктов и продуктов, содержащих растительную клетчатку. К концу первой недели переводят больного на общую диету (№10), исключая продукты, вызывающие у больного метеоризм.
Очень важно тщательно контролировать регулярность опорожнения кишечника, т.к. натуживание при дефекации чревато серьезными осложнениями. При необходимости применяют растительные слабительные, клизмы. Если больной нуждается в опорожнении кишечника, но не может сделать этого лежа, уже со второго дня заболевания ему помогают сесть (по возможности пассивно) в постели на подкладное судно, опустив ноги.
Рациональная психотерапия предполагает прямое и косвенное внушение больному идеи благоприятного исхода болезни; аутотренинг; постепенное создание путем разъяснительных бесед представления больного об образе его жизни в ближайшие месяцы и годы и возможных ограничениях в связи с приобретенными осложнениями; достижение установки больного на возможность существенной степени реабилитации при выполнении врачебных рекомендаций.
Медикаментозная терапия определяется характером осложнений. Ацетилсалициловую кислоту и бета-адреноблокаторы при отсутствии противопоказаний назначают всем больным. В подостром и постинфарктном периодах при необходимости применяют психотропные средства (транквилизаторы, антидепрессанты, иногда нейролептики).