Принципи класифікації катіонів
АНАЛІЗ КАТІОНІВ
Виявляють іони за допомогою дробного і систематичного методів аналізу. Принцип дробного методу полягає в тому, що іони елемента виявляють характерними реакціями у присутності всіх інших іонів. У складніших випадках спочатку відокремлюють конкретний іон від тих, які заважають його виявленню. Використовуючи цей метод аналізу, звичайно не дотримуються певної послідовності у виявленні окремих іонів. Систематичний метод аналізу передбачає відокремлення іонів не поодинці, а цілими групами, за допомогою реагентів, які називають груповими реагентами. Потім у межах кожної з цих груп виявляють окремі іони характерними реакціями.
Груповими є реагенти, які відповідають таким вимогам:
· осаджують іони кількісно (концентрація іону в розчині після осадження не повинна перевищувати 10-6 М);
· одержаний з їхньою допомогою осад легко розчиняється у кислотах, відтак можна продовжувати аналіз;
· надлишок доданого реагенту не заважає виявленню іонів, які залишаються у розчині.
Є декілька схем класифікації катіонів на аналітичні групи. В основі сульфідного методу аналізу катіонів є різна розчинність карбонатів і сульфідів металів залежно від рН середовища. Всі катіони поділяють на такі п’ять аналітичних груп:
перша група – катіони K+, Na+, NH4+, Mg2+, які не мають групового реагенту;
друга група – катіони Ca2+, Sr2+, Ba2+, які утворюють з (NH4)2CO3 в присутності амонійної буферної суміші (рН=9) нерозчинні у воді карбонати;
третя група – катіони Al3+, Cr3+, Mn2+, Fe2+, Fe3+, Co2+, Ni2+, Zn2+.
Розчин амоній сульфіду є груповим реагентом, дією якого на нейтральний або слабколужний розчин осаджують сульфіди NiS, CoS, FeS, Fe2S3, MnS, ZnS і гідроксиди Cr(OH)3, Al(OH)3 (гідроксиди утворюються як продукти гідролізу відповідних сульфідів);
четверта група – іони Hg2+, Cu2+, Bi3+, Cd2+, Sn(II), Sn(IV), As(III), As(V), Sb(III), Sb(V), які осаджують з кислих розчинів сірководнем у вигляді сульфідів;
п’ята група – катіони Ag+, 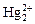 , Pb2+, Cu+, які, взаємодіючи з HCl, утворюють нерозчинні у воді хлориди.
, Pb2+, Cu+, які, взаємодіючи з HCl, утворюють нерозчинні у воді хлориди.
Сульфідний метод має суттєві недоліки. Деякі сульфіди легко окиснюються до сульфатів, у результаті чого випадають в осад сульфати кальцію, стронцію і барію. Це приводить до втрати катіонів другої групи. Значна токсичність H2S потребує обережності під час роботи з ним. Тому частіше використовують інші методи аналізу, зокрема кислотно-лужний та аміачно-фосфатний.
В основі кислотно-лужного методу є різна розчинність хлоридів і сульфатів металів, а також відмінності у властивостях їхніх гідроксидів. У цьому методі катіони поділяють на такі шість аналітичних груп:
перша група – катіони Ag+, Pb2+, 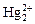 , які утворюють малорозчинні хлориди;
, які утворюють малорозчинні хлориди;
друга група – катіони Ba2+, Sr2+, Ca2+, Pb2+, які утворюють малорозчинні сульфати;
третя група – іони Al3+, Cr3+, Zn2+, Sn(II), Sn(IV), As(III), As(V), які утворюють амфотерні гідроксиди, а тому залишаються в розчині при дії надлишку NaOH і H2O2;
четверта група – іони Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb(III), Sb(V), які утворюють гідроксиди, нерозчинні в надлишку аміаку;
п’ята група – катіони Cu2+, Cd2+, Hg2+, Ni2+, Co2+, які утворюють гідроксиди, розчинні в надлишку водного розчину аміаку ;
шоста група – катіони K+, Na+, NH4+, які не мають групового реагенту.
В основу лабораторного практикуму покладено аміачно-фосфатний метод аналізу, який детально описаний у наступних розділах. Цей метод ґрунтується на використанні різної розчинності фосфатів у воді, кислотах (сильних і слабких), лугах і водному розчині аміаку. Іони поділяють на такі п’ять аналітичних груп:
перша група – катіони K+, Na+, NH4+, фосфати яких розчинні у воді. Ця група катіонів не має групового реагенту;
другагрупа – катіони, які осаджуються у вигляді малорозчин-них фосфатів із концентрованого водного аміачного розчину дією групового реагенту натрій або амоній гідрогенфосфату. Катіони другої аналітичної групи поділяють на дві підгрупи: 1)двозарядні іони Ba2+, Ca2+, Sr2+, Mg2+, Mn2+, Fe2+, фосфати яких розчинні у 2 М розчині ацетатної кислоти; 2) тризарядні іони Fe3+, Al3+, Cr3+, Bi3+, фосфати яких нерозчинні у 2 М розчині ацетатної кислоти, проте розчинні в мінеральних кислотах;
третягрупа – катіони Cu2+, Cd2+, Hg2+, Co2+, Ni2+, Zn2+, фосфати яких розчинні у водному розчині аміаку й утворюють аміакати;
четверта група – іони Sn(II), Sn(IV), Sb(III), Sb(V), As(III), As(V). Іони стануму і стибію під час нагрівання з HNO3 утворюють нерозчинні метастанатну і метастибіатну кислоти. Сполуки арсену (III) при цьому окиснюються в арсенатну кислоту, яка в цих умовах повністю адсорбується метастанатною кислотою;
п’ята група – іони Ag+, 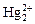 , Pb2+, які осаджуються хлоридною кислотою у вигляді малорозчинних хлоридів.
, Pb2+, які осаджуються хлоридною кислотою у вигляді малорозчинних хлоридів.
1.2. Перша аналітична група катіонів (K+, Na+, NH4+)
Майже всі солі калію, натрію та амонію добре розчинні у воді, тому ці катіони не мають загального реагенту, здатного одночасно осадити їх у вигляді нерозчинних у воді сполук. Цим перша група катіонів відрізняється від усіх інших груп.
Усі солі катіонів першої групи безбарвні, за винятком сполук, що містять забарвлені аніони (наприклад, CrO42-, Cr2O72–, MnO4-).
Солі калію та натрію стійкі під час нагрівання і прожарювання; солі амонію за таких умов легко розкладаються, особливо це стосується солей летких кислот (HCl, HNO3, H2CO3 та ін.).
1.2.1. Характерні реакції іонів К+. Натрій гексанітрокобальтат (ІІІ)Na3[Co(NO2)6]. Ця комплексна сполука у нейтральному або ацетатнокислому середовищі утворює з іонами К+ важкорозчинний жовтий кристалічний осад подвійної солі K2Na[Co(NO2)6]:
2K+ +3Na+ + [Co(NO2)6]3– = K2Na[Co(NO2)6]¯ + 2Na+.
Луги, розкладаючи реагент, заважають перебігу реакції, у результаті чого виділяється темно-бурий осад Со(ОН)3:
[Co(NO2)6]3- + 3OH- = Co(OH)3¯ + 6NO2-.
У присутності сильних кислот комплексний аніон теж розкладається:
[Co(NO2)6]3- + 6H3О+ = Co3+ + 6HNO2 + 6Н2О.
Слід пам’ятати, що розчин Na3[Co(NO2)6] під час зберігання розкладається, змінюючи буре забарвлення на рожеве (колір іонів Со2+). Такий реагент непридатний для виявлення іонів К+.
Іони NH4+ заважають виявленню іонів К+, оскільки з Na3[Co(NO2)6] утворюють осад, подібний за кольором на осад, що утворюється за наявності Калію.
Виконання досліду. До краплі досліджуваного розчину (рН 5-7) додають 2-3 краплі розчину Na3[Co(NO2)6]. Якщо реакція розчину є кислою, то необхідно додати натрій ацетат для зв’язування іонів H3О+. За наявності іонів К+ утворюється жовтий осад.
Мікрокристалоскопічна реакція.Іони К+ із реагентом Na2PbCu(NO2)6 утворюють чорні кристали кубічної форми:
2K+ + PbCu(NO2)62- = K2PbCu(NO2)6¯.
Реакція відбувається в нейтральному середовищі; її перебігу заважають іони NH4+, які утворюють подібну сполуку.
Виконання досліду. Краплю досліджуваного розчину наносять на предметне скло і випаровують на водяній бані. Після охолодження додають краплю реактиву. Якщо є іони К+, то утворюються чітко огранені кристали кубічної форми чорного або коричневого кольору.
Реакція забарвлення полум’я. Солі калію забарвлюють полум’я у блідо-фіолетовий колір.
Виконання досліду. Платинову або ніхромову дротинку змочують розчином НСl і прожарюють у полум’ї, поки не зникне забарвлення. Щоб дротинка стала чистою (не забарвлювала безбарвного полум’я), операцію виконують кілька разів. Чисту розжарену дротинку занурюють у досліджуваний розчин і поміщають у полум’я. Якщо є іони калію, то полум’я забарвлюється у блідо-фіолетовий колір.
1.2.2. Характерні реакції іонів Na+.Мікрокристалоскопічна реакція з цинк-ураніл-ацетатом Zn(UO2)3(CH3COO)8. Іони Na+ у нейтральному або ацетатнокислому середовищі з Zn(UO2)3(CH3COO)8 утворюють світло-жовті кристали октаедричної або тетраедричної форми:
Na+ + Zn(UO2)3(CH3COO)8 + CH3COO– + 9H2O =
= NaZn(UO2)3(CH3COO)9×9H2O¯.
Цією реакцією виявляють іони Na+ за наявності великого надлишку іонів K+, NH4+, Mg2+, Ca2+, Sr2+, Mn2+, Ba2+, Al3+, Cr3+, Fe3+, Zn2+, Co2+, Ni2+, Cd2+, Bi3+, Cu2+, Pb2+, Hg2+. Перебігу реакції зава-
жають іони Ag+, 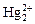 , Sb(III), PO43-, AsO43-.
, Sb(III), PO43-, AsO43-.
Виконання досліду. Краплю досліджуваного розчину на предметному склі обережно випаровують. Після охолодження на скло, поряд із залишком, наносять краплю розчину реактиву і скляною паличкою перемішують його із залишком. Якщо є іони Na+, то утворюються світло-жовті кристали у формі октаедрів або тетраедрів, які добре видно під мікроскопом.
Реакція забарвлення полум’я. Солі натрію забарвлюють полум’я у жовтий колір. Виконання досліду. Див. 1.2.1.
1.2.3. Характерні реакції іонів NH4+. Їдкі луги (NaOHабо KOH) під час нагрівання з розчинами солей амонію виділяють аміак:
NH4+ + OH- = NH3 + H2O.
Виділений аміак виявляють за запахом або хімічними реакціями. Змочений водою фенолфталеїновий папірець, піднесений до пробірки, у якій відбувається реакція, червоніє, оскільки водний розчин аміаку має лужну реакцію.
Виконання досліду. У тиглик (пробірку) поміщають 3-5 крапель досліджуваного розчину і стільки ж крапель лугу. Зверху на тиглик (пробірку) кладуть предметне скло зі змоченим внизу фенолфталеїновим папірцем і суміш підігрівають. Треба стежити, щоб бризки розчину не потрапляли на папір. Якщо є іони амонію, то фенолфталеїновий папірець червоніє.
Калій тетрайодомеркуріат (ІІ) K2[HgJ4]у KOH (реактив Неслера) з іонами NH4+ утворює червоно-бурий осад дийодо-m-амідодимеркурій (ІІ) йодид NH2Hg2J3:
NH4+ + 2[HgJ4]2- + 2OH- = [NH2Hg2J2]J¯+ 5J- + 2H2O.
Інші катіони першої аналітичної групи не заважають виявленню іонів NH4+ реактивом Неслера. Реакції заважають іони Fe3+, Bi3+, Cu2+, Cd2+, Ag+, Pb2+, As(V) та ін., бо деякі з них утворюють нерозчинні гідроксиди (Fe3+, Bi3+) або реагують з іонами J-.
Реакція чутлива. Її виконують з метою виявлення дуже малих кількостей ("слідів") солей амонію або аміаку. Тоді розчин забарвлюється у жовтий колір.
Виконання досліду. До 1–2 крапель досліджуваного розчину додають стільки ж реактиву Неслера. Якщо є NH4+-іони, то залежно від їхньої концентрації утворюється червоно-бурий осад або розчин забарвлюється у жовтий колір.
Термічний розклад солей амонію. Амонійні солі летких кислот під час нагрівання розкладаються повністю:
(NH4)2CO3 = 2NH3 + CO2 + H2O;
NH4Cl = NH3 + HCl.
Солі, утворені нелеткими кислотами, розкладаються тільки частково:
(NH4)2SO4 = NH3 + NH4HSO4.
Окремі солі амонію і нелетких кислот розкладаються під час нагрівання за такими реакціями:
(NH4)3PO4 = 3NH3 + H3PO4;
H3PO4 = HPO3 + H2O;
2Mg NH4PO4 = Mg2P2O7 + 2NH3 + H2O.
Виконання досліду. Порцелянову чашку або тигель із досліджуваною рідиною ставлять на піщану баню і, обережно нагріваючи, випаровують розчин. Одержаний залишок повільно прожарюють і після охолодження розчиняють у декількох краплинах дистильованої води. В окремій порції розчину перевіряють повноту видалення солей амонію реактивом Неслера.
Кип’ятіння розчинів солей амонію з лугами або з натрій карбонатом. Під дією їдких лугів, карбонатів калію або натрію солі амонію розкладаються з виділенням газоподібного аміаку. Нагрівання прискорює цю реакцію:
2NH4Cl + Na2CO3 = 2NH3 + 2NaCl + H2O + CO2.
1.3. Друга аналітична група катіонів
(Ba2+, Ca2+, Sr2+, Mg2+, Mn2+, Fe2+, Fe3+, Cr3+, Al3+, Bi3+)
Груповим реагентом другої аналітичної групи катіонів є гідрогенфосфати лужних металів або амонію. Під дією групового реагенту на катіони другої аналітичної групи за наявності водного розчину NH3 (рН~10) утворюються середні солі Ba3(PO4)2, Ca3(PO4)2, Sr3(PO4)2, Fe3(PO4)2, FePO4, AlPO4, CrPO4, BiPO4. Іони Mg2+ та Mn2+ утворюють подвійні солі MgNH4PO4, MnNH4PO4:
3Ba2+ + 2HPO42- + 2NH3 = Ba3(PO4)2¯ + 2NH4+;
Mg2+ + HPO42- + NH3 = MgNH4PO4¯;
Cr3+ + HPO42- + NH3 = CrPO4¯ + NH4+.
За розчинністю фосфатів в ацетатній кислоті катіони другої аналітичної групи поділяють на дві підгрупи. Фосфати першої підгрупи (двозарядні катіони Ba2+, Ca2+, Sr2+, Mg2+, Mn2+, Fe2+) розчинні в ацетатній кислоті, а фосфати другої(тризарядні катіони Fe3+, Al3+, Cr3+, Bi3+) – нерозчинні. Розчинення фосфатів у СН3СООН супроводжується утворенням іонів HPO42- та H2PO4-. Це пояснюється тим, що
константа протонізації СН3СООН ( 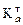 =1,8×10–5) значно більша від
=1,8×10–5) значно більша від 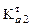 і
і  фосфатної кислоти (
фосфатної кислоти ( 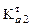 = 6,2×10–8,
= 6,2×10–8,  = 4,7×10–13):
= 4,7×10–13):
Ba3(PO4)2¯ + 4CH3COOH = 3Ba2+ + 2H2PO4– + 4CH3COO–;
2MnNH4PO4¯ + 4CH3COOH = 2Mn2+ + 2H2PO4– + 4CH3COO– + 2NH4+.
Усі фосфати катіонів другої аналітичної групи розчинні у сильних мінеральних кислотах (HCl, HNO3):
Ba3(PO4)2¯ + 6H3О+ = 2H3PO4 + 3Ba2+ + 6Н2О;
FePO4¯ + 3H3О+ = H3PO4 + Fe3+ +3Н2О.
Алюміній фосфат та хром фосфат розчинні також у надлишку їдких лугів:
AlPO4¯ + 4OH– = [Al(OH)4]– + PO43–.
Хром фосфат легко взаємодіє із сильними окисниками в лужному середовищі, тоді іон Cr3+ окиснюється в СrO42–:
2CrPO4¯ + 3H2O2 + 10OH– = 2CrO42– + 2PO43– + 8H2O.
Більшість сполук катіонів другої аналітичної групи безбарвні і малорозчинні у воді.
1.3.1. Загальні реакції катіонів другої аналітичної групи.Гідрогенфосфати лужних металів і амонію взаємодіють з катіонами другої аналітичної групи так, як про це описано вище.
Виконання досліду. До 2-3 крапель розчину солей перелічених вище катіонів другої аналітичної групи додають стільки ж 2 М розчину аміаку і 4-5 крапель розчину (NH4)2HPO4; в результаті реакції осаджуються фосфати відповідних катіонів. Важливо звертати увагу на колір одержаних осадів. Кожен з осадів розділяють на три частини і досліджують їхню взаємодію з НСl, СН3СООН та лугом. Усі фосфати катіонів обох підгруп легко розчиняються у хлоридній кислоті, а фосфати катіонів першої підгрупи також у 2 М СН3СООН. Хром та алюміній фосфати розчинні в лугах.
Їдкі луги (КОНабоNaOH) утворюють білі аморфні осади гідроксидів магнію, мангану, алюмінію і бісмуту; зелені – гідроксидів феруму (ІІ) та хрому (ІІІ); червоно-бурий – феруму (ІІІ):
Mg2+ + 2OH- = Mg(OH)2¯.
Осади гідроксидів розчинні в кислотах, а Al(OH)3 і Cr(OH)3 також у надлишку лугу, утворюючи відповідно алюмінати та хроміти:
Cr(OH)3¯ + 3OH- = [Cr(OH)6]3-.
Хроміти зеленого кольору і, на відміну від алюмінатів, розкладаються під час кип’ятіння:
[Cr(OH)6]3- = Cr(OH)3¯ + 3OH–.
Виконання досліду. До розчину солей катіонів другої аналітичної групи (крім Ba2+, Ca2+) додають декілька крапель лугу до випадання осаду. Одержані осади гідроксидів ділять на дві частини. До однієї частини додають 1-2 краплі 2 М розчину мінеральної кислоти, до іншої – стільки ж 2 М розчину NaOH. Спостерігають за змінами осаду.
Карбонати (NH4)2CO3, Na2CO3 іK2CO3утворюють із розчинними солями барію, стронцію, мангану, феруму (ІІ) карбонати:
Ba2+ + CO32- = BaCO3¯.
Солі магнію, бісмуту і феруму (ІІІ) під час кип’ятіння з карбонатами утворюють білі осади гідроксокарбонатів (MgOH)2CO3, Ві(OH)CO3 та бурий осад Fe(OH)CO3:
2Mg2+ + CO32- + 4H2O = (MgOH)2CO3¯ + 2H3О+.
Солі алюмінію і хрому утворюють осади Al(OH)3 , Cr(OH)3:
Al3+ + 3CO32- + 3H2O = Al(OH)3¯ + 3HCO3-.
Сульфатна кислота і розчинні у воді сульфати з солями барію, кальцію утворюють білі осади сульфатів (BaSO4, CaSO4), які нерозчинні в розведених кислотах. Осадження CaSO4 неповне, оскільки CaSO4 більш розчинний у воді. Інші катіони другої аналітичної групи сульфатною кислотою і сульфатами не осаджуються.
1.3.2. Характерні реакції іонів Ba2+. Калій хромат або дихромат утворюють з іонами Ва2+ жовтий кристалічний осад барію хромату, не розчинний в ацетатній кислоті, проте розчинний у мінеральних кислотах:
Ba2+ + CrO42- = BaCrO4¯;
2Ba2+ + Cr2O72- + 3H2O = 2BaCrO4¯ + 2H3О+.
Утворення барій хромату зумовлене тим, що в розчині, крім іонів Cr2O72-, є іони CrO42-, які виникають у результаті гідролізу іонів дихромату. Як видно з рівняння, під час реакції утворюються іони H3О+, які розчиняють осад BaCrO4, і тому ця реакція до кінця не відбувається. Щоб досягти повноти осадження Барію, до розчину додають CH3COONa. При цьому іони H3О+ зв’язуються з іонами CH3COO-, утворюючи ацетатну кислоту, в якій BaCrO4 не розчиняється.
Розглянута реакція є характерною для іонів Ba2+ і її застосовують не тільки для виявлення Барію, але і для відокремлення його від іонів Ca2+.
Виконання досліду. До 3-5 крапель досліджуваного розчину додають стільки ж K2Cr2O7 і старанно перемішують. Потім доливають 2 М CH3COONa, щоб оранжевий колір розчину (над осадом) змінився на жовтий. Якщо є Барій, випадає жовтий осад.
Амоній карбонат утворює з нейтральними або лужними розчинами солей барію білий аморфний осад BaCO3, який під час нагрівання переходить у кристалічний:
Ba2+ + CO32- = BaCO3¯.
Барій карбонат розчиняється в ацетатній та мінеральних кислотах (з H2SO4 утворюється осад BaSO4).
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1-2 краплі (NH4)2CO3. Якщо є іони Ba2+, то утворюється білий осад.
Сульфатна кислота (розведена) і розчинні сульфати утворюють з розчином солей барію білий дрібнокристалічний осад BaSO4:
Ba2+ + SO42- = BaSO4¯.
Ця реакція є дуже чутливою, проте виявленню іонів Ba2+ заважають іони Sr2+ та Ca2+, оскільки вони також осаджуються у вигляді сульфатів. Барій сульфат, як важкорозчинна сіль сильної кислоти, не розчиняється у розведених кислотах і лугах. Він помітно розчиняється у концентрованій сульфатній кислоті, у результаті чого утворюється барій гідрогенсульфат Ba(HSO4)2. Барій сульфат переводять у розчин, нагріваючи його з насиченим розчином Na2CO3. Водночас утворюється BaCO3, який потім розчиняють у кислоті:
BaSO4¯ + CO32– = BaCO3¯ + SO42–.
Оскільки BaCO3, що утворюється у процесі реакції, ліпше розчиняється у воді, ніж BaSO4, то реакцію можна довести до кінця, тільки багаторазово обробляючи BaSO4 насиченим розчином Na2CO3. Тому після нагрівання рідину зливають з осаду, доливають розчин Na2CO3 і знову нагрівають. Цю операцію повторюють декілька разів.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1-2 краплі H2SO4. Якщо є іони Ba2+, то утворюється білий кристалічний осад BaSO4.
1.3.3. Характерні реакції іонів Ca2+.Амоній оксалатутворює з іонами Ca2+ білий кристалічний осад кальцій оксалату:
Ca2+ + C2O42- = CaC2O4¯.
Осад CaC2O4 розчиняється в мінеральних кислотах, проте не розчиняється в ацетатній кислоті. Виявленню іонів Ca2+ заважають іони Ba2+ і Sr2+, які утворюють з (NH4)2C2O4 аналогічні осади. Реакцію виконують при рН~3,0-3,5.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1-2 краплі ацетатної кислоти, декілька крапель амоній оксалату і нагрівають. Якщо є іони Ca2+, то випадає білий осад.
Мікрокристалоскопічна реакція. Сульфатна кислота, взаємодіючи з розчинними солями кальцію, утворює характерні білі кристали гіпсу CaSO4×2H2O. Цією реакцією виявляють іони Ca2+ за наявності іонів Ba2+.
Виконання досліду. На предметному склі до краплини розчину солі кальцію додають краплину 1 М розчину H2SO4 і повільно випаровують. Якщо є іони Ca2+, то утворюються характерні пучки кристалів гіпсу CaSO4×2H2O, які можна побачити під мікроскопом.
Амоній карбонат (NH4)2CO3осаджує іони Ca2+ у вигляді білого аморфного осаду CaCO3. Під час нагрівання він стає кристалічним:
Ca2+ + CO32- = CaCO3¯.
Кальцій карбонат розчинний в ацетатній та мінеральних кислотах.
Виконання досліду. До 2–3 крапель досліджуваного розчину додають 1–2 краплі (NH4)2CO3. Якщо є іони Ca2+, то утворюється білий осад CaCO3.
Сульфатна кислота і сульфати лужних металів осаджують іони Ca2+ тільки з концентрованих розчинів солей кальцію, утворюючи білий осад CaSO4:
Ca2+ + SO42- = CaSO4¯.
Осад кальцій сульфату легше розчиняється у кислотах, ніж осади BaSO4 і SrSO4. Він також розчиняється у надлишку (NH4)2SO4, утворюючи комплексну сполуку:
CaSO4¯+ SO42– = [Ca(SO4)2]2–.
1.3.4. Характерні реакції іонів Mg2+. Магнезон І (п-нітробензол-азо-резорцин) у лужному середовищі забарвлений у червоно-фіолетовий колір. За наявності магній гідроксиду утворюється адсорбційна сполука синього кольору. Іони лужних і лужноземельних металів реакції не заважають, а їй перешкоджають іони Mn2+, Ni2+, Co2+, Cd2+.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1–2 краплі лужного розчину реактиву. Залежно від кількості Магнію у досліджуваному розчині утворюється синій осад або розчин синіє.
Натрій або амоній гідрогенфосфат з іонами Mg2+ у присутності водного розчину аміаку і NH4Cl утворює білий кристалічний осад MgNH4PO4:
Mg2+ + HPO42- + NH3 + 6H2O = MgNH4PO4×6H2O¯.
Сіль амонію додають для того, щоб не випав осад Mg(OH)2. Реакції заважають іони Ba2+, Ca2+ та інших важких металів.
Виконання досліду. До 1-2 крапель досліджуваного розчину додають 2-3 краплі 2 М HCl і 1-2 краплі Na2HPO4. Потім додають краплями 2 М водний розчин NH3. Після додавання кожної краплі суміш у пробірці помішують. Спочатку аміак нейтралізує кислоту, утворюючи NH4Cl. По закінченні нейтралізації починає випадати характерний кристалічний осад MgNH4PO4. Аміак треба додавати до слабколужної реакції (рН~9-10). З розведених розчинів осад випадає швидше, якщо потерти внутрішні стінки пробірки скляною паличкою.
1.3.5. Характерні реакції іонів Mn2+. Реакції окиснення мангану(ІІ) у вищі ступені мають велике значення для виявлення і відокремлення Мангану від інших елементів, а також для його кількісного визначення. Іони Mn2+ можна окиснити дією різних окисників у кислому і лужному середовищах. Розглянемо найважливіші реакції окиснення іонів Mn2+.
Амоній пероксидисульфат (NH4)2S2O8 за наявності каталізатора (іони Ag+) окиснює іони Mn2+ у MnO4-. Розчин при цьому забарвлюється у малиново-фіолетовий колір:
2Mn2+ + 5S2O82- + 24H2O = 2MnO4- + 10SO42- + 16H3О+.
Виконання досліду. У пробірку поміщають 2–3 кристалики (NH4)2S2O8 (або 1 мл 50% розчину), додають 0,5 мл 2 М розчину HNO3 і 2–3 краплі 0,1 М розчину AgNO3. Суміш нагрівають (не кип’ятять). У гарячий розчин занурюють скляну паличку, змочену досліджуваним розчином, і продовжують нагрівати пробірку (до 50°С) протягом 1-2 хв. За наявності Мангану розчин забарвлюється у малиново-фіолетовий колір. Якщо Мангану багато, а пероксидисульфату недостатньо і нагрівання сильне, то може випасти бурий осад MnO(OH)2. Не слід додавати багато AgNO3, оскільки утворюється аргентуму пероксид, який забарвлює розчин у жовтий колір.
Натрій бісмутату розчині нітратної кислоти окиснює іони Mn2+ до MnO4- за рівнянням:
2Mn2+ + 5BiO3- + 14H3О+ = 2MnO4- + 5Bi3+ + 21H2O.
Перебігу реакції заважають іони Сl–, які також окиснюються іонами MnO4-.
Виконання досліду. До 1-2 крапель досліджуваного розчину додають 3-4 краплі концентрованої HNO3, 5-6 крапель води і трохи порошку NaBiO3. Суміш перемішують і центрифугують. За наявності іонів Mn2+ розчин над осадом забарвлюється в малиново-фіолетовий колір.
Бромна або хлорна вода, гідроген пероксиду лужному середовищі окиснюють іони Mn2+ у MnO(OH)2 (або MnO2×2H2O) – у результаті утворюється осад бурого кольору:
Mn2+ + Br2 + 4OH- = MnO(OH)2¯ + 2Br- + H2O.
Виконання досліду. До однієї краплі досліджуваного розчину додають 5-7 крапель лужного розчину бромної води. Суміш перемішують і нагрівають. За наявності іонів Mn2+ випадає бурий осад.
2.3.6. Характерні реакції іонів Fe2+. Калій гексаціаноферат (ІІІ) K3[Fe(CN)6]утворює з іонами Fe2+ синій осад Fe3[Fe(CN)6]2 – так звану турнбулеву синь:
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯.
Осад Fe3[Fe(CN)6]2 не розчиняється у кислотах, проте розкладається лугами, у результаті чого утворюється Fe(OH)2.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають стільки ж крапель калію гексаціаноферату (ІІІ). Якщо є Fe2+, то утворюється темно-синій осад (реакцію проводять при рН~3).
1.3.7. Характерні реакції іонів Fe3+.Калій гексаціаноферат (ІІ) K4[Fe(CN)6] утворює з іонами Fe3+ темно-синій осад Fe4[Fe(CN)6]3 – так звану берлінську блакить:
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3¯.
Осад Fe4[Fe(CN)6]3 не розчиняється у розведених мінеральних кислотах; луги розкладають Fe4[Fe(CN)6]3, утворюючи Fe(OH)3:
Fe4[Fe(CN)6]3¯+ 12OH– = 4Fe(OH)3¯ + 3[Fe(CN)6]4–.
Перебігу реакції заважають іони (фосфат-, оксалат-, флуорид- та ін.), які утворюють з Fe3+ комплексні сполуки.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1-2 краплі K4[Fe(CN)6]. За наявності іонів Fe3+ утворюється осад синього кольору – берлінська блакить. Якщо іонів Fe3+ мало, то осад не випадає, а розчин забарвлюється в синій колір. Цією реакцією виявляють Fe3+-іони у суміші катіонів усіх інших аналітичних груп. Дослід можна виконати крапельним способом: на смужку фільтрувального паперу наносять по одній краплі досліджуваного розчину, 2 М розчину HCl і розчину K4[Fe(CN)6]. За наявності іонів Fe3+ утворюється синя пляма.
Калій або амоній тіоціанат (KSCN або NH4SCN) з іонами Fe3+ утворює низку забарвлених у червоний колір розчинних комплексних сполук: [FeSCN]2+, [Fe(SCN)2]+, [Fe(SCN)3] , [Fe(SCN)4]-. Чутливість реакції виявлення іонів Fe3+ за допомогою тіоціанату збільшується у процесі екстракції продукту реакції органічним розчинником, наприклад ефіром, бутиловим та ізобутиловим спиртами.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1-2 краплі HNO3 і 2-3 краплі калію або амонію тіоціанату. За наявності іонів Fe3+ розчин червоніє. Дослід можна виконати крапельним способом: на смужку фільтрувального паперу наносять по одній краплі досліджуваного розчину, розведеної HCl і 2-3 краплі розчину тіоціанату. Якщо є іони Fe3+, то на папері утворюється червона пляма.
1.3.8. Характерні реакції іонів Cr3+. Хром (ІІІ) у лужному середовищі окиснюється до CrO42-, а в кислому – до Cr2O72-. Іони Cr3+ до Cr2O72- окиснюються лише сильними окиснювачами (H2O2, Na2O2, KMnO4, Cl2, Br2, (NH4)2S2O8, та ін.)
Хром (ІІІ) у лужному середовищі найчастіше окиснюється H2O2, хлорною або бромною водою. У лужному середовищі хром (ІІІ) є у вигляді іона тетрагідроксохроміту (ІІІ). Реакцію записують так:
2[Cr(OH)4]- + 3Br2 + 8OH- = 2CrO42- + 6Br- + 8H2O.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 3-4 краплі 2 М розчину NaOH, 2-3 краплі бромної (хлорної) води або 3% розчину гідроген пероксиду і нагрівають на водяній бані до зміни зеленого забарвлення розчину на жовте. Наявність іонів CrO42- перевіряють реакцією утворення пероксихроматної кислоти H2CrO6.
Хром (ІІІ) у кислому середовищі окиснюють за допомогою KMnO4, (NH4)2S2O8 та багатьох інших сильних окисників:
2Cr3+ + 2MnO4- + 11H2O = Cr2O72- + 2MnO(OH)2¯ + 6H3О+.
Реакція відбувається під час нагрівання і супроводжується утворенням бурого осаду MnO(OH)2.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 2-3 краплі 1 М розчину H2SO4 або HNO3, 10-15 крапель KMnO4 і нагрівають. Якщо є Хром, то розчин забарвлюється в оранжевий колір. Частину розчину після охолодження досліджують на приcутність іона Cr2O72- за допомогою реакції утворення пероксихроматної кислоти.
Утворення пероксихроматної кислоти.Внаслідок взаємодії H2O2 з підкисленим розчином хромату або біхромату утворюється пероксихроматна кислота H2CrO6 і розчин забарвлюється в синій колір:
Cr2O72- + 4H2O2 + 2H3О+ = 2H2CrO6 + 5H2O.
У водному розчині пероксихроматна кислота дуже нестійка (вона розкладається з утворенням Cr3+), тому до розчину додають органічний розчинник (аміловий спирт або диетиловий ефір). Надхромова кислота у процесі перемішування переходить у шар цих розчинників, що сильно підвищує її стійкість.
Виконання досліду. У пробірку до 2-3 крапель розчину, одержаного за реакціями окиснення хрому (ІІІ), додають 1 М H2SO4 до кислої реакції, 0,5 мл амілового спирту, 4-5 крапель H2O2; якщо є іони хрому, то верхній шар розчину забарвлюється у темно-синій колір. Комбінуючи цю реакцію з будь-якою реакцією окиснення Cr3+ до Cr2O72-, можна використати її для дробного виявлення іонів хрому за наявності всіх інших катіонів.
1.3.9. Характерні реакції іонів Al3+. Алізарин S(натрієва сіль 1,2-діоксі-антрахінон-3-сульфокислоти) з іонами Al3+ у слабкокислому середовищі утворює комплексну сполуку червоного кольору AlOH[C14H6O3(OH)]2, яка не розчиняється в ацетатній кислоті. Вона має назву алюмінієвого лаку. Іони Fe3+, Bi3+, Cu2+ та деякі інші, утворюючи аналогічні забарвлені сполуки, заважають реакції.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 2 М водний розчин аміаку до лужної реакції (якщо випадає осад, то його відокремлюють центрифугуванням). До прозорого розчину додають 2-4 краплі розчину алізарину (з’являється фіолетове забарвлення) і краплями 2 М розчин CH3COOH (поки не зникне фіолетове забарвлення). За наявності іонів алюмінію залежно від їхньої концентрації випадає червоний осад або розчин червоніє.
Дослід можна виконати крапельним способом. Для цього на смужку фільтрувального паперу наносять краплю розчину K4[Fe(CN)6], а в її центр – краплю досліджуваного розчину. Сторонні іони осаджуються у вигляді гексаціанофератів і залишаються у центрі плями, а іони Al3+ по капілярах переміщаються на периферію. Після цього пляму обробляють парами аміаку, тримаючи папір над отвором склянки з розчином аміаку, і змочують розчином алізарину. Потім пляму знову обробляють парами аміаку, папір висушують, а пляму змочують 2 М розчином CH3COOH. За наявності іонів Al3+ з’являється рожеве кільце.
Алюмінон (амонійна сіль ауринтрикарбонової кислоти) з іонами Al3+ утворює комплексну сполуку червоного кольору.
Виконання досліду. До кількох крапель досліджуваного розчину додають 2-3 краплі 2 М розчину CH3COOH, 3-5 крапель розчину алюмінону і суміш нагрівають. Потім додають водний розчин NH3 до утворення слабколужної реакції (до появи запаху аміаку) і 2-3 краплі 1 М розчину Na2CO3. Якщо є іони алюмінію, то випадає червоний осад або розчин забарвлюється у червоний колір.
1.4. Третя аналітична група катіонів
(Cu2+, Zn2+, Ni2+, Co2+, Hg2+, Cd2+)
Груповим реагентом на катіони третьої аналітичної групи є водний розчин аміаку, який осаджує їх у вигляді гідроксидів, основних солей та амідосполук. Ці сполуки розчиняються у надлишку водного розчину NH3 з утворенням розчинних аміакатів. Фосфати катіонів третьої групи також розчинні в надлишку водного розчину NH3, тоді як фосфати катіонів другої аналітичної групи нерозчинні.
Більшість сполук катіонів третьої групи (сульфіди, карбонати, фосфати, силікати та ін.) малорозчинні у воді і багато з них забарвлені (сполуки купруму, нікелю, кобальту).
1.4.1. Загальні реакції катіонів третьої аналітичної групи.Гідрогенфосфати лужних металів і амонію утворюють білі кристалічні осади цинку і меркурію(ІІ) гідрогенфосфатів або фосфатів, голубий - купруму. Наприклад,
Cu2+ + HPO42- = CuHPO4¯.
Осади гідрогенфосфатів і фосфатів катіонів третьої аналітичної групи розчинні в ацетатній та мінеральних кислотах:
CuHPO4¯+ CH3COOH = Cu2+ + H2PO4– + CH3COO–.
Усі фосфати катіонів третьої аналітичної групи розчинні у водному розчині аміаку:
Zn3(PO4)2¯ + 12NH3 = 3[Zn(NH3)4]2+ + 2PO43-.
Купруму та цинку гідрогенфосфати і фосфати розчинні в надлишку їдких лугів:
CuHPO4¯ + 5OH– = [Cu(OH)4]2– + PO43– + H2O;
Zn3(PO4)2¯+ 12OH– = 3[Zn(OH)4]2– + 2PO43–.
Виконання досліду. До 2-3 крапель досліджуваного розчину того чи іншого катіона третьої аналітичної групи додають стільки ж амоній гідрогенфосфату. Важливо звернути увагу на колір осадів. Розчинність фосфатів катіонів третьої аналітичної групи випробовують у хлоридній, ацетатній кислотах, водному розчині аміаку та лугах.
Водний розчин аміаку осаджує катіони третьої аналітичної групи у вигляді гідроксидів або основних солей (гідроксосолей), які розчиняються у надлишку водного розчину аміаку з утворенням аміачних комплексів:
Cu2++2OH-=Cu(OH)2¯;
Cu(OH)2¯ + 4NH3 = [Cu(NH3)4]2+ + 2OH-.
Дією кислот аміакати руйнуються:
[Cu(NH3)4]2+ + 4H3О+ = Cu2+ + 4NH4+ + 4Н2О.
Виконання досліду. У пробірку поміщають 2-3 краплі розчину відповідної солі і повільно додають краплями водний розчин аміаку, спостерігаючи за утворенням осаду. Перемішуючи, додають надлишок реактиву, ще раз перемішують. Спостерігають розчинення осаду внаслідок утворення відповідних аміакатів.
Їдкі луги осаджують катіони третьої аналітичної групи у вигляді гідроксидів Cu(OH)2, Zn(OH)2, Hg(OH)2, причому Hg(OH)2 нестійкий і розкладається з виділенням HgO:
Hg(OH)2¯= HgO¯ + H2O.
Цинк гідроксид має амфотерні властивості і тому розчиняється у надлишку лугу з утворенням тетрагідроксоцинкатів:
Zn(OH)2¯ + 2OH- = [Zn(OН)4]2-.
У концентрованих лугах частково розчинний Cu(OH)2, утворюючи гідроксокупрати. Дослід виконують так, як і попередній.
1.4.2. Характерні реакції іонів Cu2+.Водний розчин аміаку, доданий у надлишку, утворює з іонами Cu2+ комплексну сполуку волошкового кольору:
Cu2+ + 4NH3 = [Cu(NH3)4]2+.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають краплями водний розчин аміаку, поки не випаде зеленувато-голубий осад основної солі, який розчиняється у надлишку реагенту. Якщо є іони Cu2+, то розчин забарвлюється у волошковий колір.
Калій гексаціаноферат (ІІ) K4[Fe(CN)6] при рН<7 утворює коричнево-червоний осад Cu2[Fe(CN)6]:
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]¯.
Осад розчинний у водному розчині NH3 і нерозчинний у розведених кислотах; розкладається лугами, у результаті чого утворюється блакитний осад купруму гідроксиду. Реакції заважають іони Fe3+.
Виконання досліду. До 1-2 крапель досліджуваного розчину додають
1-2 краплі K4[Fe(CN)6]. Якщо є іони Cu2+, утворюється коричнево-червоний осад Cu2[Fe(CN)6].
Натрій тіосульфат Na2S2O3 з іонами Cu2+ у кислому середовищі під час нагрівання утворює чорний осад Cu2S:
2Cu2+ + 3S2O32- + 3H2O = Cu2S¯ + S4O62- + SO42- + 2H3О+.
Реакції заважають іони Hg2+.
Виконання досліду. До 10-15 крапель досліджуваного розчину додають 1 М розчин H2SO4 до рН 2 і 2-3 кристалики натрію тіосульфату. Суміш нагрівають до початку кипіння. Якщо є іони Cu2+, то утворюється чорний осад Cu2S.
1.4.3. Характерні реакції іонів Zn2+.Амоній тетратіоціанатомеркурат (NH4)2[Hg(SCN)4] з іонами Zn2+ утворює білий кристалічний осад:
Zn2+ + [Hg(SCN)4]2- = Zn[Hg(SCN)4]¯.
Реакцію проводять у кислому середовищі. Концентрація кислоти (ліпше H2SO4) не повинна перевищувати 1 М. Реакції заважають іони Fe2+, які утворюють з реактивом осад зеленого кольору. Якщо є іони Fe3+, можуть утворюватися осади фіолетового кольору. Крім того, колір осаду маскується утворенням інтенсивно забарвленого Fe(SCN)3.
Виконання досліду. У пробірку поміщають 2-3 краплі досліджуваного розчину, підкислюють сульфатною кислотою (одна крапля 1 М розчину) і додають 2-3 краплі амонію тетратіоціанатомеркурату. Випадає білий кристалічний осад.
Дитизон (дифенілтіокарбазон) у розчині чотирихлористого карбону (або хлороформу) з іонами Zn2+ утворює внутрішньокомплексну сполуку яскраво-червоного кольору.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 1 мл ацетатної буферної суміші з рН 5 і 1-2 мл 10% розчину дитизону в CCl4 (або CHCl3). Якщо є іони Zn2+, то шар органічного розчинника забарвлюється у червоний колір. Заважають реакції іони Ag+, Bi3+, Pb2+, Cu2+. Щоб уникнути впливу цих іонів, перед введенням дитизону додають 4-5 крапель 0,5 М розчину натрій тіосульфату для зв’язування їх у комплекси.
1.4.4. Характерні реакції іонів Со2+. Тіоціанат-іони SCN– з іонами Co2+ утворюють комплексний аніон [Co(SCN)4]2– синього кольору. Реакція відбувається при рН 4-5. Надлишок NH4SCN зміщує рівновагу процесу у бік утворення комплексу, що підвищує чутливість реакції:
Co2+ + 4 SCN–D [Co(SCN)4]2–.
Бажано проводити цю реакцію в присутності органічних розчинників, які зменшують дисоціацію комплексу.
Виконання досліду. До 2–3 крапель розчину додають 1–2 краплі 2 М СН3СООН, 2–3 краплі насиченого розчину (або кілька кристалів) NH4SCN і 0,5 мл суміші амілового спирту та діетилового ефіру. Комплекс, що утворився, екстрагується органічним розчинником, який забарвлюється у синій колір. Якщо замість суміші амілового спирту з ефіром додати ацетон, то увесь розчин забарвлюється у синій колір.
Реактив – 1-нітрозо-2-нафтол – з іонами Со2+ утворює темно-червоний осад внутрішньокомплексної сполуки [Co10H6(NO)O]3Co, нерозчинної у кислотах і лугах. При цьому спочатку Со2+ окиснюється реактивом до Со3+, який утворює осад. Реакцію проводять у кислому середовищі.
Виконання досліду. 1–2 краплі досліджуваного розчину підкислюють хлоридною кислотою, нагрівають та додають кілька крапель розчину реактиву в ацетатній кислоті (необхідно мати надлишок реактиву) і знову нагрівають. Утворюється осад темно-червоного кольору.
Малі кількості Со2+ виявляють крапельним способом: краплю розчину, який містить Со2+, наносять на фільтрувальний папір і додають краплю лужного розчину 1-нітрозо-2-нафтолу. За наявності Со2+ утворюється червона пляма.
1.4.5. Характерна реакція іонів Ni2+.Реактив Чугаєва Л.А. – диметилгліоксим – з іонами нікелю Ni2+ утворює червоний осад внутрікомплексної сполуки – сіль, яку називають диметилгліоксиматом нікелю:

Опимальне середовище – рН 5-10. Реакції заважають іони Fe2+, Сu2+.
Виконання досліду. До двох-трьох крапель досліджуваного розчину добавляють 1-2 краплі розчину NH3, дві-три краплі 1%-ного спиртового розчину диметилгліоксиму. У присутності Ni2+ утворюється червоний осад диметилгліоксимату.
1.4.6. Характерні реакції іонів Сd2+. Розчин К[BiJ4] розкладається дією іонів Cd2+, оскільки останній утворює з йодид-іонами безбарвну комплексну сполуку. При цьому випадає чорний осад ВіJ3:
Сd2+ + 2[BiJ4]– "CdJ2 + 2BiJ3¯.
Виконання досліду. Краплю досліджуваного розчину поміщають на крапельну пластинку або на кусок фільтрувального паперу і добавляють краплю К[BiJ4]. У присутності іонів Сd2+ з’являється чорна пляма утвореного BiJ3, який зникає при додаванні КJ або Na2S2O3.
Для одержання К[BiJ4] беруть декілька крапель солі вісмуту і додають КJ до утворення чорного осаду BiJ3, який розчиняють у надлишку КJ з утворенням [BiJ4]– оранжевого кольору:
Bi3+ + 3J– " BiJ3$;
BiJ3 + J– " [BiJ4]–.
Сульфід-іони (розчин Н2S або Na2S) з іонами Сd2+ при рН 3-10 утворюють жовтий осад сульфіду кадмію.
Сd2+ + S2– = CdS$.
Реакції заважають всі іони, які в цих умовах утворюють сульфіди, тому їх попередньо відокремлюють.
Виконання досліду. Дві-три краплі досліджуваного розчину поміщають у пробірку, перевіряють і регулюють рН. Потім добавляють 1-2 краплі розчинуNa2S, перемішують. Спостерігають за утворенням жовтого осаду CdS.
1.4.7. Характерні реакції іонів Hg2+.Металічна мідь відновлює іони Hg2+ до металу:
Hg2+ + Сu¯ = Cu2+ + Hg¯.
Виконання досліду. На поверхню мідної пластинки, очищену нітратною кислотою, наносять краплю досліджуваного розчину. Через деякий час розчин з пластинки змивають водою, а пластинку протирають м’якою тканиною або фільтрувальним папером. Поверхня пластинки вкривається тонким шаром ртуті і стає світлою та блискучою.
Станум (ІІ) хлорид SnCl2 спочатку відновлює меркурій (ІІ) хлорид до меркурію (І) хлориду Hg2Cl2 (каломелі) – білого осаду, що не розчиняється у воді. Якщо додати надлишок SnCl2, то осад поступово сіріє внаслідок відновлення меркурію (І) до металічного. Реакції відбуваються за рівняннями:
2HgCl2 + SnCl2 = Hg2Cl2¯ + SnCl4;
Hg2Cl2 ¯+ SnCl2 = 2Hg¯ + SnCl4.
Реакцію проводять у кислому середовищі. Заважають реакції іони Ag+, Pb2+,  , які утворюють з іонами Cl- малорозчинні осади.
, які утворюють з іонами Cl- малорозчинні осади.
Виконання досліду. Декілька крапель досліджуваного розчину підкислюють краплею хлоридної кислоти і додають 3-4 краплі свіжовиготовленого розчину SnCl2. Утворюється білий осад Hg2Cl2, який швидко темніє внаслідок виділення металічної ртуті.
Натрій тіосульфат у процесі нагрівання з солями меркурію(ІІ) в кислому середовищі (рН 2) утворює осад чорного кольору HgS, який розчинний у царській воді, в суміші HCl + H2O2 або HCl + KJ:
Hg2+ + 3S2O32– + 2H3О+ = HgS¯ + 2S¯ + SO42– + 2SO2 + 3H2O.
Реакції заважають іони Ag+, Cu2+, Pb2+.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 2-3 краплі 1 М розчину H2SO4 і декілька кристалів Na2S2O3. Суміш перемішують і нагрівають майже до кипіння. Випадає чорний осад HgS.
1.5. П’ята аналітична група катіонів (Ag+,  , Pb2+)
, Pb2+)
Груповим реагентом п’ятої аналітичної групи катіонів є розведений розчин хлоридної кислоти, яка осаджує ці іони у вигляді хлоридів AgCl, Hg2Cl2, PbCl2. Більшість сполук катіонів п’ятої групи безбарвні і малорозчинні у воді. Забарвленими є лише сполуки, які утворені забарвленими аніонами. Катіони цієї групи схильні до утворення комплексних сполук типу [Ag(NH3)2]+, [AgI4]3-, [PbI4]2-, [AgCl3]2-, [Ag(CN)2]- та ін.; вони легко вступають у реакції окиснення – відновлення.
1.5.1. Загальні реакції катіонів п’ятої аналітичної групи.Лужних металів і амонію гідрогенфосфатиутворюють білі кристалічні осади аргентуму, плюмбуму і меркурію(І) гідрогенфосфатів і фосфатів:
2Ag+ + HPO42- = Ag2HPO4¯;
3Pb2+ + 2HPO42- + 2OH- = Pb3(PO4)2¯ + 2H2O.
Фосфати і гідрогенфосфати катіонів п’ятої групи розчинні в ацетатній та нітратній кислотах; у водному розчині аміаку розчиняються аргентуму фосфати і гідрогенфосфати:
Ag3PO4 ¯ + 2CH3COOH = 2CH3COO– +3Ag+ + H2PO4–;
PbHPO4¯ + 2H3O+ = H3PO4 + Pb2+ + 2Н2О;
Ag2HPO4¯ + 5NH3 = 2[Ag(NH3)2]+ + NH4+ + PO43-.
Плюмбум фосфат та гідрогенфосфат розчинні в надлишку їдкого лугу:
Pb3(PO4)2¯+ 18OH– = 3[Pb(OH)6]4– + 2PO43–.
Меркурій (І) гідрогенфосфат і фосфат під дією водного розчину NH3 утворюють чорний осад (HgNH2)3PO4×3Hg:
(Hg2)3(PO4)2¯+ 6NH3 = (HgNH2)3PO4¯ + 3Hg¯ + PO43- + 3NH4+.
Виконання досліду. До 2-3 крапель розчинів солей аргентуму, плюмбуму і меркурію(І) додають 3-4 краплі розчину фосфату лужного металу. Випадають осади відповідних фосфатів, які розділяють на декілька частин, після чого їх випробовують на розчинність у перелічених реагентах.
Розведена хлоридна кислота осаджує катіони Ag+,  , Pb2+ у вигляді білих малорозчинних осадів AgCl, Hg2Cl2 та PbCl2 відповідно. Аргентум хлорид розчинний у водному розчині аміаку і амоній карбонаті з утворенням комплексних іонів складу [Ag(NH3)2]+. Характерною особливістю PbCl2 є його розчинність у гарячій воді. Плюмбум й аргентум хлориди розчинні в надлишку концентрованої HCl з утворенням комплексних іонів [AgCl2]-, [PbCl3]-, [PbCl4]2-.
, Pb2+ у вигляді білих малорозчинних осадів AgCl, Hg2Cl2 та PbCl2 відповідно. Аргентум хлорид розчинний у водному розчині аміаку і амоній карбонаті з утворенням комплексних іонів складу [Ag(NH3)2]+. Характерною особливістю PbCl2 є його розчинність у гарячій воді. Плюмбум й аргентум хлориди розчинні в надлишку концентрованої HCl з утворенням комплексних іонів [AgCl2]-, [PbCl3]-, [PbCl4]2-.
Виконання досліду. У три пробірки відбирають по 2-3 краплі розчинів солей відповідних іонів, додають по 2-3 краплі 2 М розчину HCl і перемішують. Осади в кожній пробірці розділяють на три частини і вивчають вплив на них водного розчину NH3, концентрованої HCl і гарячої води.
Їдкі луги з катіонами п’ятої групи утворюють малорозчинні осади гідроксидів і оксидів Pb(OH)2, AgOH, Ag2O, Hg2O:
2Ag+ + 2OH- = 2AgOH¯;
2AgOH¯= Ag2O¯ + H2O.
Плюмбум гідроксид розчинний у надлишку лугу з утворенням іонів [Pb(OH)6]4-:
Pb(OH)2¯ + 4OH- = [Pb(OH)6]4-.
Виконання досліду. До 2-3 крапель розчинів солей плюмбуму, аргентуму, меркурію (І) додають краплями розчин лугу і спостерігають за забарвленням осадів, що утворюються. У пробірці, де є розчин солі плюмбуму, утворюється білий осад; у пробірці з розчином солей аргентуму і меркурію (І) – чорні. Якщо є надлишок лугу, осад Pb(OH)2 розчиняється з утворенням іонів гексагідроксоплюмбітів, а осади аргентуму і меркурію (І) в надлишку лугу нерозчинні.
1.5.2. Характерні реакції іонів Ag+.Хлоридна кислота утворює з іонами Ag+ білий осад AgCl:
Ag+ + Cl- = AgCl¯.
Аргентум хлорид під впливом світла розкладається, водночас виділяється дрібнодисперсне металічне срібло й осад чорніє.
Концентрована HCl не повністю осаджує іон Ag+, тому що утворює з ним розчинний комплексний іон [AgCl2]-:
AgCl¯ + Cl- = [AgCl2]-.
Аргентум хлорид розчиняється у водному розчині аміаку і знову випадає в осад, якщо підкислювати цей розчин нітратною кислотою:
AgCl¯ + 2NH3 = [Ag(NH3)2]+ + Cl–;
[Ag(NH3)2]+ + Cl– + 2H3O+ = AgCl¯ + 2NH4+ + 2H2O.
За цією реакцією можна виявляти іони аргентуму в складній суміші катіонів. Реакція осадження аргентум хлориду відбувається у кислих розчинах при рН<7; при рН>7 утворюється Ag2O. Реакції заважають іони  , Pb2+ та ін.
, Pb2+ та ін.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 2-3 краплі 2 М розчину HСl. За наявності іонів Ag+ випадає білий осад, який розділяють на дві частини і випробовують його розчинність у HNO3 і у водному розчині аміаку. До одержаного розчину, що містить комплексні іони аргентуму, додають краплю фенолфталеїну, концентровану HNO3 (до зникнення рожевого забарвлення) і ще 1-2 краплі надлишку. Випадає білий осад AgCl.
Калій йодид утворює з іонами Ag+ жовтий осад AgJ:
Ag+ + J- = AgJ¯.
Виконання досліду. До 2-3 крапель досліджуваного розчину додають 2-3 краплі розчину калій йодиду. За наявності іонів Ag+ випадає жовтий осад аргентум йодиду, нерозчинний у H2SO4 і HNO3. На відміну від аргентум хлориду (ДР (AgCl) =1,78×10-10), аргентум йодид не розчиняється у водному розчині NH3 (ДР (AgJ) =8,3×10-17).
1.5.3. Характерні реакції іонів  .Розведена HСl утворює з іонами
.Розведена HСl утворює з іонами  осад білого кольору:
осад білого кольору:
 + 2Сl- = Hg2Cl2¯.
+ 2Сl- = Hg2Cl2¯.
Осад Hg2Cl2, як і AgCl, розчинний у надлишку HСl з утворенн