Таким образом, чем больше концентрации реагирующих веществ, тем больше скорость реакции
Понятие химического равновесия.
Константа равновесия
Смещение химического равновесия. Принцип Ле Шателье
3.1 Изменение концентрации какого-либо из исходных веществ, участвующих в реакции (температура и давление постоянны)
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема, температура постоянна)
Нарушение равновесия вследствие изменения температуры
Основные типы задач на химическое равновесие
Понятие химического равновесия
Все химические реакции можно разделить на 2 группы:
– реакции необратимые, т.е. протекающие до полного израсходования одного из реагирующих веществ. Это связано с тем, что необратимая реакция протекает только в одном направлении;
– реакции обратимые, в которых ни одно из реагирующих веществ не расходуется полностью. Обратимая же реакция может протекать как в прямом, так и в обратном направлении.
Например, необратимая реакция:
Zn + H2SO4 ® ZnSO4+ H2
протекает до полного исчезновения либо серной кислоты, либо цинка и не протекает в обратном направлении: металлический цинк и серную кислоту невозможно получить, пропуская водород в водный раствор сульфата цинка.
Классическим примером обратимой реакции может служить реакция образования аммиака из азота и водорода:
N2 + 3 H2 ⇆ 2 NH3
Если при высокой температуре смешать 1 моль азота и 3 моль водорода, то даже после достаточно длительного промежутка времени протекания реакции в реакторе будут присутствовать не только продукт реакции (NH3), но и непрореагировавшие исходные вещества (N2 и H2). Если в реактор при тех же условиях ввести не смесь азота и водорода, а чистый аммиак, то через некоторое время окажется, что часть аммиака разложилась на азот и водород, т.е. реакция протекает в обратном направлении.
Для понимания природы химического равновесия необходимо рассмотреть вопрос о скоростях прямой и обратной реакций.
Под скоростью химической реакции понимают изменение концентрации исходного вещества или продукта реакции за единицу времени.
При изучении вопросов химического равновесия концентрации веществ выражают в моль/л; эти концентрации показывают, сколько моль данного реагирующего вещества содержится в 1 литре сосуда.
Химические реакции осуществляются в результате столкновений между молекулами, поэтому, чем больше молекул находится в единице объёма, тем чаще происходят столкновения между ними, и тем больше скорость реакции.
Таким образом, чем больше концентрации реагирующих веществ, тем больше скорость реакции.
Рассмотрим обратимую реакцию:
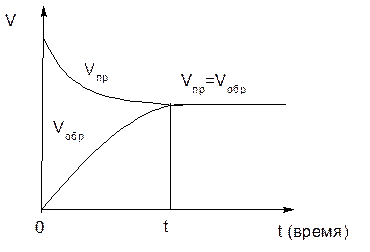
Рисунок 1– Изменение скоростей прямой и обратной реакции во времени
Концентрации исходных веществ (А и В) в системе максимальны в момент начала реакции (в момент времени t = 0). В начале (в момент времени t = 0) реакции в системе ещё отсутствуют продукты реакции (С и D), следовательно, скорость обратной реакции равна нулю. По мере взаимодействия исходных веществ (А и В) друг с другом, их концентрации уменьшаются, следовательно, уменьшается и скорость прямой реакции. Концентрация же продуктов реакции (С и D) постепенно возрастает, следовательно, возрастает и скорость обратной реакции. Через некоторое время скорость прямой реакции становится равна скорости обратной.
Vпр = kпр· [A] · [B], Vоб = kоб · [D] · [С]
Vпр = Vоб
Это состояние системы называется состоянием химического равновесия
В состоянии химического равновесия в системе не наблюдается никаких видимых изменений. Так, например, концентрации всех веществ могут сколь угодно долго оставаться неизменными, если на систему не оказывать внешнего воздействия. Это постоянство концентраций в системе, находящейся в состоянии химического равновесия, совсем не означает отсутствия взаимодействия и объясняется тем, что прямая и обратная реакции протекают с одинаковой скоростью. Такое состояние также называют истинным химическим равновесием. Таким образом, истинное химическое равновесие является динамическим равновесием.
От истинного равновесия следует отличать равновесие ложное. Постоянство параметров системы (концентраций веществ, давления, температуры) является необходимым, но недостаточным признаком истинного химического равновесия. Это можно пояснить следующим примером. Взаимодействие азота и водорода с образованием аммиака, как и разложение аммиака, протекает с заметной скоростью при высокой температуре (около 500 °С). Если при комнатной температуре смешивать в любых соотношениях водород, азот и аммиак, то реакция N2 + 3 H2 ⇆ 2 NH3
протекать не будет, и все параметры системы будут сохранять постоянное значение. Однако в данном случае равновесие является ложным, а не истинным, т.к. оно не является динамическим; в системе отсутствует химическое взаимодействие: скорость как прямой, так и обратной реакции равна нулю.
При дальнейшем изложении материала термин «химическое равновесие» будет использоваться применительно к истинному химическому равновесию.
Константа равновесия
Химическое равновесие – это состояние химической системы, при котором скорости прямой и обратной реакций равны и не изменяются во времени.
Состав реакционной смеси, соответствующий состоянию равновесия, называется равновесным составом,а концентрации веществ, находящихся в равновесии, называются равновесными концентрациями.Равновесный состав зависит от природы веществ, участвующих в равновесии, от соотношения количеств исходных веществ, а также от внешних условий (температуры, давления). При изменении любого из этих факторов равновесный состав изменяется — равновесие смещается.
Количественной характеристикой системы в состоянии химического равновесия является константа равновесия K.
Итак, при равновесии Vпр = Vоб
или kпр · [A]·[B] = kоб · [С] · [D]
откуда – константа химического равновесия:

Как быть, если реакции характеризуются наличием отличных от единицы коэффициентов:


Например: выражение константы равновесия для реакции синтеза аммиака имеет следующий вид:
N2+3H2 ⇆ 2NH3
Кравн = [NH3]2 / [N2] · [H2]3
Таким образом, численная величина константы химического равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, причём концентрация каждого вещества должна быть возведена в степень, равную стехиометрическому коэффициенту в уравнении реакции.
Важно понимать, что константа равновесия выражается через равновесные концентрации, но не зависит от них; напротив, соотношение равновесных концентраций участвующих в реакции веществ будет таким, чтобы соответствовать константе равновесия. Константа равновесия зависит от природы реагирующих веществ и температуры и представляет собой постоянную (при постоянной температуре) величину.
Константа равновесия — одна из важнейших характеристик химической системы, позволяющая судить о возможности протекания того или иного химического процесса и глубины его протекания.
Если К>>1, процесс сильно сдвинут в сторону получения продуктов реакции. Реакция пройдет достаточно глубоко, почти до конца, т. е. исходные вещества, взятые в стехиометрическом соотношении, вступят в реакцию практически полностью.
Если К<<1, наоборот, процесс сдвинут влево и практически не идет. Это означает, что, взяв чистые исходные вещества, удастся провести реакцию при этих условиях (при данной температуре) лишь в незначительной степени.
Если К ≈ 1, то равновесные концентрации исходных веществ и продуктов реакции сопоставимы; реакция в заметной степени протекает как в прямом, так и в обратном направлении.
Следует иметь в виду, что в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой фазе или в растворённом состоянии (если реакция протекает в растворе). Если в реакции участвует твёрдое вещество, то взаимодействие происходит на его поверхности, поэтому концентрация твёрдого вещества принимается постоянной и не записывается в выражение константы равновесия.
Например:
CO2 (газ) + C (тв.) ⇆ 2 CO (газ)
Кравн = [СО]2 / [СО2]
CaCO3 (тв.) ⇆ CaO (тв.) + CO2 (газ)
Кравн = [СО2]
Ca3(PO4)2 (тв.) ⇆ 3Ca2+ (раствор) + 2PO43–(раствор)
Кравн = [Са+2]3 · [PO43–]2