ПЕРЕРАХУНОК КОНЦЕНТРАЦІЙ ГАЗІВ
Затверджено
На засіданні кафедри технології
Неорганічних речовин та екології
Протокол №8 від 21.04. 2013р
Дніпропетровськ УДХТУ 2014
Методичні рекомендації до практичних занять і самостійної роботи з курсу «Нормування антропогенного навантаження на природне середовище» для студентів спеціальності 7.040106 – Екологія, охорона навколишнього середовища та збалансоване природокористування / Укл.: В.В.Архипова, В.М.Набивач. – Дніпропетровськ: ДВНЗ УДХТУ, 2014. – 71 с.
Укладачі: В.В. Архипова, канд. техн. наук
В.М. Набивач, д-р хім. наук
Відповідальний за випуск: О.А.Півоваров, д-р техн. наук
Навчальне видання
Методичні вказівки
до практичних занять і самостійної роботи
з курсу «Нормування антропогенного навантаження
на природне середовище»
для студентів спеціальності 7.040106 – Екологія, охорона
навколишнього середовища та збалансоване природокористування
Укладачі: АРХИПОВА Вікторія Вікторівна
НАБИВАЧ Валентин Михайлович
Редактор Л. М. Тонкошкур
Коректор Л. Я. Гоцуцова
Підписано до друку Формат 60x84 1/16. Папір ксерокс. Друк різограф Ум.– друк. арк. Обл.– вид. арк. Тираж 50 прим. Зам. №
Свідоцтво ДК №303 від 27.12.2000р.
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– ДВНЗ УДХТУ, 49005, Дніпропетровськ- 5, пр. Гагаріна, 8
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– Видавничо-поліграфічний комплекс Ін Ком Центру
ЗМІСТ
| Стор. | |
| ВСТУП………………………………………………………………………. | |
| 1 ПЕРЕРАХУНОК КОНЦЕНТРАЦІЙ ГАЗІВ…………………………….. | |
| 1.1 Приклади розв'язання задач……………………………………………. | |
| 1.2 Задачі для самостійного розв'язання………………………………...... | |
| 2 ВИЗНАЧЕННЯ КОНЦЕНТРАЦІЇ ШКІДЛИВИХ РЕЧОВИН ТА ОЦІНКА ЯКОСТІ ПОВІТРЯ………………………………………………. | |
| 2.1 Приклади розв’язання задач……………………………………………. | |
| 2.2 Задачі для самостійного розв’язання | |
| 3 ВИЗНАЧЕННЯ КОЕФІЦІЕНТІВ РОЗВЕДЕННЯ ДЛЯ ПРИВЕДЕННЯ КОНЦЕНТАЦІЇ ШКІДЛИВИХ РЕЧОВИН ДО ВЕЛИЧИНИ ГДК………………………………………………………………………….. | |
| 3.1 Задачі для самостійного розв’язання………………………………….. | |
| 4 ВПЛИВ ОКСИДУ ВУГЛЕЦЮ НА ЗДОРОВ’Я ЛЮДИНИ…………… | |
| 4.1 Задачі для самостійного розв’язання………………………………….. | |
| 5 РОЗРАХУНКИ ЗАБРУДНЕННЯ ПРИЗЕМНОГО ШАРУ АТМОСФЕРИ……………………………………………………………….. | |
| 5.1 Розрахунок максимальної приземної концентрації………………....... 5.1.1 Задачі для самостійного розв'язання………………………………… | |
| 5.2. Розрахунок гранично допустимого викиду…………………………… | |
| 5.2.1 Задачі для самостійного розв’язання ……………………………….. | |
| 5.3 Визначення потужності викиду та висоти труби…………………...... | |
| 5.3.1 Задачі для самостійної роботи……………………………………….. | |
| 6 НОРМУВАННЯ ЯКОСТІ ПРИРОДНИХ ВОДОЙМИЩ………………. | |
| 6.1 Визначення концентрації шкідливих речовин у природних водоймах і стічних водах………………………………………………………………. | |
| 6.1.1 Задачі для самостійного розв’язання……………………………....... | |
| 7 ЖОРСТКІСТЬ ВОДИ ТА ШЛЯХИ ЇЇ ПОМ'ЯКШЕННЯ……….………. | |
| 7.1 Задачі для самостійного розв’язання………………………………….. | |
| 8 ВИЗНАЧЕННЯ УМОВ ВІДВЕДЕННЯ СТІЧНИХ ВОД У ВОДНІ ОБ'ЄКТИ…………………………………………………………………….. | |
| 8.1 Визначення ступеню змішування та розбавлення стічних вод, що надходять у водойму……………………………………………………….. | |
| 8.1.2.Задачі для самостійного рішення…………………………………… | |
| 8.2 Визначення ступеню очистки стічних вод перед скиданням їх у водойму та розрахунок гранично допустимого скиду (ГДС)……………. | |
| 8.2.1 Задачі для самостійного розв’язання ………………………………… | |
| 8.3 Розрахунок необхідного ступеню очищення стічних вод за зваженими речовинами…………………………………………………...... | |
| 8.4 Розрахунок допустимої температури стічних вод перед спуском у водойму………………………………………………………………………. | |
| 8.5 Визначення необхідного ступеню очищення стічних вод за БСК та вмісту розчиненого кисню………………………………………………….. | |
| 8.6 Розрахунок ступеня очищення стічних вод за вмістом шкідливих речовин………………………………………………………………………. | |
| 8.6.1 Задачі для самостійного розв’язання…………………………………. | |
| 9 ОЦІНКА РІВНЯ ХІМІЧНОГО ЗАБРУДНЕННЯ ПОЧВИ…………....... | |
| 9.1 Задачі для самостійного розв’язання…………………………………… | |
| СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ………………………………. | |
| ДОДАТОК А…………………………………………………………………. |
ВСТУП
Головним завдання курсу «Нормування антропогенного навантаження на природне середовище» є надання і формування системи знань про принципи санітарно-гігієнічного нормування забруднюючих речовин в об`єктах довкілля і харчових продуктах, критерії і концепції оцінки токсичності шкідливих речовин, шляхи трансформації хімічних речовин в об`єктах довкілля та їх наслідки, методи управління процесами збалансованого природокористування.
Оскільки лекції як форма навчання забезпечують в основному передачу лише знань засвоюваної дисципліни, вони повинні поєднуватися з практичними заняттями, на яких слід закріплювати і поглиблювати одержувані на лекціях знання і виробляти вміння і навички практичної діяльності.
Практичні заняття передбачають надання студентам навичок по користуванню табличними даними і розрахунковими рівняннями для визначення небезпеки і токсичності шкідливих речовин, що надходять в атмосферне повітря і водойми, для оцінювання класу небезпеки підприємств та їх нормативних показників (ГДВ, ТДВ, ГДС), для визначення необхідного ступеню очистки стічних вод перед скиданням їх у водойми і показників питної води.
Першою умовою ефективності практичних занять є повторення теоретичного матеріалу кожної теми практичних занять по навчальному посібнику і конспекту лекцій.
При вирішуванні кожної задачі студенти повинні намагатися не тільки одержати правильну відповідь, але і опанувати загальний метод рішення подібних задач. Записав умови задачі, не слід відразу записувати формули і підставляти одержані дані. Необхідно спочатку уявити увесь розвиток рішення і тільки потім починати обчислювання. При рішенні задачі повинен бути приведений увесь хід розрахунку, пояснення до кожного рівняння і, обов’язково, висновок.
На практичних заняттях рекомендується вести запис розрахунків у строго визначеній системі, яка полегшує роботу, виявляє і підкреслює методику розрахунку, а також дає можливість легко перевірити хід рішення і виявити помилку. Особливу увагу слід приділити чіткому написанню цифр, одиниць вимірювання одержаних величин та умінню користуватися довідниками і таблицями нормативних показників.
В кожному розділі «Методичних рекомендацій», крім прикладів рішення різних задач, студентам пропонується серія аналогічних задач для самостійної роботи і підготовки до контрольної роботи, яка передбачається наприкінці.
ПЕРЕРАХУНОК КОНЦЕНТРАЦІЙ ГАЗІВ
Для кількісної характеристики газоподібних викидів зазвичай використовують об'ємні і масові концентрації шкідливих речовин. Так, окрім концентрацій, виражених через масу (мг/м³), використовують також об'ємні відсотки. Перерахунок із масових в об'ємні одиниці виміру здійснюється за формулою:
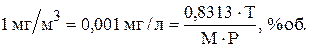 ,
,
Або за рівнянням:
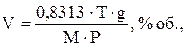 (1.1)
(1.1)
де V – концентрація, % об; g – концентрація, мг/м³; Т – абсолютна температура газу, К; М – молекулярна маса газу, кг; Р – атмосферний тиск, Па.
Зворотній перерахунок концентрацій із об'ємних відсотків в мг/м3 здійснюється за формулою:
 (1.2)
(1.2)
В зарубіжній літературі величини концентрацій у деяких випадках виражаються в одиницях ppm або ppb, хоча ці одиниці не відповідають рекомендаціям Всесвітньої організації охорони здоров'я (ВООЗ) та Міжнародного Стандарту (ISO 4226).
Абревіатура ppm означає мільйонну частку яких-небудь відносних величин (  від базового показника). Скорочення ppm походить від англ. «parts per million»(читається «пі-пі-ем») та рівнозначно позначенню млн
від базового показника). Скорочення ppm походить від англ. «parts per million»(читається «пі-пі-ем») та рівнозначно позначенню млн  :
:


Для масових концентрацій:  . Якщо йдеться про об'ємні концентрації (об'ємні долі), то
. Якщо йдеться про об'ємні концентрації (об'ємні долі), то  . Так, об'ємна концентрація вуглекислого газу в атмосфері Землі становить близько 380 ppm, тобто в 1м³ повітря міститься 380 мл СО
. Так, об'ємна концентрація вуглекислого газу в атмосфері Землі становить близько 380 ppm, тобто в 1м³ повітря міститься 380 мл СО  .
.
Абревіатура ppb (англ. «parts per billion») позначає мільярдну частку, тобто млрд  або 10
або 10  .
.
Величини ppm і ppb використовують для характеристики невеликої кількості речовин: домішок забруднювачів в повітрі і воді, мікротоксинів в живих організмах, мікрокількостей корисних копалин.
Наступна мала величина – проміле (‰) – використовується для позначення кількості тисячних часток будь-чого в цілому:
1 ‰=0,001=0,1 %=1000 ppm.
Традиційно деякі величини (частки) вимірюються в ‰: солоність води, рівень вмісту алкоголю в крові людини, уклон залізничної колії та ін.
Перерахунок концентрацій із мг/м³ в одиниці ppm здійснюється за формулою:
 , (1.3)
, (1.3)
де С – концентрація, млн  (або ppm).
(або ppm).
1.1 Приклади розв'язання задач
Приклад 1.1.1. У вихідних газах вміст оксиду вуглецю складає 2500 мг/м³. Атмосферний тиск Р=101325 Па, температура газів 25 ºС. Визначити концентрацію СО (М=28) в об'ємних відсотках.
Розв'язання. За рівнянням (1.1) знаходимо:

Приклад 1.1.2. У вихідних газах вміст сірчистого ангідриду складає 0,15% об. Атмосферний тиск Р=101325 Па, температура 25 ºС. Визначити концентрацію SО  (М=64) в мг/м³.
(М=64) в мг/м³.
Розв'язання. За рівнянням (1.2) знаходимо:
 .
.
Приклад 1.1.3. Приземна концентрація сірчаної кислоти при Р=101325 Па і температурі 25ºС дорівнює 14 мг/м³. Визначити концентрацію H2SO4 (M=98) в одиницях ppm.
Розв'язання. За рівнянням (1.3) знаходимо:

Для перерахунку концентрації в повітрі та газах, за нормальних умов (Р=101325 Па, t=25ºС), нижче наведені співвідношення для найбільш розповсюджених речовин.
| Речовина | 1мг/м³=ppm | 1ppm=мг/м³ |
| O3 | 0,509 | 1,963 |
| CO2 | 0,556 | 1,800 |
| CO | 0,873 | 1,145 |
| NO2 | 0,532 | 1,881 |
| CH4 | 1,528 | 0,654 |
| NH3 | 1,438 | 0,695 |
| SO2 | 0,382 | 2,620 |
| H2S | 0,719 | 1,391 |
| NO | 0,815 | 1,227 |
| 3,4-Бензпірен | 0,097 | 10,310 |
| Бензол | 0,313 | 3,19 |
| Етан | 0,815 | 1,227 |
| Етилен | 0,873 | 1,145 |
| Формальдегід | 0,815 | 1,227 |
Приклад 1.1.4. Концентрація двоокису азоту за нормальних умов складає 50ppm. Виразити цю концентрацію в мг/м³.
Розв'язання. З наведеної таблиці знаходимо, що 1ppm NO  відповідає 1,881 мг/м³. Тоді g = 50·1,881 = 94,05мг/м³.
відповідає 1,881 мг/м³. Тоді g = 50·1,881 = 94,05мг/м³.
Приклад 1.1.5. Вміст сірководню у коксовому газі за нормальних умов складає 32мг/м³. Виразити цю концентрацію в частках на 1млн.
Розв'язання. З наведеної таблиці знаходимо, що концентрація H2S 1мг/м³ відповідає 0,719 млн  . Отже, С = 32·0,719 = 23млн
. Отже, С = 32·0,719 = 23млн  або ppm.
або ppm.
На підставі наведених табличних даних можна проводити також перерахунок масових одиниць в об'ємні відсотки і навпаки.
Приклад 1.1.6. Концентрація оксиду вуглецю у димових газах становить 0,015 %об. Визначити концентрацію СО в мг/м³.
Розв'язання. Із табличних даних випливає, що концентрація СО 1 ppm відповідає 1,145 мг/м³. Враховуючи, що 1% об. дорівнює 10000 млн  , а 1 млн
, а 1 млн  (ppm) дорівнює 0,0001 %об., перерахунковий коефіцієнт від ppm до об'ємних одиниць дорівнює 10000. Отже, g = 10000·1,145·0,015 = 171,75 мг/м³.
(ppm) дорівнює 0,0001 %об., перерахунковий коефіцієнт від ppm до об'ємних одиниць дорівнює 10000. Отже, g = 10000·1,145·0,015 = 171,75 мг/м³.
Приклад 1.1.7. Концентрація аміаку у вихідних газах за нормальних умов складає 1600 мг/м³. Визначити концентрацію NH3 в об'ємних відсотках.
Розв'язання. Із табличних даних випливає, що концентрація NH3 1 мг/м³ відповідає 1,438 ppm. Отже, V = 1600·1,438·0,0001 = 0,23 %об.
1.2 Задачі для самостійного розв'язання
Задача 1.Концентрація двоокису нітрогену в димових газах при атмосферному тиску 99325 Па і температурі 60ºС дорівнює 175 ppm. Визначити концентрацію NO  в мг/м³. (Відп.: 288,84 мг/м³).
в мг/м³. (Відп.: 288,84 мг/м³).
Задача 2. Концентрація сірчистого ангідриду за нормальних умов складає 131мг/м³. Виразити концентрацію SO  в одиницях ppm. (Відп.: 50 ppm).
в одиницях ppm. (Відп.: 50 ppm).
Задача 3. За рахунок вихлопних газів автомобілів в атмосферу великих міст потрапляє помітна кількість оксиду вуглецю, концентрація якого може досягати за нормальних умов 100 ppm. Виразити цю концентрацію в мг/м3. (Відп.: 114,5 мг/м³).
Задача 4. Вміст двоокису вуглецю у вихлопних газах автомобілів досягає 2 % об. при Р = 102200 Па і температурі 80ºС. Виразити цю концентрацію CO  в мг/м³ та ppm. (Відп.: 30647,9 мг/м³; 20000 ppm).
в мг/м³ та ppm. (Відп.: 30647,9 мг/м³; 20000 ppm).
Задача 5. У літні, сонячні дні в атмосфері м. Лос-Анджелеса концентрація озону досягає 450 ppb. Визначити цю концентрацію О3 в мкг/м³.
Задача 6. Концентрація сірчистого ангідриду у вихідних газах за нормальних умов складає 2 г/м³. Перерахувати цю концентрацію О3 в % об. (Відп.: 0,076 % об).
Задача 7. Концентрація оксиду вуглецю у тютюновому димі за нормальних умов складає 0,045 % об. Перерахувати цю концентрацію в мг/м3 і порівняти з ГДКс.д. по СО в повітрі. (Відп.: 3 мг/м3.)
Задача 8 Концентрація 3,4-бензпирену в тютюновому димі за нормальних умов складає 0,002 ppm. Перерахувати цю концентрацію в мг/м³ і порівняти з ГДКс.д. по бензпірену в повітрі. (Відп.: 0,001 мг/м³).
Задача 9. Під час лондонського смогу в 1952 р. концентрація діоксиду сірки в міському повітрі при Р=99100 Па і t=11оС досягала 1,45 ррm. Виразити цю концентрацію в мг/м3 і визначити ступінь перевищення ГДКс.д по SO2. (Відп.: 0,05 мг/м3).
Задача 10. Вміст 3,4-бензпірену у вихлопних газах вантажних машин за нормальних умов складає 0,31∙10-6 мг/м 3. Перерахувати цю концентрацію в одиниці ррm і ррb.
Задача 11. Фонова концентрація 3,4-бензпірену в атмосферному повітрі над океаном при н.у. складає 0,00001 мкг/м3. Виразити цю концентрацію в ррm.
Задача 12. Вміст 3,4-бензпірену (М = 252,3) у повітрі промислових районів і великих міст за н.у. складає 1,86∙10-11 %. Перерахувати цю концентрацію в мг/м 3 і порівняти з фоновою концентрацією бензпірену
попередньої задачі.