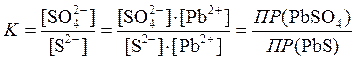Работа 2. Труднорастворимые электролиты. Обменные реакции в растворах
Задание 1. Влияние температуры на растворимость иодида свинца
В пробирку внесите по 2-3 капли растворов соли свинца (II) и иодида калия. Отметьте цвет полученного осадка. Добавьте 2-3 см3 дистиллированной воды и осторожно нагрейте почти до кипения. Если осадка много, добавьте еще воды и продолжайте нагревать почти до полного его растворения. Поставьте пробирку в штатив и наблюдайте, как в процессе медленного охлаждения раствора появляется осадок иодида свинца в крупнокристаллической форме. Запишите уравнение образования осадка в ионно-молекулярной и молекулярной формах. Запишите выражение ПР и найдите в справочнике его численное значение. Сделайте вывод о влиянии температуры на растворимость осадка. Объясните это влияние на основе принципа Ле-Шателье.
Задание 2. Получение и свойства труднорастворимых гидроксидов
Выполните следующие реакции, выбрав нужные реактивы, и изучите характер гидроксидов:
1. Ni2+ + 2OH- = Ni(OH)2¯ A13+ + 3NH3×H2O = A1(OH)3¯ + 3NH4+
2. Fe2+ + 2OH- = Fe(OH)2¯ Cr3+ + 3NH3×H2O = Cr(OH)3¯ + 3NH4+
3. Cu2+ + 2OH- = Cu(OH)2¯ Pb2+ + 2NH3×H2O = Pb(OH)2¯ + 2NH4+
4. Fe3+ + 3 OH- = Fe(OH)3¯ Be2+ + 2NH3×H2O = Be(OH)2¯ + 2NH4+
Каждый осадок получите в двух пробирках. В одну из них прилейте равный объем разбавленной серной кислоты (для гидроксида свинца использовать азотную кислоту), в другую – равный объем щелочи. Тщательно перемешайте содержимое пробирок. Растворились ли осадки?
Напишите ионно-молекулярные и молекулярные уравнения протекающих реакций, отметьте цвета осадков и растворов. Укажите характер гидроксидов. Расситайте концентрацию ионов металла (моль/дм3) в насыщенном растворе одного из изученных гидроксидов (по указанию преподавателя), используя справочное значение ПР.
Задание 3. Получение и растворение труднорастворимых солей
В три пробирки внесите по 2-3 капли раствора хлорида бария, затем добавьте по 2-3 капли растворов следующих солей: в первую – сульфат натрия, во вторую – карбонат натрия, в третью – оксалат натрия (соль щавелевой кислоты Н2C2O4). Наблюдайте появление белых осадков во всех трех пробирках.
Затем добавьте во все пробирки по 1 см3 разбавленной хлороводородной (соляной) кислоты HCl, встряхните пробирки, наблюдайте растворение некоторых осадков. Объясните, что является движущей силой реакций растворения и почему не все осадки растворились?
Напишите ионно-молекулярные и молекулярные уравнения всех реакций. Сделайте вывод о направлении протекания обменных реакций с участием твердых фаз в водных растворах.
Задание 4. Условия перехода одного осадка в другой
Смешайте в пробирке по 2 капли растворов нитрата свинца и сульфата натрия, наблюдайте образование осадка, укажите его цвет. Затем в эту пробирку добавьте несколько капель раствора сульфида натрия Na2S и хорошо перемешайте. Отметьте изменение цвета осадка. Напишите уравнения протекающих реакций в ионно-молекулярной и молекулярной формах. Найдите в справочнике значения ПР сульфата и сульфида свинца, сравните их и сделайте вывод о направлении протекания реакций, связанных с переходом одного осадка в другой.
Подтвердите свой вывод расчетом константы равновесия реакции:
PbSO4¯ + S2- = PbS¯ + SO42-