Основные характеристики энергетического состояния электронов в атоме
ХИМИЯ
Составители М.И. Пантюхина, О.А. Неволина, Е.А.Никоненко,
Л.М. Бабушкина
Научный редактор доц., канд. хим. наук Е.В. Никитина
Общая химия: учебное пособие/ сост. М.И. Пантюхина, О.А. Неволина, Е.А. Никоненко, Л.М. Бабушкина. Екатеринбург: ГОУ ВПО УГТУ-УПИ, 2012.
106 с.
Даны краткие теоретические сведения по основным темам курса, к которым приведены вопросы для самоконтроля. Учебное пособие предназначено для студентов дневной формы обучения 1 курса для специальностей: 150700 ─ машиностроение, 150400 ─ металлургия.
Прил. 3.
Подготовлено кафедрой общей химии.
© ГОУ ВПО « Уральский федеральный
университет им. Первого президента
России Б.Н. Ельцина», 2012
ОГЛАВЛЕНИЕ
1. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ 7
1.1. Основные характеристики энергетического состояния электронов в атоме 7
1.2. Электронные формулы.. 11
1.3. Возможности определения свойств элементов. 12
2. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ.. 13
2.1. Термодинамический метод рассмотрения химических процессов. 13
2.2. Химическое равновесие. 16
2.3. Константа химического равновесия. 17
2.4. Принцип Ле Шателье. 18
3. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ.. 20
3.1. Оксиды.. 20
3.2. Кислоты 23
3.3. Основания 25
3.4. Соли 27
4.ЭЛЕКТРОЛИТЫ30
5. КОНЦЕНТРАЦИЯ РАСТВОРОВ32
6. ГИДРОЛИЗ СОЛЕЙ34
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)36
7.1. Степень окисления Окислители и восстановители 36
7.2. Составление уравнений окислительно-восстановительных реакций 37
8. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ 42
9. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ И РАСТВОРАМИ ЩЕЛОЧЕЙ И КИСЛОТ45
9.1. Взаимодействие металлов с растворами кислот 45
9.1.1. Взаимодействие металлов с концентрированной серной кислотой 45
9.1.2. Взаимодействие металлов с концентрированной азотной кислотой 46
9.1.3. Взаимодействие металлов с разбавленной азотной кислотой 46
9.2. Взаимодействие металлов с водой 47
9.3. Взаимодействие металлов с водными растворами щелочей 48
10.КОРРОЗИЯ МЕТАЛЛОВ 49
11. ЭЛЕКТРОЛИЗ РАСТВОРОВ51
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 54
Тема 1. «Строение атома» 54
Тема 2: «Закономерности химичеких процессов» 56
Тема 2.1. «Термохимия» 56
Тема 2.2. «Химичекое равновесие» 58
Тема 3. «Классы неорганических веществ» 60
Тема 4. «Растворы электролитов» 61
Тема 5. «Концентрации растворов» 65
Тема 6. «Гидролиз солей» 78
Тема 7 «Окислительно-восстановительные реакции» 80
Тема 8 «Гальванический элемент» 84
Тема 9 «Взаимодействие металлов с кислотами, водой и расворами
щелочей» 88
Тема 10 «Электрохимическая коррозия металлов» 92
Тема 11 «Электролиз растворов» 95
ОБРАЦЕЦ БИЛЕТА КОНТРОЛЬНОЙ РАБОТЫ № 197
ОБРАЦЕЦ БИЛЕТА КОНТРОЛЬНОЙ РАБОТЫ № 298
ОБРАЦЕЦ ЭКЗАМЕНАЦИОННОГО БИЛЕТА99
Критерии оценки письменного экзамена по дисциплине «химия» 100
Библиографический список 101
1. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ
Основные характеристики энергетического состояния электронов в атоме
Все известные элементы классифицированы в периодической системе Д.И. Менделеева, которая состоит из семи периодов (1 - 3 малые, 4 - 7 большие), восьми групп. Каждая группа разделена на главную и побочную подгруппы. Главная (а) подгруппа содержит элементы малых и больших периодов, а побочная (б) – только больших (табл.П.1).
Химические свойства элементов определяются количеством и состоянием электронов в атоме, т.е. электронным строением атома.
Состояние электронов в атоме характеризуют квантовые числа:
· n– главное квантовое число, характеризует энергию электрона, а также размеры орбиталей. Орбиталь – та часть пространства, в которой наиболее вероятно нахождение электрона. Главное квантовое число принимает целочисленные значения: n = 1, 2, 3, 4, 5, 6, 7. Электроны, имеющие одинаковое значение n образуют квантовый слой (оболочку) или уровень энергии. Количество квантовых слоев совпадает с номером периода, в котором находится элемент.
· l – орбитальное (побочное) квантовое число, характеризует энергию электрона в зависимости от формы орбитали.
Орбитальное квантовое число принимает целочисленные значения:
0, 1, 2, 3, 4…..(n– 1).
Каждый энергетический уровень состоит из подуровней с одинаковым значением орбитального квантового числа. Подуровни имеют буквенные обозначения.
| Орбитальное квантовое число, l | " 0 | |||
| Обозначение подуровня | " s | p | d | f |
· ml – магнитное квантовое число описывает ориентацию орбитали в пространстве и зависит от орбитального квантового числаl. Магнитное квантовое число принимает целочисленные значения от – lдо + l, включая 0.
| Орбитальное квантовое число, l | Магнитное квантовое число, ml | Число орбиталей с данным значением, l |
| 0 | ||
| – 1, 0, +1 | ||
| – 2 , – 1, 0, +1, +2 | ||
| – 3, – 2, – 1, 0, +1, +2, +3 |
Условно энергетические подуровни изображают в виде квантовых ячеек: для s-орбитали одна квантовая ячейка (£), для p-орбитали три – £££, для d- пять – £££££, для f- семь – £££££££.
Приведем пространственное изображение s- , p- , d- и f - орбиталей.
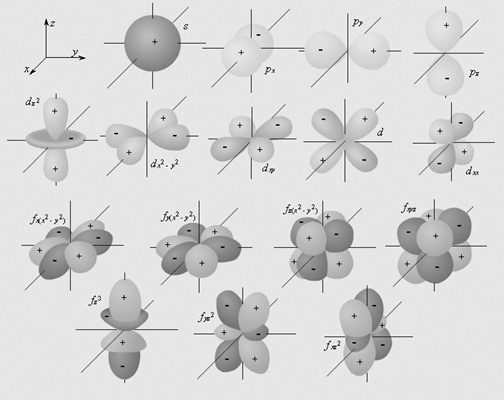
· mS– спиновое квантовое число.
Элементарные частицы, в частности, протоны, нейтроны и электроны обладают собственным моментом импульса. Проекция собственного момента импульса на выделенное направление может принимать для них лишь два значения:

где h – постоянная Планка; mS – спиновое квантовое число: mS = 
Графически это изображается антипараллельными стрелками в квантовой ячейке ↑↓.
Заполнение подуровней электронами происходит в соответствии с принципом Паули, принципом наименьших энергий и правилом Гунда.
Принцип Паули.В 1925 г. В. Паули сформулировал принцип: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Из принципа Паули следует, что максимальное число электронов на энергетическом уровне определяется по формуле Nmax = 2n2. Количество электронов на подуровнях находят по формуле: Lmax = 2(2l + 1). В таблице 1 приведены максимальные количества электронов на первых четырех энергетических уровнях и их подуровнях.
Таким образом, любое устойчивое состояние электрона в атоме характеризуются определенными значениями квантовых чисел n, l, m и s.
Таблица 1
| Главное квантовое число, n(номер уровня) | Максимальное количество электронных состояний на энергетическом уровне, Nmax | Орбитальное (побочное) квантовое число, l | Максимальное количество электронных состояний на энергетическом подуровне, Lmax | Электронная формула уровня | |||||||
| s | p | d | f | s | p | d | f | ||||
| - | - | - | - | - | - | 1s2 | |||||
| - | - | - | - | 2s22p6 | |||||||
| - | - | 3s23p63d10 | |||||||||
| 4s24p64d104f14 | |||||||||||
Схема строения атома по Бору
| Энергетические уровни | n = 1 | n = 2 | n = 3 | n = 4 | ||

| ) | )) | ))) | )))) | ||
| Подуровни: | s | s p | s p d | s p d f |
Принцип наименьших энергий.
· Электроны заполняют орбитали в порядке возрастания энергии орбиталей.