Тема 1. Предмет и задачи аналитического контроля. Качественный анализ
1.1. Объекты аналитического контроля производства
Аналитический контроль металлургического производства предназначен для проверки корректности выполнения технологических регламентов. Этими регламентами установлено определенное число точек аналитического контроля, методики и периодичности его, а также нормы содержания компонентов во всех объектах производственного процесса. Результаты аналитического контроля являются основанием для оценки соответствия или несоответствия химического состава этих веществ регламентированным требованиям.
Анализу подвергают исходные вещества (руды, концентраты); промежуточные продукты (пульпы, электролиты, растворы); вспомогательные материалы(воду, топливо, растворы); готовую продукцию (чистые металлы, сплавы и т.д.).В атмосфере цехов определяют содержание вредных газов, выделяющихся в ходе производственных процессов. Также контролируют содержание ценных компонентов и токсичных веществ в промышленных сточных водах и других отходах производства. Аналитический контроль дает возможность добиться наиболее экономичного расходования сырья, топлива, электроэнергии, уменьшить отходы производства.
На основании результатов анализа проводится классификация продукции по сортам или маркам, выполняются финансовые расчеты между поставщиком продукции и ее потребителем. Таким образом, аналитический контроль необходим для правильной организации и контроля производственных процессов, для достижения промышленным предприятием высоких технико-экономических показателей.
1.2. Аналитическая химия - научная основа химического анализа
Средством контроля производства и качества продукции служит химический анализ. Научной основой химического анализа является наука - аналитическая химия.
Аналитическая химия - наука о методах идентификации и определения химического состава веществ и материалов и их химической структуры. В задачу аналитической химии входит разработка теоретических основ метдов анализа, установление границ их применимости, оценка метрологических и других характеристик, создание методики анализа.
Методика анализа включает подробное описание последовательности и условий проведения всех стадий анализа.
Основные этапы анализа включают: постановку задачи, выбор метода и схемы анализа, отбор пробы, подготовка пробы к анализу, проведение измерений, обработка результатов измерений.
Выбор метода анализа определяется постановкой аналитической задачи. При этом учитывают:
-химический состав объекта анализа, возможные интервалы содержаний определяемого и сопутствующих компонентов;
-метрологические требования к методике;
-характеристику объекта анализа - его физические свойства, форму, интервалы колебания массы объекта, реакционную способность анализируемого вещества по отношению к атмосфере;
-назначение методики, экономический эффект от внедрения методики;
-происхождение анализируемого материала.
Кроме того, учитываются приборы, реагенты, имеющиеся в распоряжении аналитика, трудоемкость анализа и т.д.
Отбор средней пробы представляет первую стадию аналитического контроля. Задача ее - приготовление представительной пробы, результаты анализа которой будут надежно характеризовать всю массу вещества, от которого проба отобрана. Отбор проб очень ответственный момент, поскольку для анализа требуется небольшое количество материала (>>1г), а состав его должен отображать состав значительных (до тысяч тонн) масс природных или промышленных материалов.
Для правильного отбора представительной пробы от больших партий разработаны специальные методикипробоотбора.
При проведении операции разложения пробы все определяемые компоненты пробы необходимо перевести в раствор и не допустить их потерь. Ввиду сложного химического и физико-химического состава проб металлургического производства, нередко приходится применять комбинированные, способы вскрытия пробы, включающие кислотную обработку или нагревание, а затем нерастворившейся остаток сплавляют с подходящим плавнем.
Метод разделения выбирают в зависимости от свойств определяемого соединения и мешающих элементов, а так же от того какой метод анализа применяют: гравиметрический, титриметрический или какой- либо другой. В практике используют химические, физические или физико-химические методы разделения. К химическим относятся методы осаждения, основанные на различной растворимости веществ, к физическим - отгонка, сублимация, плавление и т.д., к физико - химическим - экстракция, ионный обмен, хроматография и др. Более подробную информацию о методах пробоотбора и подготовки пробы к анализу мы рассмотрим в соответствуюших разделах.
При количественном измерении определяют интенсивность аналитического сигнала, т.е. численное значение свойства, связанное с содержаниеманализируемого компонента. Аналитическим сигналом может быть сила тока, э.д.с. системы, оптическая плотность, интенсивность излучения, масса вещества и т.д. По результатам количественного измерения с помощью уравнения связи рассчитывают содержание определяемого элемента в пробе.
Уравнение связи выражает зависимость между интенсивностью аналитического сигнала (измеряемой величиной) и содержанием анализируемого компонента:
Р = f(C) (1)
где: Р - интенсивность аналитического сигнала; C - концентрация.
1.3. Классификация методов количественного анализа
1. По объектам анализа: неорганический и органический.
2. По цели: качественный и количественный.
Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа количественный анализ даёт возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом объекте.
Методы качественного и количественного анализа, позволяющие определить в анализируемом веществе содержание отдельных элементов, называют элементным анализом; функциональных групп – функциональным анализом; индивидуальных химических соединений, характеризующихся определённой молекулярной массой, – молекулярным анализом.
Совокупность разнообразных химических, физических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом.
3. По способу выполнения: химические, физические и физико-химические (инструментальные) методы.
4. По массе пробы: макро- (>> 0,10 г), полумикро - (0,10…0,01 г), микро - (0,01…10–6 г), ультрамикроанализ(< 10–6 г).
1.4. Требования, предъявляемые к анализу
1. Анализ вещества заключается в получении опытным путем данных о его химическом составе.
Независимо от используемых методов к анализу предъявляют следующие требования:
2. Точность анализа - это собирательная характеристика метода, включающая их правильность и воспроизводимость.
3. Правильность результатов анализа - получение результатов, близких к действительным.
4. Воспроизводимость - получение одинаковых или близких результатов при повторных определениях.
5. Экспрессность - быстрота проведения анализа.
6. Чувствительность - минимальное количество вещества, которое можно определить данным методом.
7. Универсальность - возможность определять многие компоненты. Особенно важно определять их одновременно в одной пробе.
8. Автоматизация анализа. При проведении массовых однородных анализов следует выбирать метод, допускающий автоматизацию, которая снижает трудоемкость, погрешности, увеличивает скорость, снижает стоимость анализа.
1.5. Качественный химический анализ
1.5.1. Методы качественного анализа
Первоначальная задача при исследовании любого материала - его качественный анализ на содержание наиболее распространенных неорганических ионов, поскольку знание элементного состава исследуемого материала и степеней окисления присутствующих элементов во многом определяет его структуру и свойства.
Задачи качественного химического анализа - обнаружение в исследуемом образце и идентификация строго определенных компонентов: химических элементов или ионов, функциональной группы или какого-либо конкретного химического вещества. Этот анализ осуществляется как с помощью химических реакций, так и в результате наблюдения некоторых физических свойств веществ. В ходе его так же можно приблизительно оценить содержание этого вещества в образце: большое, малое, очень малое, следы.
1.5.2. Аналитические операции и реакции. Требования к ним
В химическом анализе для выявления присутствия-отсутствия веществ используют химические реакции. В ряде случаев, если не удается выбрать достаточно чувствительную реакцию, проводят дополнительно физические испытания, например, спектральный анализ.
Таблица 1
Примерыаналитическихреакций
| Реакции, процесс | Примеры уравнений реакций | Аналитический эффект | Примеры открываемых ионов и веществ |
| Осаждения | Ba+2+ SO42-=BaSO4↓ | Образование белого осадка | Ba+2, SO2- |
| Кислотно-основные | CO32-+2H3O+=CO2↑+ 3H2O | Выделение пузырьков газа | CO32- |
| Окислительно- восстановительные | Mn+2+2H2O2=MnO2↓ + 2H2O | Образование темно-коричневого осадка | Mn+2 |
| Комплексообразо-вания | Fe+3 +3SCN-=Fe(SCN)3 | Появление красной окраски раствора | Fe+3 |
| Этерификации | CH3COOH +C2H5OH = = CH3COOC2H5 +H2O | Появление запаха груши | CH3COOH |
| Экстракции | I2(водн.) + C6H6 =I2(орг.) | Фиолетовый экстракт | I2 |
Для качественного анализа пригодны только те реакции, которые сопровождаются заметным, характерным только для этого вещества, изменением реакционной смеси - аналитическим эффектом. Аналитическим эффектом может быть появление (или исчезновение) осадка, окраски, выделение газов, способность экстрагироваться несмешивающимся с водой растворителем, характерной окраской пламени при внесении в него испытуемой пробы и т.п. В качестве таких реакций могут быть взяты реакции разных типов. Кроме того качественная реакция должна обладать высокой чувствительностью и селективностью.
1.5.3. Методы проведения качественного анализа
Для проведения качественного анализа используют систематический и дробный методы.
Систематическийметод идентификации основан на переведении пробы в раствор, разделении смеси ионов на группы и подгруппы с помощью групповых реагентов, а затем в пределах этих групп обнаружении отдельных ионов характерными реакциями. Такой способ позволяет значительно увеличить количество получаемой аналитической информации и повысить ее надежность.
Дробный метод основан на непосредственном определении данного элемента или иона в объекте с помощью качественной реакции. Обнаружение иона осуществляется в два приема: сначала из раствора устраняются (маскируются) мешающие ионы, а затем с помощью характерной реакции осуществляется обнаружение определяемого иона.
На практике используют оба метода и по отдельности, и в сочетании. Для определения катионов обычно предпочитают проводить систематический качественный анализ, а для определения анионов - дробный.
Группы реагентов, применяемые в качественном анализе:
1) общие: реагируют преимущественно со всеми ионами (например: щелочи, гидроксид аммония, анионы сильных и слабых кислот, цинк);
2) групповые: взаимодействуют более чем с тремя ионами;
3) специфические или характерные для данного иона: действуют только на определенный ион.
Способы проведения аналитических реакций: «сухой» и «мокрый».
При «сухом» способе реагенты берут в твердом состоянии: реакции растирания порошков; получение стекловидных шариков при плавлении небольших количеств анализируемого вещества с бурой или дигидрофосфатом аммония; окрашивание пламени.
При «мокром» способе предварительно растворяют реагенты в воде, кислоте или щелочи и аналитические реакции проводят, вводя в исследуемый раствор определенные реактивы, дающие с открываемым ионом характерный продукт взаимодействия.
Разновидности анализа в зависимости от количества используемых веществ: 1) макроанализ; 2) полумикроанализ; 3) ультрамикроанализ.
1.5.4. Качественный анализ катионов. Аналитическая классификация катионов
При анализе образцов, содержащих достаточно большое число видов разнообразных катионов, их взаимное мешающее действие не позволяет использовать дробный метод анализа. В этом случае используют систематический анализ, чтобы предварительно разделить эти ионы на более мелкие группы с помощью подходящих групповых регентов, а затем определять отдельные виды катионов внутри каждой группы.
Аналитическая классификация катионов на группы проводится не по всей совокупности химических свойств элементов, а по небольшому числу выбранных свойств конкретных ионов, которые определяют конкретную специфику их качественного анализа.
В каждом отдельном случае, исходя из определенных частных соображений, выбирают свойства катионов для распределения их на группы. В результате созданы разные классификации катионов и, как следствие этого, разные схемы анализа: кислотно-основная, сероводородная, аммиачно-фос-фатная, тиоацетамидная и др. Каждая из этих схем анализа обладает определенными достоинствами и недостатками, но в конечном итоге при тщательном выполнении все они дают правильные результаты.
Таблица 2
Аналитическая классификация катионов
| Группы | Катионы | Групповой реагент | Примечание |
| I | Na+,К+,NH4+ | - | Эти катионы в большинстве случаев образуют хорошо растворимые соли и группового реагента не имеют. |
| II | Ag+,Hg22+, Pb2+ | HC1 | Эти катионы образуют малорастворимые хлориды. Наибольшее значение произведения растворимости у РЬС12 (1,6·10-5), поэтому часть ионов РЬ2+ остается в растворе и в ходе систематического анализа попадает вIII группу. |
| III | Са2+,Sr2+,Ва2+,Pb2+ | H2SO4 | Эти катионы образуют малорастворимые сульфаты. Наибольшей растворимостью обладает CaSO4(ПР = 2,5·10-5). Для снижения растворимости следует добавлять равный объем этилового спирта. |
| IV | Аl3+,Сr3+,Zn2+, As3+, As5+, Sn2+, Sn4+ | NaOH | Эти катионы образуют амфотерные гидроксиды или растворимые соли кислородсодержащих кислот и поэтому хорошо растворяются в избытке щелочей. |
| V | Bi3+, Fe3+, Fe2+, Mg2+, Mn2+, Sb3+,Sb5+ | NaOH | Эти катионы образуют малорастворимые гидроксиды или кислородсодержащие кислоты. |
| VI | Cd2+, Co2+, Cu2+, Ni2+, Hg2+ | NH4OH | Эти катионы образуют прочные растворимые в водеаммиакаты, в результате образования которых нерастворимые гидроксиды легко переходят в раствор. |
В основу кислотно-основной схемы анализа положено разное отношение катионов к действию на них разных кислот и оснований, в частности,НС1,H2SO4,NaOH,NH4OH. В соответствии с их действием выделены шесть групп катионов.
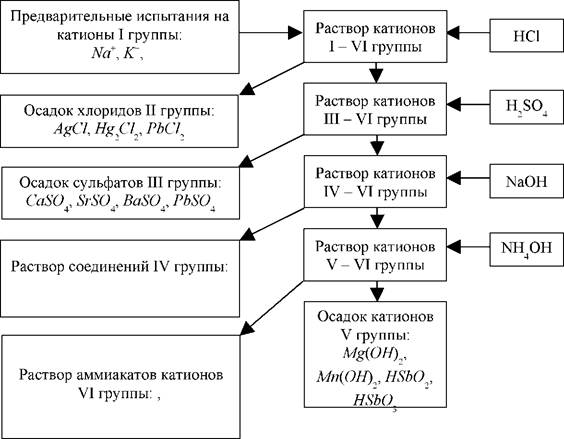 Рис. 1. Схема разделения катионов на аналитические группы.
Рис. 1. Схема разделения катионов на аналитические группы.
|
В соответствии с кислотно-основной классификацией систематический ход качественного анализа смеси катионов можно представить схемой (рис.1), приведенной выше.
1.5.5. Аналитическая классификация анионов
Анализ анионов существенно отличается от анализа катионов, основанного на последовательном делении катионов на группы с помощью групповых реакций.
Для обнаружения большинства анионов чаще всего возможен дробный метод. Кроме того, окислительно-восстановительные и комплексообразую-щие свойства анионов приводят к тому, что многие из них не могут находиться в растворе одновременно или в присутствии некоторых катионов из-за идущих между ними реакций. Например,S2-иNO3-; иI-иH2AsO4-.
Тем не менее, для упрощения анализа анионов предлагаются классификации, основанные на использовании разных реактивов в качестве групповых.
Таблица 3
Взаимодействие BaCl2 и AgNO3 с отдельными ионами
| Анионы | BaCl2 | AgNO3 | ||
| безподкисления | при подкислении | без подкисления | при подкислении | |
| I группа Cl- Br- I- | - - - | - - - | AgCl↓белый AgBr↓желтоватый AgI↓ светло-желтый | AgCl↓ белый AgBr↓ желтоватый AgI↓ светло-желтый |
| II группа SO42- CO32- PO43- | BaSO4↓ белый ВаСОз↓ белый BaHPO4↓ белый | BaSO4↓белый - - | - Ag2CO3↓Белый Ag3PO4↓ Желтый | - - - |
| IIIгруппа NO3- | - | - | - | - |
Также используется классификация анионов по окислительно-восстановительным свойствам.
Контрольные вопросы
1.Для чего предназначен аналитический контроль металлургического производства?
2. Какие объекты металлургических производств подлежат анализу?
3. Укажите основные задачи аналитической химии?
4. Какие этапы аналитического процесса вам известны?
5. Чем определяется выбор метода анализа?
6.Что такое аналитический сигнал?
7. Какую зависимость выражает уравнение связи?
8. По каким признакам классифицируются методы анализа?
9. Перечислите требования, предъявляемые к методам анализа.
10. Дайте определение аналитическому эффекту реакции. Приведите примеры.
11. Параметры, характеризующие чувствительность аналитической реакции.
12. Дайте характеристику методам качественного анализа.
13. Групповые реагенты. Приведите основно-кислотную классификацию катионов и укажите каждой группе соответствующий групповой реагент.
14. «Маскировка» ионов. Дайте определение и укажите, для каких целей применяется в качественном анализе.