Тема. Количество вещества, выделяемое за время электролиза
26.12.2014
Урок 32 (9 класс)
Тема. Количество вещества, выделяемое за время электролиза
Жидкости, как и твердые тела, могут быть диэлектриками, проводниками и полупроводниками. К числу диэлектриков относится дистиллированная вода, к проводникам - растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов и др.
Электролиз. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (в химии это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция). Процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, называют электролизом. Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду.
Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией.
Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы.
1.Законы Фарадея
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза. Очевидно, что масса выделившегося вещества m равна произведению массы одного иона m0i на число ионов достигших электрода за время  :
:

Масса иона m0i согласно формуле (8.4) равна: 
где М - молярная (или атомная) масса вещества, а NA - постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:
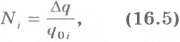
где  - заряд, прошедший через электролит за время
- заряд, прошедший через электролит за время  ;
;  - заряд иона, который определяется валентностью n атома:
- заряд иона, который определяется валентностью n атома:  (е - элементарный заряд).
(е - элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K+ и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu2+ и SO42-, так как атомы меди в данном соединении двухвалентны (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что  , получаем
, получаем

Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом  :
:

Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем:

Следовательно, масса вещества, выделившегося на электроде за время  при прохождении электрического тока, пропорциональна силе тока и времени.
при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название закона электролиза Фарадея.
Из формулы (16.8) видно, что коэффициент k численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину k называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Электрохимический эквивалент имеет простой физический смысл. Так как  , то согласно формуле (16.7)
, то согласно формуле (16.7)  , т. е. k - отношение массы иона к его заряду.
, т. е. k - отношение массы иона к его заряду.
Измеряя величины m и  , можно определить электрохимические эквиваленты различных веществ.
, можно определить электрохимические эквиваленты различных веществ.
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов черезI1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.

Определение заряда электрона. Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:

Зная массу m выделившегося вещества при прохождении заряда  , молярную массу М, валентность атомов n и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл.
, молярную массу М, валентность атомов n и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл.
Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.
Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.
2. Практическое применение электролиза
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия – покрытие одного металла другим (хромирование, никелирование, золочение и т.д., рис. 1). Это прочное покрытие защищает поверхность от коррозии.
Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл (этого достигают, например, нанося на поверхность графит), то можно получить копию с рельефной поверхности.
В полиграфической промышленности такие копии (стереотипы) получают с матриц (оттиск набора на пластичном материале), для чего осаждают на матрицах толстый слой железа или другого вещества. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор постепенно стирается), то сейчас использование стереотипов позволяет значительно увеличить тираж. Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати.
Также электролиз применяется в металлургии для выплавки редких металлов в чистом виде (алюминий, натрий, кальций, магний).


Рис. 1. Примеры гальванопластики и гальваностегии соответственно
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
При помощи электролиза получают алюминий из расплава бокситов. Именно этот способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту.
С помощью электролиза получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются незакрытые краской участки медного слоя. После этого краска смывается и на плате появляются детали микросхемы.
Домашнее задание
1. Ф.Я.Божинова, Н.М.Кирюхин, Е.А.Кирюхина. Физика, 9 класс, «Ранок», Харьков, 2009. § 19-20 (с.105-113) читать.
2. Упражнение 19, задача 1-5 (решить).
3. Ответить на вопросы:
1. Сформулируйте закон электролиза Фарадея.
2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?