СВОЙСТВА P-ЭЛЕМЕНТОВ III ГРУППЫ
Электронные конфигурации элементов. Степени окисления, тенденция изменения устойчивых степеней окисления при переходе от бора к таллию. Изменение величин радиусов атомов и потенциалов ионизации в ряду бор–таллий. Валентные возможности бора и алюминия, характерные координационные числа. Бор, получение, химические свойства (взаимодействие с кислородом, галогенами, кислотами и щелочами в присутствии окислителя).
Бороводороды, общие способы получения, природа химической связи в В2H6. Взаимодействие диборана с водой, гидридами щелочных металлов, кислородом. Смешанные гидриды бора. Оксид бора, получение, химические свойства (взаимодействие с оксидами, щелочами). Ортоборная кислота, получение. Полимерные кислоты бора и их соли. Тетраборат натрия (бура). Гидролиз буры.
Галогениды бора, получение, взаимодействие с водой. Понятие о галогенангидридах. Строение молекул BГ3. Объяснение плоского треугольного строения BГ3 c позиций метода ВС. Акцепторные свойства ВF3. Тетрафтороборная кислота.
Алюминий, нахождение в природе. Бокситы и алюмосиликаты. Получение алюминия. Криолит, его получение. Стандартный электродный потенциал алюминия. Взаимодействие алюминия с водой, кислотами, щелочами. Амфотерные свойства оксида и гидроксида алюминия. Способы их получения. Алюминаты и гидроксоалюминаты. Гидролиз солей алюминия. Алюмокалиевые квасцы. Диссоциация квасцов, гидролиз.
Вопросы и задачи: 12,с. 6, № 1–109.
1. Сколько граммов буры надо растворить в 300 мл воды, чтобы получить 1%-ный раствор в расчете на безводную соль? (Ответ: m = 5,78 г)
2. Устойчив ли алюминий в атмосфере СО2? Возможен ли при стандартных условиях процесс: 4Al + 3СО2 ® 3C + 2Al2O3? (Ответ: ∆G 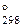 = –1981кДж)
= –1981кДж)
3. Вычислить термодинамические характеристики процесса испарения бромида бора, если известно, что при температуре 33,2оС давление насыщенного пара составляет 0,13 атм., а при температуре 90,9оС – 1 атм. Определить температуру кипения этого вещества. (Ответ: ∆H 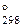 = 32,753 кДж; ∆S
= 32,753 кДж; ∆S 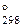 = 89, 7 Дж/К; Т = 364 К)
= 89, 7 Дж/К; Т = 364 К)
4. Определить рН 0,1%-ного раствора ортоборной кислоты (ρ = 1 г/мл).
(Ответ: рН = 5,53)
5. Выпадет ли осадок хлорида таллия (I) при смешивании равных объемов 0,02 н. раствора нитрата таллия (I) и 0,04 н. хлорида натрия? ПР(ТlCl) = 2.10–4. (Ответ: да, ПС = 2.10–4)
6. Рассчитать рН 0,3 н. раствора Al(NO3)3. Что произойдет при добавлении кислоты к раствору нитрата алюминия? (Ответ: рН = 3,07)
7. Вычислить величину ∆G 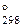 процесса диссоциации комплексного иона [AlF6]3–.
процесса диссоциации комплексного иона [AlF6]3–.
(Ответ: ∆G 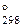 = –113,07кДж)
= –113,07кДж)
8. Составить молекулярно-ионные уравнения реакций. Для б) определить DG 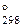 реакции: а) Al + KNO2 + KOH →; б) KMnO4 + Al + H2SO4→. (Ответ: ∆G
реакции: а) Al + KNO2 + KOH →; б) KMnO4 + Al + H2SO4→. (Ответ: ∆G 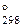 = –4588,6 кДж)
= –4588,6 кДж)
9. Составить схему и рассчитать ЭДС гальванического элемента, состоящего из алюминиевого электрода, опущенного в насыщенный раствор Al(OH)3, и водородного электрода, опущенного в 0,01 М раствор H3BO3 (Т = 298 К). (Ответ: ∆E = 1,49 В)
10. Какие продукты будут выделяться на катоде и аноде в первую очередь при электролизе водных растворов при угольных электродах, если в электролизере находится смесь следующих веществ: а) Аl2(SO4)3 и CuС12; б) H3BO3 и NaBr.
Литература: 1, с. 470–510; 2, с. 342–362.