Диаграммы состояния двухкомпонентных систем с твердыми растворами
Если содержащиеся в твердом растворе компоненты могут смешиваться в любых соотношениях, то данный процесс является с твердыми растворами неограниченной растворимости или непрерывным рядом твердых растворов. При наличии однофазного твердого раствора из двух компонентов, находящегося в равновесии с расплавом, состоящим их тех же компонентов, степень свободы системы будет равна единице, то есть каждой температуре соответствует строгая концентрация компонентов в твердом растворе и расплаве (рисунок 4). На диаграмме появляется кривая, показывающая изменение состава твердой фазы при изменении температуры (кривая Та – S1 – Тв).
Составы равновесного расплава и твердого раствора определяются концами конноды, проведенной при заданной температуре, например между точками L1 и S1. Когда точка М достигнет линии ликвидуса, начинается кристаллизация твердого раствора S1. При дальнейшем понижении температуры состав жидкости меняется по кривой ликвидуса, состав твердого раствора – по кривой солидуса.
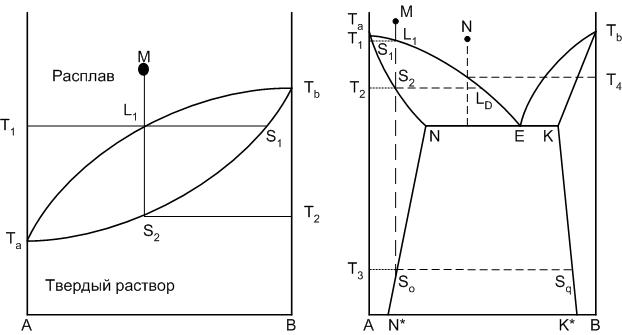
При температуре Т2, когда состав твердого раствора совпадает с исходным составом системы, кристаллизация закончится. Изменение состава твердого раствора в процессе кристаллизации происходит за счет диффузии атомов или ионов одного компонента в кристаллической решетке.
Рисунок 4. Диаграммы равновесия двухкомпонентных систем с твердыми растворами
Если смешиваемость компонентов происходит лишь до некоторых пределов концентраций, то такой твердый раствор называется твердым раствором с ограниченной растворимостью.
При эвтектической температуре в равновесии с расплавом находятся два твердых раствора: α и β. Точки N и К – точки предельной концентрации твердых растворов, которая изменяется при понижении температуры по линиям предельной растворимости.
На диаграмме исходных составов системы, пути кристаллизации которых отличаются друг от друга, можно выделить три интервала: А–N*, N*-N, N–E, если рассматривать точку эвтектики как точку симметрии диаграммы. Пути кристаллизации составов, находящихся в интервале A-N*, не отличаются от путей кристаллизации составов с твердыми растворами неограниченной растворимости.
Таблица 4
Пути кристаллизации составов системы
| Температура | Равновесные фазы | Примечание |
| Состав М | ||
| Т = Т1 | L1 + тв.р-рS1 | - |
| Т→Т2 | L(1→D) + S(1→2) | - |
| Т = Т2 | тв.р-р (S2) | Кристаллизация закончилась |
| Т = Т3 | тв.р-р (So) + тв.р-р (Sq) | Разделение в твердой фазе на два раствора |
| Т < Т3 | тв.р-р (So→n*) тв.р-р (Sq→ k*) | Изменение концентрации твердых растворов по линиям предельной растворимости |
| Состав N | ||
| Т = Т4 | тв.р-р (S4) + расплав L4 | (составы условно не показаны) |
| Т = Те | тв.р-р (Sn) + тв.р-р (Sk) | Кристаллизация закончилась |
| Т < Те | тв.р-р Sn→ n* + тв.р-р Sk→ k* | Изменение составов твердых растворов |
Правило рычага
По диаграммам равновесия двухкомпонентных систем можно определять не только качественно фазовые равновесия, но и рассчитывать количественное соотношение равновесных фаз.
Для этого используется правило рычага: если одна фаза в системе распадается на две, то количество образовавшихся фаз обратно пропорционально отрезкам, заключенным между точкой исходного состава и точками составов образовавшихся фаз.
Покажем работу правила на примере. Пусть Q – масса исходного расплава состава М (рисунок 1). При охлаждении исходного состава до температуры Т2 выделилось некоторое количество кристаллов компонента В. Обозначим это количество кристаллов через Х.
В исходном расплаве при температуре выше Т1 количество компонента А определяется как
А = (Q*FB) / 100 (2)
При температуре Т2 количество компонента А в расплаве определяется как
А = (Q – X)*DB / 100. (3)
Учитывая, что при кристаллизации исходного расплава до температуры Т2 количество компонента А не изменялось, мы вправе записать
(Q*FB) / 100 = (Q – X)*DB / 100. (4)
Из последнего уравнения имеем количество кристаллов как
X = Q*(DB – FB) / DB = (Q*DB) / DB (5)
и количество расплава
Q – X = (Q*FB) / DB. (6)
Отношение равновесных фаз при температуре Т2 (кристаллов к расплаву) будет определяться следующим образом:
X / (Q – X) = (Q*DF*DB) / (DB*Q*FB) = DF / FB. (7)
Таким образом, отрезок DB определяет общее количество равновесных фаз, отрезок DF – количество кристаллической фазы, FB – количество оставшегося в системе расплава.
Для практического использования правила рычага при решении задач фазового равновесия необходимо за 100% принять отрезок, ограниченный составами равновесных в данных условиях фаз. Точка исходного состава будет обязательно находиться на этом отрезке и делить его в пропорциях, соответствующих равновесным фазам.
Раздел 2. Индивидуальное задание
Диаграмма равновесия
Диаграмма равновесия двухкомпонентных систем представляет собой графическое изображение последовательных равновесных состояний при бесконечно малых изменениях температуры или иных параметров состояния. Диаграмма равновесия представляет собой диаграмму (рисунок 3), на которой по оси абсцисс откладываются значения концентрации компонентов системы (в весовых или молярных долях), а по оси ординат - температура системы. Такие графические изображения устанавливает строгую функциональную зависимость между параметрами системы. Особенностью диаграмм подобного рода является то, что любая ее точка характеризует определенное состояние системы и численные значения этого состояния.
Исходя из вышесказанного по диаграмме состояния для любых заданных параметров системы можно определить:
¾ количество фаз, находящихся в равновесий в данный момент времени;
¾ состав равновесных фаз;
¾ количественное соотношение равновесных фаз, и, зная свойства образовавшихся фаз, предсказать свойства материала, полученного в результате термической обработки данной системы в процессе изготовления обжиговых строительных материалов.