Основные правила диаграммы трехкомпонентных систем
Цели и задачи
Целью данной работы является:
1. Изучение методики построения диаграмм по фигуративным точкам;
2. Решение практических задач по диаграммам равновесия трехкомпонентным системам.
К основным задачам отчета относятся:
1. Построения основных элементов диаграммы.
2. Изучение общего вида диаграммы трехкомпонентных систем.
3. Изучить:
¾ основные определения;
¾ метод нанесения понижения температурных пограничных кривых;
¾ первично выпадающие фазы и дальнейший путь распада кристалла;
¾ точку окончание кристаллизации.
Раздел 1 Теоретическая часть
Общий вид и элементы диаграммы трехкомпонентных систем
Диаграмма (рисунок 1) представляет собой призму, грани которой образованы соответствующими двухкомпонентными диаграммами и является пространственной фигурой: концентрации компонентов откладываются на сторонах равностороннего треугольника (треугольника концентраций), а температура – на перпендикуляре, проведенном к плоскости треугольника концентраций.
На диаграмме трехкомпонентной системы вместо линий появляются поверхности ликвидуса, например: А*-Е1*-Е*-Е3*-А*, С*-Е2-*Е-Е3*-С*, В*-Е1*-Е*-Е2*-В*, при пересечении которых образуются пограничные кривые Е1*-Е*, Е2*-Е*, Е3*-Е*, сходящиеся в точке тройной эвтектики Е*.

Поверхность ликвидуса имеет те же свойства, что и кривая ликвидуса: показывает температуру начала кристаллизации (конца плавления) любого состава системы; состав насыщенной жидкой фазы находится в равновесии с твердой фазой при данной температуре.
Рисунок 1 - Пространственная диаграмма трехкомпонентной системы
Пограничные линии разделяют треугольник концентраций на поля первичной кристаллизации соединений, существующих в данной системе. Состав кристаллов в поле первичной их кристаллизации отмечается кружком.
Точки составов двойных соединений находятся на сторонах треугольника, точки составов тройных химических соединений – внутри его.
Основные понятия диаграммы трехкомпонентных систем
Проекционную диаграмму используют для удобства работы, которая образуются при проецировании на плоскость треугольника концентраций всех элементов пространственной диаграммы. Температура на диаграмме показывается в этом случае изотермами, получаемыми пресечением пространственной диаграммы плоскостями, параллельными треугольнику концентраций при фиксированном значении температуры. Часто изотермы на проекционной диаграмме не показываются вообще, чтобы не усложнять изображение.
Пограничные линии разделяют треугольник концентраций на поля первичной кристаллизации соединений, существующих в данной системе. На рисунке 2 поле Е1-В- Е2- Е- Е1 – поле первичной кристаллизации компонента В, А- Е1- Е- Е3- А – компонента А и С- Е3- Е- Е2- С- компонента С.

Рисунок 2 - Проекционная диаграмма трехкомпонентной системы
Точки составов химических соединений или компонентов системы, имеющие смежные поля первичной кристаллизации, соединяются тонкими прямыми линиями, носящими название соединительных прямых. Соединительные прямые разбивают диаграмму на отдельные, элементарные треугольники, каждый треугольник может рассматриваться как отдельная диаграмма трехкомпонентной системы.
Если через точку М, на рисунке 2, проводятся прямые, параллельные сторонам проекционной диаграммы, которые рассекают каждую строну проекционной диаграммы на три отрезка, каждый из которых определяет количественное содержание одного из компонентов. То средний отрезок определяет количество компонента противоположного угла диаграммы, а отрезки, примыкающие к углам диаграммы, определяют количество компонентов, принадлежащих данной стороне в обратной пропорции. Это правило будет работать и в том случае, когда рассматриваемая диаграмма не является равносторонним треугольником.
Правило рычага в трехкомпонентной системе
Для трехкомпонентной системы с помощью правила рычага можно решать следующие задачи:
1. Определение количественного соотношения жидкой и твердой фаз при наличии одной твердой фазы.
2. Определение количественного соотношения жидкой и твердой фаз при наличии двух кристаллических фаз с одновременным определением количественного соотношения кристаллических фаз в составе твердой фазы.
3. Определение соотношения двух одновременно кристаллизующихся в данный момент времени фаз.
Основные правила диаграммы трехкомпонентных систем
Правило 1 – Метод нанесения понижения температурных пограничных кривых:
Температура всегда понижается от точки пересечения пограничной кривой (или ее продолжения) с соединительной линией (или ее продолжения), соединяющей точки составов фаз, поля первичной кристаллизации которых разделяет данная пограничная кривая. На пограничной кривой в точке ее пересечения с соединительной линией будет находиться температурный максимум.
Правило 1 (рисунок 3), позволяет определить направление понижения температуры на пограничных кривых диаграммы - будет определяться следующим образом. На кривой Е1- Е температура понижается от точки Е1 к точке Е, так как точка Е1 - точка пересечения соединительной линии АВ (совпадающая в данном случае со стороной проекционной диаграммы) и пограничной кривой Е1- Е, то есть точка Е1 является точкой температурного максимума на кривой Е1- Е.
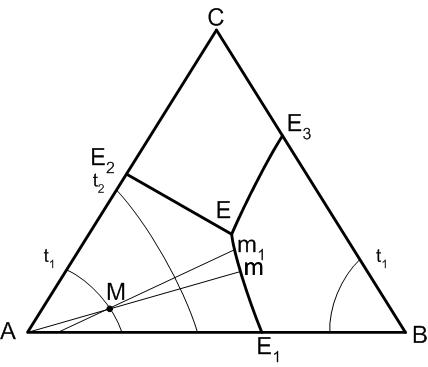
Рисунок 3 - Диаграмма состояния трехкомпонентной системы с точкой тройной эвтектики
Правило 2 – Определение первично выпадающей фазы и дальнейшего пути распада кристалла:
1. При кристаллизации расплава, первично выпадающей фазой будет тa, в поле первичной кристаллизации которой находится точка исходного состава. Если точка исходного состава принадлежит пограничной кривой, то первичными фазами будут тe поля первичной кристаллизации, которые разделяет данная пограничная кривая.
2. При кристаллизации из расплава одной твердой фазы состав жидкой фазы изменяется по продолжению прямой, проходящей в поле кристаллизации этой фазы и проведенной через точку состава первично выпадающей фазы и точку исходного состава в сторону понижения температуры.
После начала кристаллизации компонента А (рисунок 3) состав расплава будет изменяться по отрезку M-m прямой А-М в сторону точки М. Как только состав расплава дойдет до пограничной кривой Е1 -Е расплав становится пересыщенным по отношению к двум твердым фазам: А и В. Причем кристаллы этих фаз будут одновременно выпадать из расплава (степень свободы системы равна единице).
Независимым термодинамическим параметром будет температура, а состав расплава будет изменяться при дальнейшем понижении температуры строго по пограничной кривой, то есть от точки М по кривой Е1 -Е в сторону точки Е. При достижении температуры точки тройной эвтектики tЕ начинается кристаллизация компонента С, так как в этом случае расплав становится пересыщенным по отношению сразу к трем компонентам. Нонвариантное состоянии, характерное для этого случая, заканчивается полной кристаллизацией расплава и дальнейшее возможное охлаждение системы приводит к охлаждению трех кристаллических фаз: А, В, С. Таким образом, путь кристаллизации исходного состава М: МmЕ. Изменение фазового равновесия при нагревании будет обратным, нежели при охлаждении.
Правило 3 – Определение точки окончания кристаллизации:
Окончание кристаллизации произвольного состава системы произойдет в точке, где пересекаются поля первичной кристаллизации фаз, находящихся в вершинах элементарного треугольника, которому принадлежит точка исходного состава.
Из этого правила следует, что все составы (смотри рисунок 4), находящиеся в элементарном треугольнике А-В-АС закончат свою кристаллизацию в точке Е, а конечными продуктами кристаллизации будут соответственно кристаллы компонентов А и В и кристаллы химического соединения АС.
Если исходный состав (точка 3 на диаграмме) расположен на соединительной прямой В-АС, то этот случай рассматривается как диаграмма двухкомпонентной системы В-АС, для которой точка К является точкой двойной эвтектики и именно там окончится кристаллизация указанного состава.
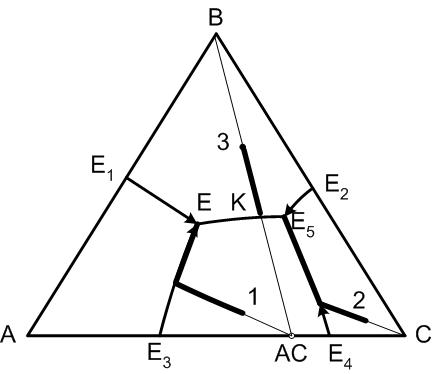
Рисунок 4 - Диаграмма трехкомпонентной системы с двойным химическим соединением, плавящимся конгруентно
Правило 4 – Путь кристаллизации точки системы, покидающую инконгруэнтную кривую и продолжающую дальше плавится:
1. Двойное химическое соединение в трехкомпонентной системе плавится с разложением, если точка состава этого соединения не принадлежит полю его первичной кристаллизации, а последнее примыкает к стороне проекционной диаграммы, на которой находится состав химического соединения.
2. Путь кристаллизации покидает инконгруентную кривую в точке ее пересечения с продолжением прямой, соединяющей точку исходного состава с точкой состава химического соединения. После этого путь кристаллизации пересекает поле первичной кристаллизации химического соединения по продолжению указанной выше кривой.
При плавлении с разложением химическое соединение будет выделять расплав, состав которого определяется проекцией точки перитектики двухкомпонентной системы на сторону проекционной диаграммы, то есть состава U и кристаллы (в нашем случае компонента А).
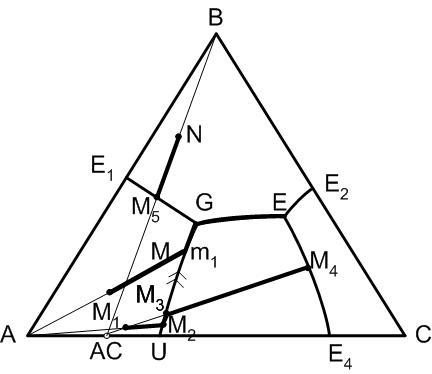
Рисунок 5 - Диаграмма трехкомпонентной системы с двойным химическим соединением, плавящимся инконгруэнтно
Точка G на диаграмме носит название точки двойного подъема. Это нонвариантная точка диаграммы, признаком которой является то, что по двум подходящим к ней пограничным кривым температура понижается к точке G и по одной пограничной кривой температура понижается от точки G. Дальнейший путь кристаллизации из точки двойного подъема возможет при уменьшении числа фаз.
Раздел 2 Индивидуальное задание
2.1 Система СаО-Al2O3-SiO2

Система СаО-Al2O3-SiO2 (рисунок 6) играет важную роль в теории и технологии производства портландцемента, глиноземистого цемента, огнеупоров, стекла, тонкой и строительной керамики и других строительных материалов.
Рисунок 6 - Области составов силикатных материалов: 1 – динасовые огнеупоры; 2 – стекла; 3 – кислые шлаки; 4 – основные шлаки; 5 – портландцемент; 6 – глиноземистый цемент; 7 – корундовые огнеупоры; 8 – муллитовые огнеупоры; 9 – шамотные огнеупоры; 10 – фарфор
В системе имеется 10 бинарных химических соединений и два тройных соединения: алюмосиликаты кальция – природные минералы анортит и геленит.