Защита против внеклеточных бактерий
Особенности иммунного ответа при поражении внеклеточными паразитами
В зависимости от локализации патогена адекватными (т.е. эффективными) являются различные механизмы иммунной защиты. Внеклеточные патогены могут быть
нейтрализованы антителами, с помощью которых к ним могут быть при-
влечены эффекторные факторы врожденного иммунитета. Патогены, лока-
лизующиеся в гранулах, могут быть уничтожены факторами врожденного
иммунитета (бактерицидные компоненты фагоцитов), стимулированными
Т-лимфоцитами и их цитокинами. Патогены, интегрированные в геном или
локализованные в цитозоле, уничтожаются вместе с инфицированной клет-
кой цитотоксическими лимфоцитами — естественными (NK) или адаптив-
ными (Т). Наконец, особые (пока недостаточно полно охарактеризованные)
способы защиты адресованы внеклеточным патогенам, локализующимся на
поверхности слизистых оболочек.
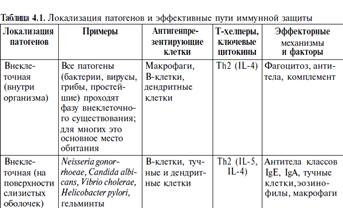
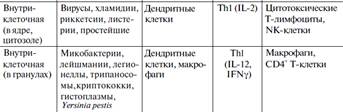
Яркое проявление адаптации системы иммунитета к взаимодействию с
патогенным окружением — осуществление адекватного выбора пути ответа
уже на этапе распознавания антигена. Этот выбор осуществляют клетки
инициаторы иммунного ответа — дендритная клетка и CD4+ Т-лимфоцит.
Дендритная клетка выбирает различные пути презентации антигена (в соста-
ве молекул МНС I или II класса), что диктуется вне- или внутриклеточной
локализацией возбудителя. Кроме того, дендритная клетка генерирует раз-
личные сигналы в зависимости от химической природы и физико-химичес-
ких характеристик его ≪опознавательных≫ молекул. CD4+ Т-клетка, в зависи-
мости от сигналов, поступающих через TCR и костимулирующие молекулы
от дендритной клетки, делает выбор между несколькими альтернативными
вариантами дифференцировки Т-хелперов, которые обеспечивают развитие
адекватной формы ответа.
Защита против внеклеточных бактерий
• Независимо от пути поступления в организм, бактерии распознаются
TLR макрофагов, тучных, эпителиальных и других клеток. Это приво-
дит к активации этих клеток, секреции провоспалительных цитокинов
и формированию воспалительной реакции, сопровождающейся мигра-
цией из сосудов в очаг лейкоцитов, в первую очередь — нейтрофилов.
• Нейтрофилы, а затем макрофаги и другие клетки фагоцитируют и раз-
рушают значительную часть бактерий. При ограниченном количестве
патогена иммунная защита успешно реализуется с помощью реакций
врожденного иммунитета.
• Независимо от успешности фагоцитоза бактерий в первую линию защи-
ты вовлекаются NKT-клетки (секретируют IFNγ), γδТ-клетки (участву-
ют в бактериолизе с помощью невыясненных механизмов) и др.
• Важнейший фактор ранней защиты против внеклеточных пато-
генов — естественные антитела, пресинтезированные В1-клетками.
Значительная часть этих антител специфична к распространеннымантигенам бактерий — фосфорилхолину, липоплисахариду, пепти-
догликанам и др. Большинство естественных антител принадлежит
к IgM-классу. Связывание этих антител с бактериями обусловливает
активацию комплемента по классичекому пути, что обеспечивает опсо-
низацию бактерий (т.е. способствует их фагоцитозу), а иногда (напри-
мер, в случае нейссерий) вызывает лизис бактерий.
• Внеклеточные микроорганизмы становится объектом действия других
гуморальных факторов врожденного иммунитета — пентраксинов (опсо-
низируют бактерии и активируют комплемент), дефензинов, секретируе-
мых эпителиальными клетками и фагоцитами. Активация комплемента на
их поверхности происходит не только по классическому, но и по альтерна-
тивному пути. Можно предполагать, что резервов врожденного иммуните-
та достаточен для отражения большинства атак внеклеточных бактерий.
• Независимо от эффективности защитной функции врожденного имму-
нитета при инфицировании бактериями происходит запуск механизмов
адаптивного иммунитета. Дендритные клетки захватывают бактерии
и их продукты (экзотоксины и др.) и доставляют их в региональный
лимфатический узел, где происходит презентация антигенного пептида
CD4+ Т-лимфоцитам.
• При ответе на внеклеточные патогены активируются преимущественно
Тh2-клетки, хотя Th1- и Тh17-клетки тоже образуются (последние необ-
ходимы для мобилизации нейтрофилов, а Th1-клетки — для обеспече-
ния IFNγ-зависимой составляющей гуморального иммунного ответа).
• В очагах поражениия и лимфатических узлах В-лимфоциты распознают
антигены бактерий, обрабатывают их и презентируют предобразован-
ным специфическим Тh2-клеткам. В-клетки получают от Т-хелперов
сигнал через костимулирующую молекулу CD40. IL-4, секретируе-
мый Тh2-клетками, обепечивает пролиферацию клона активированных
В-лимфоцитов.
• В лимфоидных фолликулах при ключевом участии фолликулярных
дендритных клеток происходит морфогенетический процесс, приво-
дящий к формированию зародышевых центров. В них мигрирует боль-
шинство стимулированных В-лимфоцитов, а также фолликулярные
CXCR5+ Т-хелперы.
• В зародышевых центрах в процессе пролиферации происходит переклю-
чение изотипов BCR и повышение его сродства к антигену благодаря
запуску гипермутационного процесса в В-клетках и отбору клонов по
сродству к антигену, представленному в составе иммунных комплексов
на фолликулярных дендритных клетках.
• В-клетки мигрируют в апикальную зону зародышевых центров, где про-
исходит дифференцировка плазматических (антителообразующих) кле-
ток. Затем плазматические клетки мигрируют в красную пульпу селе-
зенки, мозговые шнуры лимфоузлов и (преимущественно) в костный
мозг, где они секретируют антитела. Антитела главным образом класса
IgA секретируются также в мукозальном отделе иммунной системы.
• Антитела взаимодействуют с антигенами на поверхности внеклеточных
патогенов. Антитела, направленные против жгутиковых антигенов,
обездвиживают клетку. IgA-антитела, связывающиеся с бактериями впросвете кишечника, препятствуют их проникновению через кишеч-
ную стенку. Взаимодействуя с токсинами, антитела обычно вызывают
их инактивацию. Таким образом, антитела сами по себе могут осущест-
влять защиту от внеклеточных бактерий и их токсинов.
• Защитный эффект антител реализуется также с участием фагоцитов-
макрофагов (эффект опоснизации) или комплемента, активируемого по
классическому пути (эффекты оспонизации и лизиса).
Таким образом, защита от внеклеточных бактерий и других патогенов
реализуется с участием факторов врожденного иммуниета (преимущест-
венно путем фагоцитоза) и гуморальных факторов адаптивного иммуни-
тета — антител, действующих самостоятельно или усиливающих защитные
эффекты врожденного иммунитета.
Толерантность
Иммунологическая толерантность — не просто состояние иммунодепрес-
сии (хотя иммунодепрессия часто является фоном, на котором удается
индуцировать толерантность), поскольку неотвечаемость распространяется
только на антигены, использованные для индукции толерантности, тогда
как способность к иммунному ответу на другие антигены у животных
сохраняется. Иными словами, иммунологическая толерантность представ-
ляет собой специфическое подавление способности к иммунному ответу на
уровне отдельных клонов лимфоцитов.
Оптимальный материал для индукции толерантности — пролифериру-
ющие клетки кроветворной и иммунной систем. Это связано, во-первых,
с длительным персистированием этих клеток в организме вследствие их
способности к самовоспроизведению, а во-вторых, — с высоким уровнем
экспрессии ими молекул МНС обоих классов. В результате формируется
длительный химеризм, что служит обязательным условием поддержа-
ния состояния толерантности. Важно сохранение в организме хозяина
дендритных клеток донора, почти всегда присутствующих в трансплан-
тируемой ткани.
Вскоре после открытия иммунологической толерантности было уста-
новлено, что можно индуцировать специфическую неотвечаемость и на
растворимые антигены. Толерантность вызывали внутривенным введением
некоторых сывороточных белков, освобожденных от молекулярных агре-
гатов ультрацентрифугированием или ≪биологическим фильтрованием≫ —
пропусканием через организм мыши. Толерантность к растворимым анти-
генам можно индуцировать на двух дозовых уровнях, в результате чего
получают низкодозовую и высокодозовую толерантность. Существуют
некоторые структурные особенности антигенов или их физико-химичес-
кого состояния, благоприятствующие индукции толерантности и которые
можно обозначить как толерогенность (см. раздел 3.2.1.2).
Отмена состояния иммунологической толерантности может произойти
спонтанно после удаления из организма антигена (в случае его связи с
клетками — после устранения химеризма). Прерывание толерантности
может быть ускорено с помощью воздействий, повреждающих лимфо-
циты и требующих восстановления лимфоидной системы, при условии
отсутствия толерогена в период регенерации. Толерантность удается пре-
одолеть введением сингенных лимфоцитов от нетолерантных животных
(особенно эффективно толерантность отменяется при введении лимфо-
цитов от животных, иммунизированных соответствующим антигеном).
Наконец, отмене толерантности способствует иммунизация антигеном,
перекрестно реагирующим с антигеном, использованным для индукции
толерантности.
Приведенные выше данные свидетельствуют о том, что иммуноло-
гическая толерантность есть некая форма активности иммунной систе-
мы. Классическая трактовка природы иммунологической толерантности
состоит в том, что введенный антиген вызывает элиминацию или анергию
клонов лимфоцитов, которые его распознают. По-видимому, именно с воз-
можностью реализации такого процесса как элиминация клонов (наиболее
радикального механизма толерантности) связаны возрастные ограничения
индукции толерантности путем введения клеток интактным реципиентам.
4.3. Иммунологическая толерантность и анергия 569
Вероятно, такая возможность требует наличия на периферии иммунной
системы лимфоцитов, отвечающих гибелью (а не активацией, как у взрос-
лых) на действие антигена, а такие клетки содержатся в организме лишь в
короткий срок после рождения. Для поддержания толерантности необходи-
мо установление химеризма на уровне костного мозга, в результате чего в
тимус поступают дендритные клетки донорского генотипа, несущие анти-
ген, к которому индуцирована толерантность. Эти клетки обеспечивают
элиминацию соответствующих клеток на уровне отрицательной селекции.
Нарушение химеризма приводит к прекращению такой селекции и потере
толерантности.
Индукцию толерантности растворимыми антигенами первоначально
трактовали как результат ≪обхода≫ нормального механизма поглощения и
переработки антигена макрофагами. В настоящее время это можно объ-
яснить сходным, но несколько иным образом: безагрегатные антигены
действительно не активируют макрофаги, которые вследствие этого не
выделяют провоспалительные цитокины, необходимые для стимуляции
созревания иммуногенных дендритных клеток (DC1). В результате антиген
поглощают незрелые или DС2-дендритные клетки, являющиеся толероген-
ными, так как они способны индуцировать анергию Т-клеток, которым пре-
зентируют антиген. Толерантность, индуцированная белками, временна,
поскольку с удалением антигена восстанавливается нормальный процесс
презентации с участием DC1-клеток.
Объекты действия толерогенов и толерогенных факторов — преимущест-
венно Т-лимфоциты, особенно Т-хелперы, первыми получающие сигнал
от дендритных клеток. Поскольку от активации Т-хелперов зависят прак-
тически все формы иммунного ответа, их ≪толеризации≫ обычно бывает
достаточно, для предотвращения развития иммунного ответа. Однако в
опытах с индукцией иммунологической толерантности разными дозами
белковых антигенов показано, что В-клетки тоже могут приобрести состо-
яние специфической неотвечаемости, но для этого необходимы более высо-
кие дозы антигена и достигнутое состояние бывает менее стабильным.
Хотя превентивная индукция иммунологической толерантности к анти-
генам тканевых трансплантатов донора применения не нашла, ее индукцию
с помощью иммунодепрессивных воздействий (прежде всего циклоспорина)
после подсадки органов используют повсеместно и она служит основой всех
удачных случаев приживления аллогенных тканей. Индукция взаимной
толерантности тканей реципиента и донора является условием также для
формирования устойчивого химеризма без развития РТПХ при пересадке
костного мозга реципиентам, облученным при лечении гемобластозов или
в случаях радиационных катастроф.

