Необходимые теоретические сведения
Задачи на вывод химической формулы вещества
| Вывод химической формулы вещества: | Номер задачи (пример решения) | Вычисление молярной массы вещества | Задачи для самостоятельного решения |
| - на основании массовых долей (%) атомов элементов | M 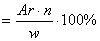 , где n - число атомов , где n - число атомов
| Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 | |
| - на основании массовых долей (%) атомов элементов и плотности соединения | М (CхНу) = D(Н2) ·М (Н2) | Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О | |
| - по плотности вещества в газообразном состоянии | М (в-ва) = ρ · М (газообр. в-ва) | Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О | |
| - на основании массовых долей (%) атомов элементов и массе соединения | М находится по соотношению, или M 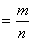
| Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. Ответ: C3Н8 | |
| - по массе или объёму исходного вещества и продуктам горения | М (в-ва)=Vm·ρ 
| Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
| Дано: w (О) = 42,67% | Решение: Рассчитать молярную массу кислоты CnН2n (N Н2) CОOH w (О) = 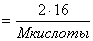 M кислоты
M кислоты 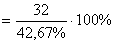 = 75 (г/моль) Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75 14 n = 14, n = 1 Ответ: формула кислоты NН2CН2CОOH М (NН2CН2 CОOH) = 75 г/моль = 75 (г/моль) Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75 14 n = 14, n = 1 Ответ: формула кислоты NН2CН2CОOH М (NН2CН2 CОOH) = 75 г/моль
|
| Вывести формулу соединения CnН2n (N Н2) CОOH |
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
| Дано: w (С) = 85,7 % w (Н) = 14,3 % D Н2 (CхНу) = 21 | Решение:
1. Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности: М (CхНу)= D (Н2) ·М (Н2)
 М (CхНу)= 21 · 2 = 42
2. m(С) = 42г. /100% · 85, 7 %= 36 г.
m (Н) = 42г. /100% · 14,3 %= 6 г. Находим количество вещества атомов углерода и водорода n (С) = 36г :12 г/моль = 3 моль n (Н) = 6г.: 1 г/моль = 6 моль
Ответ: истинная формула вещества C3Н6. М (CхНу)= 21 · 2 = 42
2. m(С) = 42г. /100% · 85, 7 %= 36 г.
m (Н) = 42г. /100% · 14,3 %= 6 г. Находим количество вещества атомов углерода и водорода n (С) = 36г :12 г/моль = 3 моль n (Н) = 6г.: 1 г/моль = 6 моль
Ответ: истинная формула вещества C3Н6.
|
| Вывести формулу соединения CхНу- ? |
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
| Дано: Пары алкана в 2,5 раза тяжелее аргона | Решение: По относительной плотности можно найти молярную массу алкана: М (C n Н 2 n + 2) = 14 n + 2 = 2,5 · М(Ar) = 100 г/моль Откуда n = 7. Ответ: формула алкана C7Н14 |
| Вывести формулу алкана C n Н2 n + 2 |
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
| Дано: w (С) = 39,97 % w (Н) = 6,73 % w (0) = 53,30 % Vн.у. (CхHуОz) = 300 мл. m (CхHуОz) = 2,41 г. | Решение: Для расчёта выбираем 100г. соединения. Тогда масса углерода равна 39,97 г; водорода 6,73 г; кислорода 53,30 г. 1. Определяем количество вещества: n (С) = 39,97г :12 г/моль = 3,33 моль n (Н) = 6,73г.: 1,008 г/моль = 6,66 моль n (0) = 53,3г.: 16 г/моль = 3,33 моль Определяем наименьшее общее кратное – 3,33. n (С) : n (Н) : n (0) = 1 : 2 : 1 Простейшая формула соединения – CH2О М (CH2О) = 30 г/моль Определяем молярную массу соединения по соотношению: 0,3 л. – 2,41 г. 22,4 л. – х г. х = (22,4 · 2,41)/0,3 = 180 Или по формуле М= Vm · m/ V К = 180 : 30 = 6 Определяем молекулярную формулу соединения, умножая стехиометрические коэффициенты в простейшей формуле на 6. Ответ: искомая формула - C6H12О6 |
| Вывести формулу соединения CхНуОz- ? |
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
| Дано: M (CхHу) = 4,4 г. ρ (н.у.) = 1,97 г/л V (СО2) = 6,72 л. m (Н2О) = 7,2 г. | Решение: 1. Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности: М (CхHу) = Vm · ρ М (CхHу) = 22,4л/моль ·1,97г/л = 44г/моль 2. Записываем в алгебраическом виде уравнение реакции горения газа, выразив коэффициенты через х и у.  Составляем пропорции: 4,4 / 44 = 6, 72/ х · 22,4 х = 44 · 6, 72/ 4,4 · 22,4 = 3 у = 44 · 7,2/ 4,4 · 9 = 8 Формула соединения C3H8; М (C3H8) = 44 г/моль Ответ: молекулярная формула соединения C3H8
Составляем пропорции: 4,4 / 44 = 6, 72/ х · 22,4 х = 44 · 6, 72/ 4,4 · 22,4 = 3 у = 44 · 7,2/ 4,4 · 9 = 8 Формула соединения C3H8; М (C3H8) = 44 г/моль Ответ: молекулярная формула соединения C3H8
| |
| Вывести формулу CхHу - ? | ||
| Вывести формулу соединения SхFу - ? | ||
Ипы задач в задании С5.
1. Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
2. Определение формулы вещества по продуктам сгорания;
3. Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
1. Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение: