Основные положения и понятия координационной теории
Комплексные соединения
Комплексные соединенияэто молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе независимо в обычных условиях. Реакции, в результате которых образуются комплексные соединения, носят название реакций комплексообразования.
Основные положения и понятия координационной теории.
Строение комплексных соединений объясняет координационная теория, предложенная швейцарским химиком А. Вернером (1893 г.) в которую он ввел два понятия: о координации и о побочной валентности.
По Вернеру главной валентностьюназывается валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности. Но, исчерпав главную валентность, атом способен, как правило, к дальнейшему присоединению за счет побочной валентности, в результате проявления которой и образуется комплексное соединение.
Основу координационной теории составляют следующие положения:
1) центральное место в комплексном соединении занимает комплексообразователь– обычно положительно заряженный ион (чаще всего металл);
2) вокруг комплексообразователя расположены или координированы лиганды, т.е. ионы противоположного знака или нейтральные молекулы; число, показывающее, сколько лигандов удерживает комплексообразователь, называется координационным числом;
3) комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения (в формулах комплекс заключают в квадратные скобки);
4) ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферукомплексного соединения.
Можно сказать, что комплексные соединения это соединения, молекулы которых состоят из центрального атома (или иона) непосредственно связанного с определённым числом других молекул или ионов, называемых лигандами.
В роли комплексообразователей чаще всего выступают катионы металлов (Со+3, Рt+4, Cr+3, Cu+2Au+3 и др.).
В качестве лигандов могут выступать ионы Cl-, CN-, NCS-, NO2-, OH-, SO42- и нейтральные молекулы (NH3, H2O, амины, аминокислоты, спирты, тиоспирты, РН3, эфиры).
Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостьюили дентатностью.
Лиганды, присоединенные к комплексообразователю одной связью, занимают одно координационное место и называются монодентатными (Cl-, CN-, NCS-). Если же лиганд присоединён к комплексообразователю посредством нескольких связей, то он является полидентатным. Например: SO42- , СО32-являются бидентатными.
Ионы внешней сферы связаны менее прочно по сравнению с лигандами и пространственно удалены от комплексообразователя. Они легко замещаются другими ионами в водных растворах.
Например, в соединении К3[Fe(CN)6] комплексообразователем является Fe+2, лигандами - CN-. Два лиганда присоединены за счет главной валентности, а 4 – за счет побочной валентности, следовательно координационное число равно 6.
Ион Fe+2 с лигандами CN- составляют внутреннюю сферу или комплекс, а ионы К+ внешнюю координационную сферу:
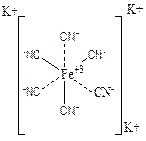
Как правило, координационное число равно удвоенному заряду катиона металла, например: однозарядные катионы имеют координационное число равное 2, 2-х зарядные – 4, а 3-х зарядные – 6. если элемент проявляет переменную степень окисления, то с увеличением её координационное число растет. Для некоторых комплексообразователей координационное число является постоянным, например: Со+3, Рt+4, Cr+3 имеют координационное число равное 6, у ионов В+3, Ве+2, Сu+2 , Au+3 координационное число равно 4. Для большинства ионов координационное число является переменным и зависит от природы ионов внешней сферы и от условий образования комплексов.