ПРОЦЕССЫ ПРЕОБРАЗОВАНИЯ ХИМИЧЕСКОЙ ЭНЕРГИИ В ЭЛЕКТРИЧЕСКУЮ ЭНЕРГИЮ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Теоретическая часть
Электрохимия – это наука, исследующая процессы превращения энергии химической реакции в электрическую и, наоборот, электрической в химическую энергию. Преобразование химической энергии в электрическую происходит в гальванических элементах. Электрическая энергия переходит в химическую в процессе электролиза.
ПРОЦЕССЫ ПРЕОБРАЗОВАНИЯ ХИМИЧЕСКОЙ ЭНЕРГИИ В ЭЛЕКТРИЧЕСКУЮ ЭНЕРГИЮ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
В системе, состоящей из металлического стержня, опущенного в воду, небольшое количество частиц металла в виде ионов переходит в воду. Такой переход возможен благодаря особенности металлической связи и структуры кристаллической решётки металлов. В узлах кристаллической решётки металла находятся атомы и ионы металла.
Ме Меn+ + n
Диполи воды взаимодействуют с ионами металла, образуя вокруг них гидратную оболочку. Это приводит к ослаблению связей с другими частицами внутри кристаллической решетки металла и способствует перемещению гидратированных катионов металла в жидкую фазу.
Меn+ + m H2O Меn+ . m H2O
При этом тонкий приповерхностный слой раствора заряжается положительно, а поверхность металла за счёт некомпенсированных электронов заряжается отрицательно. На границе раздела двух фаз возникает двойной электрический слой. Его электрическое поле препятствует перемещению катионов металла от поверхности пластинки по всему объёму воды.
Переход гидратированных ионов металла в воду или раствор является обратимым. Параллельно с гидратацией и переходом ионов в жидкую фазу идут процессы дегидратации, восстановления металла из раствора на поверхности металлической пластинки.
Меn+. m H2O + n Ме + m H2O
На границе металла и раствора устанавливается равновесие данных процессов.
Для всех металлов, погружённых в воду, металлический электрод заряжается отрицательно, а приповерхностный слой – положительно. В случае когда металлическая пластинка опущена в раствор, содержащий ионы металла пластинки, равновесие, установившееся на поверхности пластины, смещается сторону реакции перехода ионов металла на поверхность пластины. При этом металл заряжается менее отрицательно.
Разность потенциалов, возникающая между металлом и раствором, называется равновесным электродным потенциалом.
Определить абсолютное значение электродного потенциала невозможно. В связи с этим измеряют разность потенциалов между данным электродом и электродом сравнения. В качестве электрода сравнения используют стандартный водородный электрод, потенциал которого условно принимают равным нулю.(рис. 1)
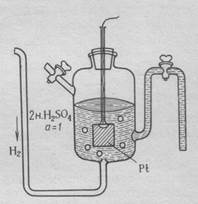
Рис.1. Строение стандартного водородного электрода
Водородный электрод состоит из платиновой пластинки, покрытой слоем губчатой платины, погружённой в раствор 2 н. серной кислоты. Через раствор кислоты пропускают газообразный водород под давлением 1 Атм.
Водород, контактируя с платиной, распадается на атомы, которые затеем адсорбируются на её поверхности.
Н2 2Н
На границе платиновой пластины и раствора устанавливается равновесие.
Н2 2Н+ + 2
В зависимости от исследуемого электрода, соединённого со стандартным водородным электродом, равновесие будет сдвигаться в сторону прямого или обратного процесса.
Электродный потенциал, измеренный в стандартных условиях (давление - 1 Атм., температура – 250С, активная концентрация ионов металла в растворе 1 моль/л), называется стандартным (0).
Активностью называют концентрацию электролитов, соответственно которой они взаимодействуют в реакциях. В растворе электролита каждый ион окружён ионами противоположного заряда, что уменьшает его подвижность. Вследствие этого электролиты в реакциях ведут себя так, будто их концентрация меньше действительной. В разбавленных растворах взаимодействие между ионами уменьшается, и значение активности практически совпадает с величиной молярной концентрации ионов металла.
Если расположить символы, обозначающие металлические электроды и водородный электрод, в порядке возрастания их стандартных потенциалов, получится ряд, называемый электрохимическим рядом напряжения металлов. На основания ряда напряжения металлов можно сделать выводы.
1. Металлы с более отрицательным электродным потенциалом, способны вытеснять металлы с более положительным потенциалом из водных растворов их солей. Например, Zn + CuSO4 = ZnSO4 + Cu.
 2. Металлы, имеющие отрицательный потенциал, вытесняют водород из кислот, а металлы с положительным потенциалом этим свойством не обладают. Например, Zn + 2HCl = ZnCl2 + H2; Cu + HCl =
2. Металлы, имеющие отрицательный потенциал, вытесняют водород из кислот, а металлы с положительным потенциалом этим свойством не обладают. Например, Zn + 2HCl = ZnCl2 + H2; Cu + HCl =
Прибор для измерения электродного потенциала является примером гальванического элемента.
Гальванический элемент состоит из двух электродов, соединённых между собой металлическим проводником и электролитическим ключом (или пористой перегородкой). Электролитический ключ представляет собой U – образную трубку, содержащую раствор электролита. В гальваническом элементе происходит преобразование энергии химических процессов в энергию электрическую.
Рассмотрим строение и процессы, протекающие в гальваническом элементе на примере цинково-медного гальванического элемента (Даниэля-Якоби). (рис. 2) Этот гальванический элемент состоит из цинкового и медного электродов.
Электрод представляет собой металлическую пластинку, опущенную в раствор соли данного металла, например, цинковый электрод состоит из цинковой пластинки, опущенной в раствор сульфата цинка, а медный электрод – из медной пластинки, опущенной в раствор сульфата меди.

Рис. 2. Цинково-медный гальванический элемент
Значение стандартного потенциал цинкового электрода меньше значения стандартного потенциала медного электрода (0 (Zn2+/Zn) = - 0,76 B, 0 (Cu2+/Cu) = 0,34 B). Поэтому в гальваническом элементе цинковая пластина будет заряжаться отрицательно, а медная - положительно. Электроны будут перемещаться от цинкового электрода к медному. На цинковом электроде будут преобладать процессы окисления цинка:
Zn Zn2+ + 2;
на медном - процессы восстановления ионов меди из раствора на поверхности медной пластинки:
Cu2+ + 2 Cu.
Электрод, в котором протекают процессы окисления, называется анодом, а электрод, на котором протекают процессы восстановления – катодом.
Потенциала анода всегда меньше потенциала катода. В гальваническом элементе анод заряжен отрицательно, катод – положительно.
Суммарный процесс протекающий на электродах выражается уравнением: Zn + Cu2+ = Zn2+ + Cu.
Схема цинково-медного гальванического элемента:
(-)Zn Zn2+Cu2+ Cu (+)
В гальваническом элементе помимо процессов окисления анода и восстановления катионов на катоде, а также перемещения электронов от анода к катоду (возникновение электрического тока), происходит направленное перемещение ионов по электролитическому ключу или через полупроницаемую мембрану от катода к аноду.
Работа гальванического элемента продолжается до полного окисления анода или полного восстановления ионов металла из раствора катода.
Характеристикой гальванического элемента является его электродвижущая сила (ЭДС, Е). Электродвижущая сила гальванического элемента – максимальное напряжение гальванического элемента, измеренное компенсационным методом, т.е. при отсутствии тока в цепи.
Следовательно, стандартный электродный потенциал есть ЭДС гальванического элемента, состоящего из стандартных исследуемого и водородного электродов.
ЭДС равна разности потенциалов катода и анода.
Ео = о(катода) – о(анода)
Для цинково-медного стандартного гальванического элемента ЭДС равна: Ео = о(Zn2+/Zn) – о(Cu2+/Cu), Ео = 0,34 - (-0,76) = 1,1 В.
На значение электродного потенциала влияют температура и концентрация ионов металла в растворе электрода. Эта зависимость выражается уравнением Нернста.

0  – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;
R - универсальная газовая постоянная, R = 8, 31  ;
;
T – температура, К;
F – постоянная Фарадея, F = 96500 Кл;
n – число электронов, участвующих в электродном процессе;
 - активная концентрация ионов металла в растворе, моль/л.
- активная концентрация ионов металла в растворе, моль/л.
Для разбавленных растворов при температуре 298 К с учётом постоянных величин, а также осуществляя переход к десятичному логарифму, уравнение Нернста приобретает вид:

Из уравнения Нернста следует, что можно изготовить гальванический элемент, состоящий из двух одинаковых электродов, отличающихся только концентрацией ионов металла или водорода в растворе. Такие элементы получили название концентрационных. Например, гальванический элемент состоит из двух никелевых электродов, концентрация ионов никеля в одном электроде 1 моль/л, в другом – 0,5 моль/л. При этом на аноде будет происходить окисление никелевой пластинки и переход ионов никеля в раствор, а на катоде - восстановление ионов никеля из раствора.
Уравнение Нернста для определения потенциала водородного электрода (рН2 = 1 Атм.) приобретает вид:  , учитывая, что рН = -lg a (H2), то формула приобретает вид
, учитывая, что рН = -lg a (H2), то формула приобретает вид 
Уравнение Нернста можно использовать для определения ЭДС гальванического элемента.
 ,
,
где а (Ox) – активность ионов металла катода, моль/л,
а (Red) - активность ионов металла анода, моль/л,
ЭДС цинково-медного гальванического элемента можно определить по уравнению:

ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Эти процессы складываются из направленного движения ионов в растворе или расплаве электролита и реакций восстановления и окисления, происходящих на электродах.
При электролизе, как и в гальваническом элементе на аноде происходит окисление, а на катоде - восстановление. Однако при этом катод подключён к отрицательному полюсу внешнего источника тока, анод – к положительному полюсу.
При электролизе расплава электролита на электродах подвергаются восстановлению и окислению только ионы, на которые диссоциирует этот электролит. Например, при электролизе расплава хлорида натрия на катоде протекает восстановление катионов натрия (Na+):
Na+ + Na;
на аноде окисление анионов хлора:
2Cl- Cl2 + 2
Суммарная реакция: 2NaCl 2Na + Cl2
Электролиз водных растворов осложняется возможностью протекания на электродах нескольких процессов. В водных растворах, кроме ионов электролита, находятся также вода, ионы Н+ и ОН-. Все эти вещества могут подвергаться электрохимическим превращениям.
Последовательность катодных реакций
При электролизе растворов солей на катоде возможны следующие реакции:
1. восстановление ионов металла
Men+ + n Me;
2. восстановление ионов водорода в кислой среде
2Н+ + 2 Н2 (  );
);
3. восстановление молекул воды
2Н2О + 2 Н2 + 2ОН- (  ).
).
Из возможных катодных процессов осуществляется тот, который характеризуется наибольшим значением электродного потенциала.
Из этого следует, что при электролизе растворов солей металлов, стоящих в ряду напряжения после водорода, например, медь, серебро, золото и другие, на электроде восстанавливаются только ионы металла и выделяется металл. В нейтральных и щелочных растворах с рН 7 возможно выделение и тех металлов, электродные потенциалы которых выше -0,41 В. (Объяснение следует дальше)
Из растворов, содержащих смесь таких катионов, происходит последовательное выделение металлов в порядке уменьшения величины их электродных потенциалов.
Если в растворе находятся ионы металлов, стоящие в ряду напряжения до алюминия включительно (  ), например, натрий, литий, кальций и другие, то на катоде восстанавливается только вода.
), например, натрий, литий, кальций и другие, то на катоде восстанавливается только вода.
Металлы, электродные потенциалы которых не сильно отличаются от водородного (находится в ряду напряжения металлов после алюминия), восстанавливаются на катоде одновременно с водой. При этом выделяется и металл, и водород. В зависимости от условий электролиза массовые соотношения металла и водорода могут быть различными, вплоть до выделения только одного металла или водорода.
Восстановление ионов металлов средней активности из растворов солей, становится возможным по двум причинам. Одна из них заключается в том, что растворы, подвергающиеся электролизу, имеют рН отличное от нуля, поэтому потенциал водородного электродного электрода становится величиной отрицательной, так, при рН = 7,  .
.
Реальные электрохимические реакции осложняются процессами диффузии ионов к поверхности электродов, адсорбции их, разрядки, десорбции и другими. Для их преодоления нужно приложить некоторое добавочное напряжение, которое получило название перенапряжения. Значительная величина перенапряжения процесса восстановления водорода, объясняет возможность восстановления на катоде достаточно активных металлов.
Последовательность анодных реакций
При электролизе растворов солей на аноде могут протекать реакции окисления:
1. анионов кислотных остатков: Ann- An + n
2. гидроксид - анионов
4ОН- - 4 2Н2О + О2 (  ).
).
3. молекул воды
2Н2О - 4 О2 + 4Н+ (  при рН = 7)
при рН = 7)
4. металла анода (растворимый анод)
Me Men+ + n
Из возможных анодных процессов осуществляется тот, который характеризуется наименьшим значением электродного потенциала.
Характер анодных процессов зависит от природы используемого анода. Различают инертные и растворимые аноды. Первые изготовлены из малоактивных металлов, например, из платины, а также используют графитовые, угольные электроды. Материалом растворимых анодов является металл с потенциалом меньшим, чем потенциалы конкурирующих процессов, например, медь, цинк и другие. При этом окислению подвергается материал анода. Так, при электролизе раствора сульфата меди (II) с медным анодом происходит растворение анода: Сu Cu2+ + 2. Это объясняется тем, что потенциал меди (  ) меньше потенциалов окисления воды и сульфат - иона. В процессе электролиза с использованием растворимого анода металла анода в виде ионов переходит в раствор, затем они могут восстанавливаться на катоде. На этом основаны методы очистки металлов от примесей (электрохимическое рафинирование металлов), методы нанесения покрытий и прочее.
) меньше потенциалов окисления воды и сульфат - иона. В процессе электролиза с использованием растворимого анода металла анода в виде ионов переходит в раствор, затем они могут восстанавливаться на катоде. На этом основаны методы очистки металлов от примесей (электрохимическое рафинирование металлов), методы нанесения покрытий и прочее.
На инертных анодах (графитовый, угольный, платиновый) могут окисляться молекулы воды, гидроксид – ионы или ионы кислотных остатков.
На аноде в растворах кислородосодержащих кислот или их солей разряжается вода. Это связано с тем, что электродные потенциалы анионов кислородосодержащих кислот имеют большие значения, чем потенциал окисления воды. Например, 2SO42- - 2 S2O82- (2,01 В). Аналогично ведут себя фторид-ионы (  ).
).
Ионы Cl-, Br-, J-, S2- разряжаются из не очень сильно разбавленных растворов.
2Сl- Cl2 + 2,  , 2Br- Br2 - 2,
, 2Br- Br2 - 2, 
2J- J2 - 2,  , S2- S - 2,
, S2- S - 2, 
В связи с перенапряжением реакции выделения кислорода на аноде идёт окисление ионов хлора, хотя  >
>  .
.
При электролизе растворов щелочей на аноде происходит окисление гидроксид-ионов, т.к.  <
<  .
.
Процессы, протекающие при электролизе, подчиняются законам Фарадея.
I. Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся веществ прямо пропорциональны количеству электричества, прошедшего через электролит.
m = k . q
где m - масса (г) образовавшегося, или подвергшегося превращению вещества;
q – количество электричества, прошедшего через электролит (Кл),
q = J . t,
J – сила тока, А; t – время, с.
k – электрохимический эквивалент.
Электрохимический эквивалент численно равен массе вещества, выделяемого 1 Кл электричества.

МЭ – молярная масса эквивалента, г/моль-экв;
F – постоянная Фарадея, равная 96500 Кл.
Постоянная Фарадея – это количество электричества, необходимое для осуществления электрохимического превращения одного моль эквивалента вещества.
Подставив все параметры, получим выражение:

II. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные их эквивалентным массам.
