Склад комплексних сполук. Координаційна теорія Вернера
Тема: Вступ. Хімія біогенних елементів.
.
Тема. Біонеорганічна хімія і медицина. Біогенні s-елементи
АКТУАЛЬНІСТЬ ТЕМИ
Значна кількість різноманітних хімічних речовин (ліки, харчові добавки, продукти забруднення навколишнього середовища) потрапляють в організм людини. Дія цих речовин, а також їх численних комбінацій може бути неоднозначною.
Особливого значення набувають відомості про вплив деяких металів на перебіг тих чи інших процесів у хворому й здоровому організмах. Сучасні дослідження свідчать, що вже незначні зміни концентрації металів, необхідних для організму (біометалів), і тим паче чужорідних, призводять до появи хвороб, притаманних вже не окремим людям, а більшості населення земної кулі. Вивчення ролі різних елементів та їхніх сполук із залишками органічних молекул має велике значення для подальшого розвитку медицини.
ВИХІДНІ ЗНАННЯ
1. Хімічний склад живих організмів.
2. Мікроелементний склад живих організмів.
3. Роль води в життєдіяльності організму.
4. Будова клітини та плазматичної мембрани.
5. Типи й механізми транспортування речовин крізь плазматичну мембрану.
6. Будова атомів хімічних елементів.
Сучасна хімія характеризується переходом до вивчення складних елементоорганічних сполук, побудованих із залишків молекул як неорганічних, так і органічних речовин. Стираються грані між традиційними науками. На межі хімії, біології та медицини виникають нові: молекулярна біологія, молекулярна генетика, молекулярна фармакологія і патологія, біоорганічна та біонеорганічна хімія. Комплекс цих наук створює ниві фундамент сучасної теоретичної медицини.
Біонеорганічна хімія розглядає роль металів у виникненні та розвитку різних процесів у здоровому та хворому організмах, створює нові ефективні препарати на основі металоорганічних сполук, активно бере участь у боротьбі за збереження здоров'я людей.
Роль металів та окремих хімічних елементів в організмі людини різноманітна. Як пластичний матеріал вони входять до складу різних частин тіла, є компонентами багатьох білків та нуклеїнових кислот, а також можуть перебувати у вільному стані чи у вигляді йонів. Вони необхідні для процесів обміну речовин, особливо як активатори й кофактори багатьох ферментів, для підтримання гомеостазу. В тілі людини знайдено близько 70 хімічних елементів, що надходять в організм разом з водою та їжею. З них 47 елементів містяться в ньому постійно, тому їх називають біогенними хімічними елементами.
У 1891 p. B.I. Вернадський установив, що кількісний та якісний склад хімічних елементів у живих організмах значною мірою залежить від вмісту їх у навколишньому середовищі- В.І. Вернадський заснував новий напрям у науці — біогеохімію, що вивчає роль мінеральних речовин у життєдіяльності організмів та вплив організмів на зміни складу ґрунтів і вод. Залежно від кількісного вмісту всі біогенні хімічні елементи В.І. Вернадський розподілив на макро-, мікро- та ультрамікроелементи:
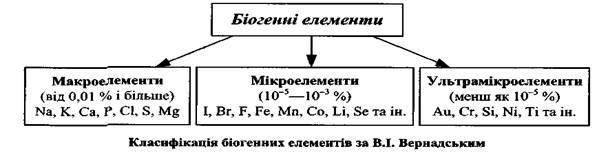
Біогенні s-елементи. s-Елементи — це елементи, в атомі яких заповнюється s-підрівень. Вони знаходяться в головних підгрупах І—II груп періодичної системи хімічних елементів Д.І. Менделєєва і позначаються червоним кольором. Як біоеле-менти найбільше значення мають Na, K, Li, Ca, Mg. На зовнішньому енергетичному рівні їх міститься один або два електрони, які вони можуть легко відщеплювати й перетворюватися на йони. Наприклад:
Будова атома: 11Na 1s22s22p63sl — хімічно дуже активний
Na0 - le- →Na+
Будова йона 11Na+1s22s22p63s0:
У водних розчинах йони цих металів зв'язують різне число молекул води, утворюючи міцні гідратовані йони.
Значення йонів s-елементів для організму дуже велике. Вони беруть участь у створенні буферних систем організму, забезпеченні необхідного осмотичного тиску, виникненні мембранних потенціалів, передаванні нервових імпульсів (Na+, K+), структуроутворенні (Са2+, Mg2+).
Поняття про осмотичний тиск.Процес розчинення пов'язаний з дифузією — довільним розподілом частинок розчиненої речовини в середовищі розчинника. Причиною дифузії є безладний тепловий рух частинок. У розчинах молекули розчиненої речовини поступово переходять від ділянки з більшою концентрацією у чистий розчинник або ділянку з меншою концентрацією того самого розчину. Одночасно молекули розчинника проникають (дифундують) в об'єм розчину з більшою концентрацією. Результатом такої двобічної дифузії є вирівнювання концентрації розчиненої речовини в усьому об'ємі розчину.
Картина істотно зміниться, якщо стикаються два розчини (наприклад, цукор у воді) різної концентрації, відокремлені один від одного напівпроникною перегородкою (мембраною), яка здатна пропускати молекули розчинника, але перешкоджає проникненню молекул розчиненої речовини.
Нехай розчин 1має меншу концентрацію, ніж розчин 2 (С1 < С2). Оскільки концентрація розчинника вища у менш концентрованому розчині, то його молекули з розчину 1 крізь напівпроникну мембрану переходять у розчин 2. Справді, розчинник може проникати крізь мембрану у двох напрямках, але швидкість його проходження з розчину 1 у розчин 2буде більшою, ніж у зворотному напрямку. Внаслідок такого переміщення рівень розчину 1 знижуватиметься, а розчину 2— підвищуватиметься (рис. 1.1, штрихові лінії).
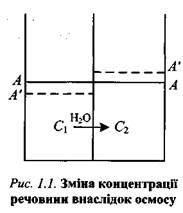
Такий процес однобічної дифузії через напівпроникну мембрану називають осмосом.
Перехід розчинника з розчину 1 у розчин 2зумовить одночасне зростання концентрації C1 і зменшення концентрації С2, тобто концентрації будуть вирівнюватися. Рівновага встановлюється при С1= С2, і осмос припиняється в момент, коли крізь мембрану в обох напрямках за одиницю часу проходить однакова кількість розчинника.
Осмотичний тиск — це тиск, який потрібно прикласти, щоб припинити осмос. Осмотичний тиск вимірюють за допомогою приладу, який називають осмометром (рис. 1.2). Він складається з трубки 1, посудини з напівпроникними стінками 2 та посудини з водою 3.
Величину осмотичного тиску розраховують за формулою π=CXRT,
де π — осмотичний тиск, кПа; СX — молярна концентрація розчину, моль/л;
R — універсальна газова стала (R = 8,314 Дж/мольК); Т— абсолютна температура, К.
Величина осмотичного тиску залежить від концентрації розчину та його температури, але не залежить від природи розчиненої речовини й природи розчинника.
 Фізіологічна роль осмосу
Фізіологічна роль осмосу
Осмос відіграє важливу роль у життєдіяльності рослинних і тваринних організмів, сприяючи достатньому обводненню клітин і міжклітинних структур. Оболонки клітин є напівпроникними мембранами. Сталий осмотичний тиск у клітинах зумовлює пружність клітин і тканин — тургор, сприяючи тим самим підтриманню еластичності тканин. Розміщуючи рослинні клітини у воді, можна спостерігати переміщення води всередині клітин, що призводить до їх набрякання, а потім і до розриву. Таке руйнування клітин називають лізисом. У концентрованих розчинах солей, навпаки, спостерігається зморщування клітин — плазмоліз, зумовлений втратою води.
Розчини з однаковим осмотичним тиском називають ізотонічними. Кров, лімфа, рідини тканин людини — це розчини багатьох речовин, їх сумарний осмотичний тиск за температури 37 °С становить близько 0,8 МПа (740—780 кПа). Такий самий тиск створює й 0,9 % розчин NaCl, який є ізотонічним крові. Ізотонічні розчини не спричинюють змін у клітинах. Саме тому розчини деяких ліків для внутрішньовенного введення виготовляють не на дистильованій воді, а на розчині натрій хлориду з масовою часткою 0,9 %, який має такий самий осмотичний тиск, як і плазма крові. У медицині цей розчин дістав назву — фізіологічного розчину.
Гіпертонічні розчини мають вищу концентрацію й осмотичний тиск. Вони зумовлюють цитоліз еритроцитів (вода виділяється з еритроцитів, вони зморщуються).
Гіпотонічні розчини мають менші концентрацію та осмотичний тиск. Вони спричинюють гемоліз еритроцитів (еритроцити руйнуються).
Осмотичний тиск біологічних рідин у різних організмах неоднаковий. Відомо, що в тканинах рослин, які вбирають воду із землі, осмотичний тиск сягає 0,5—2 мПа, а в деяких рослин пустель та солончаків — до 18 мПа. Найбільший тиск відмічено в наземних частинах рослин— листках і паростках. У рослин, а також у багатьох морських тварин і риб осмотичний тиск тканинних рідин може істотно змінюватися залежно від тиску зовнішнього середовища.
Під час консервування харчових продуктів застосування високих концентрацій солі або цукру призводить до плазмолізу мікроорганізмів, внаслідок чого вони стають нежиттєдіяльними.
Натрій.Загальний вміст Натрію в організмі становить приблизно 105 г. Він є головним катіоном позаклітинних рідин організму (наприклад, вміст Na+ в сироватці крові дорослих за нормою становить 137— 150 ммоль/л, а в еритроцитах 9—28 ммоль/л). Натрій накопичується в певних місцях, утворюючи його природні депо. У складі кісткової тканини міститься близько 44 % загальної кількості Натрію, і лише 6 % локалізується внутрішньоклітинно.
Біологічна роль Натрію полягає у підтриманні осмотичного тиску; це основний елемент у створенні нормального осмотичного тиску; йони Na+ також беруть участь у підтриманні кислотно-основного стану (КОС), передаванні збудження вздовж нервового волокна. Натрій надходить в організм з їжею, добова потреба в ньому — близько 5 г. Виводиться з організму переважно нирками, лише 5—10 % Натрію виділяється з потом і калом.
Баланс Натрію в організмі регулюється ЦНС, ендокринною системою і нирками. Гормон кори надниркових залоз альдостерон сприяє затриманню Na+ в організмі.
Патологією обмінуНатрію є гіпо- та гіпернатріємія.
Гіпонатріємія свідчить про особливо тяжкі розлади мінерального обміну в умовах серцевої недостатності. У разі загального надлишку Натрію в організмі гіпонатріємія може бути результатом депонування його у так званому «третьому просторі», тобто в тих рідинах, що утворюються в порожнинах організму при патологічних станах. Таке явище спостерігається у разі масивного випоту в плевру, швидкого розвитку асциту, формування заочеревинного випоту при травмах, ранових набряків, переміщення Натрію після введення в підшкірну жирову клітковину бідних на Натрій рідин.
Гіпонатріємія може бути проявом синдрому невідповідної секреції вазопресину — антидіуретичного гормону, коли спостерігається посилене затримання нирками вільної води.
Абсолютна нестача Натрію в організмі може настати внаслідок безсольової дієти чи тривалого внутрішньовенного введення рідин, бідних на електроліти. Іншою причиною може бути надлишкова втрата Натрію організмом внаслідок проносів, блювання, ниркової недостатності.
Гіпернатріємія спостерігається у разі гіперпродукування альдостерону, значних виділень рідини без втрати солей, при хронічних нефритах, гепатитах, цирозі печінки, менінгітах, енцефалітах.
Медичне застосування
□ NaCI (натрій хлорид) — 0,9 % розчин (ізотонічний, або фізіологічний) використовують при значних крововтратах внутрішньовенно як замісник плазми крові для підтримання осмотичного тиску та об'єму циркулюючої крові; при втратах рідини організмом внаслідок блювання, проносу, опіків. 5—10 % розчин (гіпертонічний) використовують зовнішньо для промивання гнійних ран;
□ NaHCО3 (натрій гідрогенкарбонат, або питна сода) застосовують при підвищеній кислотності шлункового соку, виразковій хворобі шлунка та дванадцятипалої кишки; як відхаркувальний засіб; для полоскання носа, порожнини рота, промивання очей;
□ NaBr (натрій бромід) використовують як заспокійливий засіб;
□ Nal (натрій йодид) — для компенсації нестачі йоду в організмі.
Калій. Концентрація Калію в клітині приблизно у 25 разів вища за його концентрацію в позаклітинній рідині (вміст Калію в сироватці крові дорослих у нормі становить 3,6—5,3 ммоль/л, в еритроцитах — 79,9—99,3 ммоль/л). Приблизний вміст Калію в організмі людини масою 70 кг становить 250 г. Не весь внутрішньоклітинний Калій здатний впливати на осмотичний потенціал. Основним депо Калію є м'язова тканина.
Біологічна роль. Калій бере участь у підтриманні осмотичного тиску та КОС у клітинах; разом з Натрієм створює різницю потенціалів по обидва боки клітинної мембрани, що забезпечує енергією фізіологічні процеси, які відбуваються в мембранах; є учасником процесів біосинтезу білка, глікогену, АТФ, ацетилхоліну; сприяє передаванню збудження нервово-м'язовим волокном.
Виводиться Калій з організму переважно нирками, а незначні його кількості — з калом, потом, слиною. Калій виводиться легше, ніж Натрій, сприяє діурезу.
Регуляція рівня К+ у крові здійснюється ЦНС і гормонами — альдостероном та інсуліном. Калійчутливі рецептори розміщені у кровоносних судинах печінки, нирок, тонкої кишки. Альдостерон посилює секрецію Калію нирковими канальцями, сприяючи зниженню його концентрації в організмі. Інсулін, навпаки, зменшує втрати Калію нирками і полегшує його транспортування до клітин. Шок при тяжких опіках зумовлений втратою клітинами йонів К+. Введення йонів Калію сприяє розслабленню серцевого м'яза між скороченнями серця.
Патологія обміну Калію виявляється гіпо- або гіперкаліємією.
Гіпокаліємія спостерігається при первинному альдостеронізмі, а також супроводжує періодичний м'язовий параліч, який виникає при мігрені, епілепсії, прогресуючій м'язовій атрофії.
Гіпокаліємія може бути також наслідком недостатнього надходження Калію, його втрати через травний канал, нирки (при хронічному нефриті, гострому канальцевому некрозі, при лікуванні діуретиками), надмірного надходження Калію в клітини (при цукровому діабеті, що лікується інсуліном) та масивної крововтрати.
Корекцію гіпокаліємії здійснюють уведенням розчину солей Калію під постійним контролем його рівня в плазмі й за допомогою електрокардіограми.
Гіперкаліємія може спостерігатися під час посиленого розпаду тканин у результаті травм, опіків, крововиливу, при діабетичній комі, а також унаслідок надлишкового введення Калію.
Зміни балансу Калію стають причиною серйозних порушень діяльності серця.
Медичне застосування:
□ КС1(калій хлорид) вводять в організм при гіпокаліємії, що виникає внаслідок приймання діуретиків; використовують як антиаритмічний засіб; для приготування сольових розчинів — плазмозамінників при втратах рідини.
□ СН3СООК(калій ацетат) є ефективним сечогінним засобом, який діє у разі серцевих та ниркових набряків.
Поняття про мембранний потенціал.Мембранний потенціал пов'язаний з нерівномірним розподілом йонів К+, Na+, Сl- між клітиною та міжклітинним простором і неоднаковою проникністю плазматичної мембрани для цих йонів (рис. 1.3, кольор. вклейка). У клітині міститься більше йонів К+, а в позаклітинному просторі — йонів Na+, Сl-. У стані спокою йони К+, Сl- легко проникають через спеціальні канали в міжклітинний простір і також легко можуть повертатись у клітину. Однак плазматична мембрана майже непроникна для йонів Na+. Отже, між зовнішньою поверхнею клітини та її внутрішнім вмістом виникає різниця потенціалів зі знаком «мінус» усередині клітини та знаком «плюс» поза клітиною.
У разі виникнення збудження в нервових, м'язових, деяких залозистих клітинах проникність плазматичної мембрани для йонів Na+ змінюється (приблизно в 500 разів). Під час подразнення клітини канали відкриваються й велика кількість йонів Na+ легко проникає в клітину та призводить до перезаряджання внутрішньої частини плазматичної мембрани на «плюс», а зовнішньої — на «мінус».
Таке перезаряджання плазматичної мембрани по обидва боки призводить до передавання нервового імпульсу вздовж клітини. Після короткотривалої (1—2 мс) підвищеної проникності мембрани для йонів Натрію настає підвищена її проникність для йонів Калію. Для того щоб відновити заряд внутрішньої поверхні мембрани (з «плюса» на «мінус»), клітина виводить назовні велику кількість Na+, а оскільки його там і так багато (перенесення відбувається проти градієнта концентрації), то цей процес викачування супроводжується витратами енергії, що вивільнюється під час розщеплення АТФ.
Такий процес перезаряджання плазматичної мембрани супроводжується виникненням біжучої хвилі збудження й зумовлює її рух по волокну на великі відстані (до 1,5 м у дорослої людини).
Літійвпливає на обмін речовин у нервовій тканині. Він пригнічує поглинання кисню корою головного мозку й частково збільшує в підкіркових зонах. На відміну від солей Цезію, Рубідію та Селену солі Літію чинять тривалу, але помірну гіпотензивну дію, знижуючи артеріальний тиск. Розчинні солі Літію пригнічують збудження, патологічну емоційну нестійкість та агресивність при психічних захворюваннях.
Медичне застосування:
□ Li2CO3(літій карбонат) використовують для профілактики та лікування деяких нервово-психічних захворювань.
Кальційміститься в організмі переважно в кістках, дентині та емалі зубів. Невелика кількість міститься в позаклітинних рідинах. У плазмі крові розрізняють кілька фракцій Кальцію: йонізований; нейонізований, але здатний до діалізу; недіалізований білокзв'язаний Кальцій.
Будова атома: 20Са 1s2222p63s33p64s2 — хімічно дуже активний;
Са0-2е- → Са2+
Будова йона: 20Са2+ 1s22s22p63s32p64s0.
Біологічно активним є тільки йонізований Кальцій. Його кількість становить 50 % загального вмісту цього елемента в організмі.
Біологічна роль. Кальцій бере участь у регуляції серцевого ритму й транспортуванні поживних речовин крізь клітинну мембрану; процесах згортання крові; функціонуванні нервової та м'язової систем. Відіграє важливу роль у проведенні нервових імпульсів, забезпечує рівновагу між процесами збудження й гальмування в корі головного мозку, бере участь у скороченні м'язів. Він також знижує рівень холестерину в крові, активізує процеси розщеплення глікогену в печінці, бере участь у процесах поділу клітин, секреції гормонів (зокрема інсуліну), модуляції електричної активності клітин тощо.
Добова потреба організму дорослої людини в Кальції в нормі становить близько 1—1,5 г. Особливо значна і постійна потреба в Кальції у дітей, а також у жінок у період вагітності та годування немовлят.
Кальцій виводиться з організму із сечею, а також слинними залозами та у складі шлункового соку й секрету підшлункової залози.
Обмін Кальцію регулюється гормонами прищитоподібних і щитоподібної залоз — кальцитоцином та паратгормоном. Паратгормон впливає на кісткову тканину, нирки і травний канал. При цьому спостерігається підвищення концентрації йонів Са2+ у крові. Вплив гормону на кісткову тканину виявляється у збільшеному вивільненні з кісткового матриксу Са2+ (мобілізація), у нирках посилюється канальцева реабсорбція Са2+ і стимулюється синтез кальцитріолу (активна форма вітаміну D), що підсилює всмоктування Са2+ в кишках.

Кальцитоцин знижує рівень Кальцію в крові через виведення Са2+ із сечею та гальмування виходу з кісткової тканини.
У нормі синтез цих гормонів перебуває в динамічній рівновазі.
Патологія обміну Кальцію може виявлятися у формі гіпо- або гіперкальціємії.
Гіпокальціємія спостерігається при гіпопаратиреозі, що призводить до зниження рівня йонізованого Кальцію в крові. При цьому виникають спазми м'язів рук і ніг, судоми (тетанія) м'язів ніг та спини, розм'якшення кісток, остеопороз, руйнування зубів. Зниження рівня Кальцію спостерігається при механічних жовтяницях, нефрозах, гломерулонефритах, гіповітамінозі D (що особливо важливо в дитячому віці, адже в такому разі розвивається рахіт).
Гіперкальціємія виникає при гіперфункції прищитоподібних залоз, деструктивних процесах у кістках. Надлишок Кальцію супроводжується такими явищами, як зниження апетиту, закреп, спрага, підвищений діурез, гіпотонія м'язів, ослаблення рефлексів, підвищення тиску.
Медичне застосування:
□ СаСl2(кальцій хлорид) широко використовують при алергічних захворюваннях (знімає набряки, запалення); як кровоспинний засіб; при спазмах серцево-судинної системи; переломах кісток; нестачі Кальцію в організмі;
□ Кальцій лактат, кальцій глюконат застосовують у тих самих випадках, що й кальцій хлорид;
□ CaSO4 • 2Н2О(гіпс) — біло-сірий порошок, який при змішуванні з водою швидко твердне. На цій властивості ґрунтується його застосування в медицині для гіпсових пов'язок при переломах кісток.
Магній.В організмі дорослої людини міститься 20—25 г Магнію, з них половина — в кістках і третина — у м'язах. Концентрація елемента в клітинах значно вища, ніж у міжклітинній рідині та плазмі крові. Більша частина Магнію в клітинах зв'язана з білками й такими низькомолекулярними сполуками, як нуклеотидфосфати (АМФ, АДФ, АТФ тощо), а також утворює комплекси з нуклеїновими кислотами.
Біологічна роль. Йони Mg2+ беруть участь у передаванні нервового імпульсу, скороченні м'язів, метаболізмі вуглеводів. Магній входить до складу системи пропердину, яка захищає від інфекційних хвороб; пригнічує всмоктування Са2+ (замішує його); затримує Фосфор в організмі; сприяє виділенню жовчі, стимулює перистальтику кишок, знижує рівень холестеролу.
Магній можна назвати центральним елементом енергетичних процесів. Магній — один з основних активаторів ферментативних процесів. Він активує ферменти синтезу та розпаду АТФ.
Патологія обміну Магнію може виявлятися у формі гіпомагніємії.
Гіпомагніємія може спостерігатися при нестачі білка і низькій енергетичній цінності дієти. До дефіциту Магнію в організмі призводить також втрата його із сечею. Клінічні ознаки гіпомагніємії такі самі, як і при гіпокальціємії: підвищена нервово-м'язова збудливість, розлади психіки, які лікують за допомогою розчину магній хлориду.
Добова потреба організму в цьому елементі становить 300—350 мг.
Медичне застосування:
□ MgSO4 • 7Н2O (магній сульфат семиводний, англійська сіль) використовують як послаблювальний засіб. Проносна дія цієї солі пов'язана з майже повною непроникністю стінок кишок для йонів Mg2+, внаслідок чого відбувається осмотичне перенесення води крізь стінки кишок.
□ Солі Магнію використовують для гальмування нервової системи (у великих дозах може зумовити наркотичний стан); при гіпертонічній хворобі; при епілепсії та атеросклерозі.
Тема. Комплексні сполуки
АКТУАЛЬНІСТЬ ТЕМИ
Комплексні сполуки (КС) відіграють важливу роль у біохімічних процесах, адже переважна більшість хімічних елементів міститься в органах і тканинах у вигляді комплексних сполук з різними біомолекулами. Так, необхідні для життєдіяльності організму метали входять до складу біосистем у формі гідратованих йонів, тобто вони координаційно зв'язані з молекулами води. У комплексах металів з біолігандами виявляється активність ферментних систем (металоферментів), які прискорюють перебіг окремих біохімічних реакцій. Отже, в організмі КС виконують найрізноманітніші функції: накопичення й транспортування різних речовин та енергії, обмін і блокування функціональних груп, участь в окисно-відновних реакціях (ОВР), утворення та розщеплення хімічних зв'язків.
ВИХІДНІ ЗНАННЯ
1 Будова атомів хімічних елементів.
2. Типи хімічних зв'язків.
3. Механізми утворення ковалентного зв'язку (донорно-акцепторний зв'язок).
Склад комплексних сполук. Координаційна теорія Вернера
Комплексні сполуки було отримано ще в середині XIX ст. Наприкінці століття було встановлено, що в багатьох сполуках крім основних валентних зв'язків існують додаткові взаємодії, які на той час не можна було пояснити на підставі класичного вчення про валентність. Нагадаємо, що валентність елемента — це здатність його атомів приєднувати певну кількість атомів іншого елемента.
У 1893 р. швейцарський хімік А. Вернер систематизував відомі на той час дані й створив координаційну теорію, суть якої полягає ось у чому:
1. Крім головних валентностей, атоми мають додаткові (побічні) валентності.
2. Насичення основних валентностей приводить до утворення сполук першого порядку на зразок НС1, Н2О, CuCl2, SО3 тощо.
3. Насичення побічних валентностей лежить в основі утворення сполук вищого порядку, наприклад NН4Br, [Co(NH3)6]Cl3, A1C13•6Н2О, K2[PtCl6], які називають комплексними.
4. Комплексні сполуки мають центричну будову, оскільки всі групи, що входять до їх складу, певним чином розміщені навколо атома — комплексоутворювача, або центрального атома (йона).
Комплексними сполуками називають стійкі хімічні сполуки, у вузлах кристалічної ґратки яких знаходяться складні частинки, що містять центральний атом (йон) і молекули або йони, що його оточують.
Наприклад, у сполуках [Ag(NH3)2]Cl і K2[Zn(OH)4] центральним атомом, або комплексоутворювачем, є йони Ag+ і Zn2+. Вони оточені нейтральними молекулами амоніаку NH3 у першій сполуці або гідроксид-іонами ОН- у другій сполуці, які називають лігандами. Комплексоутворювач (здебільшого це йон перехідного металу Меп+ і рідше метал Me) разом з лігандами утворює внутрішню координаційну сферу, яка може бути як електронейтральною, так і у формі катіона чи аніона. Йони Сl- або К+, які приєднуються до внутрішньої координаційної сфери йонним зв'язком, утворюють зовнішню координаційну сферу.
Центральним атомом можуть бути різні хімічні елементи, однак найбільшу здатність до комплексоутворення виявляють d-елементи. Лужні та лужноземельні метали є менш активними комплексоутворювачами. Такі неметали, як В, Si, P, As, виконують роль центрального атома в КС на зразок К[ВН4], H2[SiF6], K[PF6] та ін.
Комплексоутворювач характеризується координаційним числом (к.ч.), яке показує, скільки простих лігандів координується навколо центрального атома. Інакше кажучи, координаційне число — це число зв'язків, за допомогою яких ліганди сполучені з комплексоутворювачем. Воно залежить від природи комплексоутворювача та лігандів. Зі збільшенням ступеня окиснення центрального атома зростає і к.ч., яке, як правило, вдвічі більше від валентності комплексоутворювача й найчастіше має значення 2, 4, 6.

Важливою характеристикою лігандів Lє їхня координаційна ємність, або ден-татність. Дентатність— це кількість місць, які займає певний ліганд у внутрішній координаційній сфері комплексу. Ліганди поділяють на моно-, бі-, три- і полідентатні. Монодентатний ліганд займає одне місце в координаційній сфері, наприклад, нейтральні молекули Н2O, NH3, CO, NO та одновалентні кислотні залишки Сl-, Br-, I-, F-, CN-, OH-, SCN- Бідентатними лігандами є аніони двох- та багатоос-новних кислот — CO  , SO
, SO  , С2O
, С2O  , Р2O
, Р2O  , етилендіамін H2N—CH2—CH2—NH2 (En) та більшість амінокислот. До тридентатних відносять аспарагінову кислоту, до полідентатних — деякі амінокарбонові та поліамінокарбонові кислоти.
, етилендіамін H2N—CH2—CH2—NH2 (En) та більшість амінокислот. До тридентатних відносять аспарагінову кислоту, до полідентатних — деякі амінокарбонові та поліамінокарбонові кислоти.