Измерение количества электричества
Кулонометрическое определение меди (II)
Определение Cu2+ основано на обратимом кулонометрическом титровании I2, выделившегося в результате следующей реакции:
2Cu2+ + 4I- = 2CuI + I2 в растворе.
К выделившемуся I2 добавляют избыток тиосульфата натрия, и после протекания реакции:
2S2O32- + I2 = S4O62- + 2I-
Оставшийся в избытке тиосульфат натрия титруют йодом, электрогенерированным на платиновом электроде из вспомогательного реагента KI:
2I- – 2e- = I2 на электроде
Конечную точку титрования определяют визуально по появлению окраски комплекса крахмала с йодом.
Реактивы и посуда:
1. Лабораторный электрохимический стенд.
2. Персональный компьютер.
3. Программное обеспечение MultyLab.
4. Электрохимическая ячейка с платиновым генераторным и стеклоуглеродным вспомогательным электродами.
5. Катодное отделение (ячейка с мембраной) для вспомогательного стеклоуглеродного электрода с насыщенным раствором KCl (или солевой мостик).
6. Анализируемый раствор тиосульфата натрия, Na2S2O3, ~110-3 М раствор.
7. Раствор иодида калия, 0.2 М.
8. Раствор крахмала, 1 %-ный.
9. Пипетки вместимостью 5.0 и 10.0 мл.
10. Мерная колба вместимостью 100.0 мл.
11. Стакан вместимостью 100 мл.
12. Мерный цилиндр вместимостью 50 мл.
13. Магнитная мешалка.
I. Стандартизация раствора тиосульфата натрия методом кулонометрического титрования с визуальной индикацией к.т.т.
Электрохимическая реакция на электроде:
2 I – 2e– I2.
Химическая реакция в растворе:
I2 + 2 S2O32 2 I + S4O62.
Титрование ведут при постоянной силе тока 3–5 мА. Конечную точку титрования устанавливают визуально по появлению окраски комплекса крахмала с йодом.
Выполнение работы
Подготовка электрохимического датчика
1.1. Подготовить электроды к работе: платиновый электрод обработать раствором HNO3 (1:1) и многократно промыть дистиллированной водой, стеклоуглеродный электрод в трубчатой камере с пористой диафрагмой должен быть предварительно выдержан в течение нескольких часов в дистиллированной воде. Платиновый генераторный электрод подключают к разъему Uвых, стеклоуглеродный вспомогательный электрод, погруженный в катодное отделение с насыщенным раствором KCl (можно использовать солевой мостик), – к разъему Iвх для генераторной цепи стенда.
1.2. Поднять держатель электродов вверх.
1.3. В стакан для титрования вносят 10 мл 0.2 М раствора KI и 1 мл крахмала, отмеренные мерным цилиндром. В раствор погружают платиновый генераторный и платиновый вспомогательный электроды на 1.5–2 см. Опустить магнитную мешалку и установить стаканчик на основание стенда.
1.4. Опустить держатель электродов вниз.
1.5. Запустить программу «MultyLab», при этом на мониторе появляется главное окно программы
Выбор текущих установок
2.1. Нажать на панели управления кнопку «Установки», на экране монитора появляется диалоговое окно «Текущие установки».
2.2. Активировать в этом окне четыре установки:
· включить мешалку и установить слайдером интенсивность перемешивания;
· В диалоговом окне «Текущие установки» устанавливают постоянное значение силы тока «5 мА», выбирают параметр регистрации для генераторной цепи – «Ток ± 10 мА».
· источник напряжения вгенераторной цепи и источник напряжения в индикаторной цепи должны быть дезактивированы для данного вида титрования.
2.3. В окне «Дополнительные параметры»задать следующие установки:
· период регистрации значений – 1 с;
· «Приливаемый объем титранта» – V = 10.0 мл. Внимание! В данном случае под установкой «Объем прилитого титранта» подразумевают объем аликвоты исследуемого раствора тиосульфата натрия, поскольку в методе кулонометрического титрования титрант не приливается, а генерируется на электроде.
После выбора текущих установок экран монитора будет поделен на четыре окна, в каждом из которых располагается график для регистрации установленных параметров, причем, рядом с вертикальной осью верхнего графика в окне «Генераторная цепь» должна появиться надпись «Ток», а рядом с вертикальной осью нижнего графика в окне «Генераторная цепь» – надпись «Q». Это значит, что прибор готов к работе в режиме кулонометрического титрования.
Выполнение измерений
3.1. Внести в стакан для титрования аликвоту исследуемого раствора тиосульфата натрия объемом 10.0 мл. На панели управления активировать кнопку «Старт». В верхнем правом углу монитора появляется окно «Регистрация», включается мешалка, начинается генерация титранта и начинается измерение текущего параметра – количества электричества. (Текущие установки– интенсивность перемешивания, силу тока в генераторной цепи – можно изменить в окне «Регистрация», изменение параметра необходимо подтвердить нажатием клавиши «Применить», в этом случае измененные настройки будут сохранены). Регистрируемое значение визуально отображается на странице «От времени» в окне «Генераторная цепь», на графиках зависимости тока от времени и количества электричества от времени. Электролиз проводят до появления отчетливой синей окраски раствора.
3.2. После окончания титрования аликвоты в окне «Регистрация» нажимают кнопку «Стоп». На странице «От V титранта» в окне «Генераторная цепь» появляется контрольная точка.
3.3. Результаты титрования записать в «Архив».
4. Запись результатов в «Архив»
На панели управления активировать кнопку «Архив/Сохранить в архив» и внести необходимую текстовую информацию.
Измерение количества электричества
5.1. В верхней части графика Ток–Время маркером <S> задают диапазон интегрирования, выделяя для этого участок между двумя точками.
5.2. По интегральной зависимости Q–Время определяют численное значение Q, которое было затрачено на генерацию титранта, необходимого для реакции с данным объемом тиосульфата натрия. Соответствующее значение Q(Кл) автоматически отображается в верхней части графика.
Печать графиков
6.1. Если у компьютера имеется выход на принтер, на панели управления активировать кнопку «Архив/Открыть архив», открыть нужный файл, активировать кнопку «Печать» и отправить на печать графические зависимости.
6.2. В случае, если выход на принтер отсутствует, нужный файл с рисунком перенести в буфер обмена, например, нажав в сочетании клавиши «Alt» и «Print Screen».
6.3. Свернуть программу «Multilab», открыть программу «Microsoft Word», вставить файл с рисунком из буфера обмена, например, нажав в сочетании клавиши «Сtrl» и «V».
6.4. Сохранить файл с рисунком как документ «Word», скопировать его на электронный носитель и распечатать.
По данным кулонометрического титрования вычисляют массу тиосульфата натрия в аликвоте исследуемого раствора (в граммах), используя закон Фарадея:
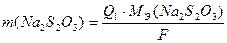
где Q1 – количество электричества, необходимое для титрования аликвоты исследуемого раствора Na2S2O3, Кл; МЭ(Na2S2O3) молярная масса эквивалента тиосульфата натрия, г/моль-экв; F – постоянная Фарадея (96485 Кл).
Нормальность раствора тиосульфата натрия рассчитывают по формуле:
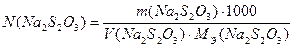
где m(Na2S2O3) – найденная масса тиосульфата натрия в аликвоте исследуемого раствора, г; Va – объем аликвоты исследуемого раствора Na2S2O3, мл.
Проводят статистическую обработку результатов стандартизации раствора тиосульфата натрия, полученных подгруппой студентов, с расчетом среднего, стандартного отклонения, обнаружением и исключением промахов, нахождением доверительного интервала с заданной доверительной вероятностью.
II. Определение содержания меди растворе
Получают у лаборанта контрольную задачу, содержащую раствор меди (II). К анализируемому раствору приливают 10 мл раствора KI. Затем добавляют пипеткой 10.0 мл раствора тиосульфата натрия и 1 мл раствора крахмала. Далее проводят титрование так же, как и при определении Na2S2O3 (см. п. 3 «Выполнение измерений»). Находят количество электричества Q2, затраченное на генерацию йода.
Расчет количества Cu2+ (в граммах) проводят по формуле:

где Q – количество электричества, рассчитываемое по формуле Q= Q1 – Q2; МЭ(Cu) молярная масса эквивалента меди, г/моль-экв; F – постоянная Фарадея (96485 Кл).