Комплексообразование в организме
В живом организме d-элементы представлены в основном, как микроэлементы. «Свободных» ионов металлов в организме нет, т.к. они либо гидролизуются, либо гидратированы, либо существуют в виде КС. Чаще всего в биохимических реакциях d-элементы участвуют в качестве биоорганических комплексов металлов. Их лигандами могут быть аминокислотные остатки, пептиды, белки, гормоны, нуклеиновые кислоты (НК) и некоторые др. Биоорганические комплексы d-элементов называют биокластерами. В них входят металлы, которые взаимодействуют с донорными атомами связывающих групп: ОН–, сульфогидрильные группы (SH, NH2) белков или аминов, СОО–.
В зависимости от размера полости, природы электродонорных атомов, ее образующих, от их расположения в пространстве в нее могут попасть только те металлы, диаметр ионов которых соответствует диаметру полости. Наиболее известные металлоферменты: карбоангидраза, ксантиноксидаза, цитохромы. Это биокластеры, содержащие катионы Zn, Mo, Fe соответственно.
В зависимости от выполняемой биологической функции, биокомплесы металлов условно делят на следующие группы:
– транспортные –прежде всего доставляют организму кислород (гемоглобин) и металлы, такую функцию выполняет железосодержащий фермент трансферрин;
– аккумуляторы (накопители) – биокомплексы, содержащие Fe – миоглобин, ферриты;
– биокатализаторы (ферменты).
Многие соединения d-элементов (Zn, Cd, Hg, Ag,V, Niи др) и некоторые р –элементы (Pb, As, Sb, Bi и др.) оказывают токсическое действие на организм человека. Это объясняется тем, что вышеуказанные элементы образуют с белками нерастворимые соединения. Этот процесс получил название денатурации. Денатурация белков происходит в результате взаимодействия ионов тяжелых элементов с электронодонорными атомами серы групп – SH, входящих в состав белков. Возможна также координация d–элементов по атому азота аминогруппы. Комплексообразование позволяет вывести из организма многие токсические вещества. Так, при остром отравлении (если не произошло всасывания ядов в кровь) пострадавшему дают белковые продукты: яйца, молоко. Если же наступило всасывание ядов в кровь, а также при хроническом отравлении вводят различные препараты (антидоты): унитиол, раствор Na2S2O3, динатриемую соль ЭДТА и др.
Комплексообразование используют при консервировании донорской крови. В качестве антикоагулянтов используют Na2-ЭДТА и цитраты.
Громадна роль комплексообразования и в растительном мире: это процессы метаболизма, катализа и синтеза.
Строение гемма
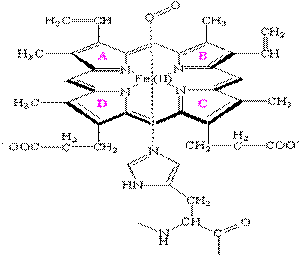 Наиболее известным переносчиком кислорода является гемоглобин.Он присутствует в организмах позвоночных, а также и ряда беспозвоночных (например, двустворчатых моллюсков, морских многощетинковых червей, голотурий). Молекула гемоглобина состоит из белковой части – глобинаи гема – комплекса Fe(II) с одним из порфиринов–так называемым протопорфирином IX.Порфирин – это циклическая молекула, в состав которой входит 4 пиррольные группы. Атом железа образует с атомами азота две ковалентные и две координационные (донорно-акцепторные) связи. в действительности же все 4 связи Fe-N почти равноценны (как и 4 связи N–H в катионе аммония), поэтому вклад резонансных структур примерно одинаков.
Наиболее известным переносчиком кислорода является гемоглобин.Он присутствует в организмах позвоночных, а также и ряда беспозвоночных (например, двустворчатых моллюсков, морских многощетинковых червей, голотурий). Молекула гемоглобина состоит из белковой части – глобинаи гема – комплекса Fe(II) с одним из порфиринов–так называемым протопорфирином IX.Порфирин – это циклическая молекула, в состав которой входит 4 пиррольные группы. Атом железа образует с атомами азота две ковалентные и две координационные (донорно-акцепторные) связи. в действительности же все 4 связи Fe-N почти равноценны (как и 4 связи N–H в катионе аммония), поэтому вклад резонансных структур примерно одинаков.
С трех сторон порфириновый цикл гема содержит гидрофобные заместители – метильные и винильные группы, а с четвертой стороны – две гидрофильные карбоксильные группы, которые в нейтральной среде находятся в анионной форме СОО-.
Рисунок 1.Строение гема
Координационное число атома железа в геме равно 6, поэтому он может образовывать еще две координационные связи: с молекулой кислорода и азотом гистидина – аминокислоты в составе белка глобина.Строение молекулы гема представлено на рис. 1.