Глава 1. Строение и свойства материалов
Кристаллические и аморфные тела
В природе существуют две разновидности твердых тел, различающихся по свойствам – кристаллические и аморфные.
Кристаллические –остаются твердыми, т.е. сохраняют приданную им форму до вполне определенной температуры (t плавления), при которой они переходят в жидкое состояние.
Аморфные –при нагреве размягчаются в большом температурноминтервале, становятся вязкими, а затем переходят в жидкое состояние.
При охлаждении процесс идет в обратном направлении. Кристаллическое состояние твердого тела более стабильно, чем аморфное.
Аморфное состояние можно зафиксировать во многих органических и неорганических веществах ускоренным охлаждением из жидкого состояния. Нестабильность аморфного твердого тела проявляется в частичном или полном переходе в кристаллическое состояние при повторном нагреве (помутнение неорганических стекол), при деформации (кристаллизация резины при растяжении).
Кристаллические тела характеризуются упорядоченным расположением в пространстве частиц, из которых они состоят (ионы, атомы, молекулы).
Свойствакристаллов зависят от электронного строения атомов и характера взаимодействия их в кристалле, от пространственного расположения частиц, химического состава. Все эти детали строения кристаллов описывает понятие «структура».
Используют следующие понятия: тонкая структура, микроструктура, макроструктура.
Тонкая структура –описывает расположение частиц в кристалле и электронов в атоме и изучается дифракционными методами.
Большинство материалов состоит из мелких кристалликов (зерен) – это микроструктура. Изучается с помощью оптического или электронного микроскопа.
Изучая строение кристаллов – макроструктуру с помощью лупы или невооруженным глазом можно выявить характер излома, усадочные раковины, поры, размеры и форму крупных кристаллов, волокнистость, трещинноватость, химическую неоднородность.
1.2. Элементы кристаллографии
Кристаллическая решетка
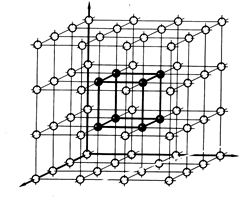 В кристалле частицы (ионы, атомы, молекулы), из которых построен кристалл, сближены до соприкосновения и располагаются закономерно по разным направлениям (рис 1.1).
В кристалле частицы (ионы, атомы, молекулы), из которых построен кристалл, сближены до соприкосновения и располагаются закономерно по разным направлениям (рис 1.1).
Рис. 1.1. Схематическое изображение простейшей кубической пространственной
решетки металла и его элементарной ячейки (выделена более толстой линией).
Атомы расположены равномерно во всех трех направлениях.
Если в кристалле провести три ортогональных направления x, y, z, то расстояния между частицами, расположенным по этим направлениям в общем случае неодинаковы и равны а, вис соответственно.
Плоскости, параллельные координатным плоскостям, находящиеся на расстоянии а, в, с,разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед называют элементарной ячейкой.Последовательное перемещение его образуют кристаллическую решетку. Вершины параллелепипеда называют узламипространственной решетки.С этими узлами совпадают центры тяжести частиц, из которых построен кристалл.
Для описания элементарной ячейки кристалла решетки используют 6 величин: 3 отрезка, равные расстояниям а, в, с до ближайших частиц по осям координат, и 3 угла α, β, γ между этими отрезками.
Соотношения между этими величинами определяются симметрией, согласно которой все кристаллы подразделяются на семь систем (табл. 1.1).
Табл. 1.1
Кристаллические системы элементов
| Система | Ребра | Углы |
| Триклинная Моноклинная Ромбическая Ромбоэдрическая Гексагональная Тетрагональная Кубическая | а ≠ в ≠ с а ≠ в ≠ с а ≠ в ≠ с а = в =с а = в ≠ с а = в ≠ с а = в = с | α ≠ β ≠ γ α = β = 90º γ ≠ 90º α = β = γ = 90º α = β = γ ≠ 90º α = β = 90º γ = 120º α = β = γ = 90º α = β = γ = 90º |
Размер элементарной ячейки кристаллической решетки оценивают отрезки а, в, с. Их называют периодами решетки.
В большинстве случаев решетки имеют сложное строение, т.к. частицы находятся не только в узлах, но и на гранях или в центре решетки (рис. 1.2). О степени сложности судят по числу частиц, приходящихся на одну элементарную ячейку. В простой пространственной решетке всегда на одну ячейку приходится одна частица. В каждой ячейке имеется восемь вершин, но каждая частица в вершине относится, в свою очередь, к восьми ячейкам. Таким образом, от узла на долю каждой ячейки приходится 1/8 объема, а всего узлов в ячейке – 8, следовательно, на ячейку приходится одна частица.
 | |||||
 |  | ||||
Рис.1.2. Элементарные ячейки трех наиболее типичных для металлов
кристаллических решеток: а - объемноцентрическая кубическая (ОЦК) – α-железо;
б- гранецентрическая кубическая (ГЦК) – γ-железо, медь, никель;
в – гексагональная плотноупакованная (ГП) – цинк.
В сложной пространственной решетке на одну ячейку приходится больше одной частицы. На объемно-центрированную ячейку приходятся две частицы: одна - от вершины и другая - центрирующая, которая относится только к данной ячейке. В гранецентрированной ячейке имеются четыре частицы: одна - от вершины и три - от шести центрированных плоскостей, так как частица, находящаяся в центре плоскости, относится одновременно к двум ячейкам.
Система, период и число частиц, приходящихся на элементарную ячейку, полностью определяют расположение частиц в кристалле. Дополнительными характеристиками кристаллической решетки являются координационное число и коэффициент компактности.

 Число ближайших равноудаленных частиц определяет координационное число К(рис. 1.3).Например, в решетке объемно – центрированного куба (ОЦК) для каждого атома число таких соседей будет равно 8 (К8). Для простой кубической решетки координационное число будет 6 (К6), для гранецентрированной кубической решетки (ГЦК) – 12 (К12).
Число ближайших равноудаленных частиц определяет координационное число К(рис. 1.3).Например, в решетке объемно – центрированного куба (ОЦК) для каждого атома число таких соседей будет равно 8 (К8). Для простой кубической решетки координационное число будет 6 (К6), для гранецентрированной кубической решетки (ГЦК) – 12 (К12).
Рис. 1.3. Определение координационного числа в кристаллической решетке
а – ГЦК , б - ОЦК
Отношение объема всех частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки определяет коэффициент компактности. Для простой кубической решетки его значение равно 0.52, для ОЦК – 0.68 и для ГЦК – 0.47.
Оставшееся пространство образуют поры, которые подразделяют на октаэдрические и тетраэдрические. На рис.1.4. центры этих пор показаны маленькими точками на ГЦК решетке. Радиус октаэдрической поры составляет 0.41, а тетраэдрической поры – лишь 0.22 радиуса частицы.

Рис. 1.4. Поры в кристаллической решетке: а – тетраэдрическая, б - октаэдрическая
Для многих металлов характерна плотная упаковка частиц. Если частицы изобразить в виде шаров, то получатся структуры, показанные на рис. 1.5.
Шестигранная призма на рис. 1.5а изображает гексагональную плотноупакованнуюрешетку (ГП) – на первый слой шаров (А) в лунки накладывают второй слой (В). Если третий слой шаров укладывается над первым слоем – получается ГП-решетка. Если третий слой не укладывается над первым, а только четвертый повторяет первый слой шаров, то получается гранецентрическая кубическая решетка (ГЦК) (рис 1.5в).
Если частицы обладают сферической симметрией, то отношение периодов с/а = 1,633 (как в ГП кристаллической решетке, где а=в≠с, α=β=90о , γ=120о)
При отклонении частиц от сферической симметрии возможно образование гексагональных структур с соотношением периодов, отличающихся от 1.633, а также ОЦК – структур (рис.1.5.б).
 | |||||
 | |||||
 | |||||
а б в
Рис.1.5. Упаковка частиц в кристалле: а – ГП, б – ОЦК, в – ГЦК