Аминокислоты - главные составные части белков
Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты - это аминопроизводные класса карбоновых кислот. Аминокислоты входят не только в состав белков. Многие из них выполняют специальные функции. Поэтому в живых организмах различают аминокислоты протеиногенные (кодируются генетически) и непротеиногенные (не кодируются генетически).
Классификация аминокислот:
1.Ациклические АК
· моноаминомонокарбоновые, содержат 1 -аминную и 1-карбоксильную группы: L-глицин, L -аланин, L -серин, L -треонин, L -цистеин, L -метионин, L -валин, L -лейцин.
· моноаминодикарбоновые -содержат 1-аминную и 2 карбоксильные группы: L-глутаминовая кислота, L-аспарагиновая кислота.
· диаминомонокарбоновые - содержат 2 аминные и 1 карбоксильную группы: L-лизин и L-аргинин
2. Циклические аминокислоты имеют в своем составе ароматическое или гетероциклическое ядро: фенилаланин, L-тирозин, L-триптофан, L-гистидин
Соединения состоящие из 2 АК – дипептид, состоящее из 3 АК- трипептид.
3. Уровни структурной организации белков
Всего различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами.
ü Первичная структура
Первичная структура представляет собой последовательность аминокислот в полипептидной цепи (рис. 1). Структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка, информация, находящаяся в гене, сначала переписывается на мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка.
 рисунок 1.
рисунок 1.
Можно выделить следующие этапы выяснения первичной структуры белков и пептидов:
· Выделение белка в чистом виде и определение его молекулярной массы
· Определение аминокислотного состава
· Определение N-концевой аминокислоты
· Определение С-концевой аминокислоты
· Определение аминокислотной последовательности
Определение аминокислотного состава белка. До определения аминокислотной последовательности выделенного белка желательно иметь представление о его аминокислотном составе, то есть знать, какие аминокислоты и в каком количестве входят в состав его молекулы. Для этого проводят полный гидролиз белка с последующим количественным анализом высвободившихся аминокислот. Чаще используют кислотный гидролиз. Полипептид растворяют в 6N НCl в отсутствие кислорода, чтобы предотвратить окисление серосодержащих аминокислот. Смесь нагревают до 100-1200С и выдерживают при этой температуре в течение 10-100ч. К сожалению при этом способе гидролиза некоторые аминокислоты (Сер, Три, Тир, Глн, Асн) разрушаются.
Аминокислотный состав полипептидного гидролиза определяют с помощью автоматического аминокислотного анализатора. Прибор разделяет аминокислоты посредством ионообменной хроматографии. Их идентифицируют по элюционному объему и количественно учитывают по интенсивности флюоресценции после проведения реакции с дансилхлоридом.
· Определение N-концевой аминокислоты.
Популярным методом идентификации N-концевой аминокислоты является разрушение по Эдману. Фенилизотиоцианат (ФИТЦ, реактив Эдмана) взаимодействует с N-концевой аминогруппой белков в слабо щелочной среде. В результате образуется фенилтиокарбамильный продукт. Его обрабатывают безводной сильной кислотой, такой как трифторуксусная кислота. При этом тиазолиновое производное N-концевой аминокислоты отщепляется, в то время как остальные пептидные связи не подвергаются гидролизу. Тем самым разрушение по Эдману заключается в отщеплении остатка только N-концевой аминокислоты и сохранении оставшейся части полипептидной цепи.
Тиазолиновое производное аминокислоты избирательно экстрагируют органическим растворителем и превращают в более стабильное фенилтиогидантоиновое производное. Последнее можно идентифицировать сравнением с известными стандартами при проведении тонкослойной хроматографии, электрофореза, высокоэффективной жидкостной хроматографии или газо-жидкостной хроматографии. Наиболее важным преимуществом расщепления по Эдману по сравнению с другими методами определения N-концевой аминокислоты является то, что, проводя повторно с одним и тем же пептидом эту процедуру, каждый раз можно идентифицировать новую N-концевую фенилгидантоин-аминокислоту, выясняя таким образом аминокислотную последовательность.
· Идентификация С-концевой аминокислоты.
Один из подходов заключается в использовании ферментов - карбоксипептидаз (катализирует отщепление от пептида С-концевой аминокислоты). Карбоксипептидазы, подобно другим ферментам, обладают субстратной специфичностью, то есть они катализируют отщепление определенных аминокислот. Вместе с тем, наличие рядом с С-концевой аминокислотой остатка Про делает невозможной её отщепление под влиянием карбоксипептидазы. В этом случае наиболее надежным считается метод гидразинолиза. Полипептид обрабатывают безводным гидразином при температуре 900С в течение 20-100ч в присутствии ионообменного сорбента (в качестве катализатора). При этом разрушаются все пептидные связи, а из высвобождающихся аминокислот образуются гидразиды. Но С-концевая аминокислота высвобождается как свободная и поэтому её можно идентифицировать хроматографически.
· Определение аминокислотной последовательности.
Установление концевых аминокислот в исследуемом пептиде позволяет в дальнейшем определить всю его аминокислотную последовательность. Для этого обычно проводят повторное разрушение по Эдману в автоматическом приборе - секвенаторе, который был предложен П. Эдманом и Г. Бэгом. Современный такой прибор определяет 1 аминокислотный остаток в час. Таким способом можно установить последовательность расположения 40-60 остатков аминокислот. Затем накапливаются незавершенные реакции, продукты побочных реакций. Наряду с потерей самого пептида они делают малоинформативной и ненадежной дальнейшую идентификацию аминокислот. Чтобы установить последовательность их расположения в больших полипептидных молекулах, их подвергают расщеплению ферментативным или химическим путем на фрагменты с размерами, достаточными для проведения секвенирования (рис.1.19).
· Исследование последовательности нуклеотидов ДНК - рутинная операция в молекулярной биологии.
Этот метод в последнее время вытеснил другие методы исследования первичной структуры белков. Зная последовательность нуклеотидов, можно легко установить последовательность аминокислот
Метод пептидных карт. Процесс определения аминокислотной последовательности в белке - процедура достаточно длительная. Её можно существенно ускорить в случае выяснения аминокислотной последовательности гомологичного белка, если у сравниваемого белка она уже известна. Метод носит название "метод пептидных карт" или "метод отпечатков пальцев". Он включает в себя сочетание хроматографии и электрофореза на бумаге продуктов неполного гидролиза сравниваемых белков. При этом пептидные фрагменты, отличающиеся аминокислотной последовательностью, будут обладать разной подвижностью по сравнению с таковыми у исходного белка.
ü Вторичная структура
 Вторичной структурой белка называют пространственную структуру, образующуюся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: -спирали -структура.
Вторичной структурой белка называют пространственную структуру, образующуюся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: -спирали -структура.
Под -спиралью понимают структуру, в которой пептидный остов закручивается в виде спирали за счёт образрвания водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка.
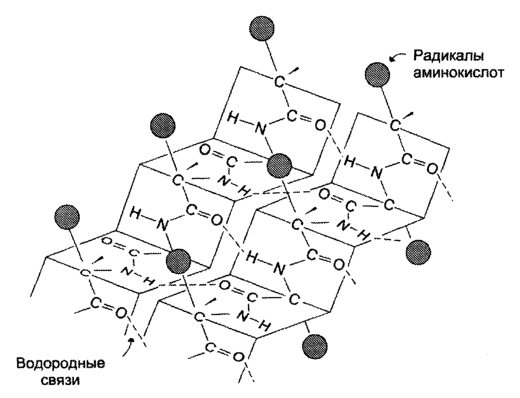
Под -структурой понимают фигуру, подобную листу, сложенному «гармошкой». Фигура формируется за счет образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными группами.
В отличие от -спиралей, разрыв водородных связей, формирующих -структуры, не вызывает удлинения данных участков полипептидных цепей.
Как -спираль так и -структуры обнаружены в глобулярных и фибриллярных белках.
ü Третичная структура
Третичная структура белка представляет собой трехмерную пространственную структуру, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи .
 Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль
Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль
ü Четвертичная структура белка
Четвертичной структурой называют взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса
 Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
4.Заключение
Белки по праву можно назвать основой жизни всех организмов. Так как без них нормальное функционирование любого организма невозможно. Все многочисленные функции организма напрямую зависят от них.
Без белков или их составных частей – аминокислот – не может быть обеспечено воспроизводство основных структурных элементов органов и тканей, а также образование ряда важнейших веществ, как, например, ферментов и гормонов.
Белки – основная и необходимая часть всех организмов. Белки осуществляют обмен веществ и энергетические превращения, они неразрывно связаны с активными биологическими функциями. Если исключить из рациона питания белковую пищу, то организм начнет слабеть, и при длительном отсутствии белковой пищи погибнет.
Фридрих Энгельс дал следующее определение жизни : «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка.»
5. Список литературы
1. Северин Е.С. Биохимия // М.:ГЭОТАР – МЕД , 2004. – 784 с.
2. http://xumuk.ru
3. Потапов В.М. Органическая Химия // М.: Просвещение, 1976. – 376 с.
4. http://www.km.ru/referats/332549-belki-–-osnova-zhizni
Для заметок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________