Исходный уровень знаний и навыков
Предисловие
Данное пособие состоит из двух частей, соответствует программе по биохимии для студентов высших медицинских учебных заведений, утвержденной Минздравом Республики Беларусь, и предназначено для студентов 2-го курса, изучающих биохимию.
Весь курс предусматривает 36 занятий, из них 23 занятия помещены в первой части пособия и 13 – во второй.
Теоретическая частьвключает перечень учебных вопросов, рассматриваемых по данной теме, которые должен знать студент.
В практической частиприведены ситуационные задачи и лабораторные работы. Подробное описание лабораторных работ включает такие важные для понимания и усвоения методов биохимических исследований элементы, как принцип метода, ход работы, в ряде случаев меры предосторожности, необходимые для выполнения работы, клинико-диагностическое значение данной работы, которое завершается выводами, основанными на полученных результатах.
В первой части пособия описаны темы практических занятий, касающихся общих вопросов биохимии, в частности, таких разделов, как введение в биохимию, современные методы биохимических исследований, строение и функции белков, энзимология, биоэнергетика, биохимия углеводов, липидов, белков и нуклеиновых кислот.
Во второй частирассматриваются темы, непосредственно касающиеся проблем клинической биохимии: биохимия гормонов и витаминов, а также отдельных органов, тканей и систем организма, биохимия крови, почек, печени, нервной, мышечной системы, миокарда и соединительной ткани.
В конце каждого раздела имеется перечень вопросов для контроля и самоконтроля, что поможет студенту в закреплении знаний по конкретной изучаемой теме и подготовке к сдаче контрольных занятий и экзаменов.
Раздел "Биохимия липидов" написан совместно с доцентом кафедры биохимии ГГМИ, канд. биол. наук В. Т. Свергун
Автор выражает признательность аспиранту кафедры биохимии А. Н.Ковалю, а также всем, кто помогал в подготовке рукописи к изданию.
1 Введение в биохимию
Занятие 1
Введение в биохимию. Современные методы исследования. Строение и функции белков
Цель занятия: сформировать представление о биохимии как фундаментальной медико-биологической науке. Изучить структуру и физико-химические свойства белков. Научиться определять содержание общего белка в плазме крови биуретовым методом.
Исходный уровень знаний и навыков
Студент должен знать:
1 Основные правила техники безопасности при работе в химической лаборатории.
2 Строение и классификацию альфа-аминокислот.
3 Кислотно-основные свойства аминокислот. Реакции на их функциональные группы.
4 Уровни структурной организации белка.
5 Особенности строения пептидной связи.
6 Качественные реакции на белки и пептиды.
7 Комплексные соединения (комплекс меди в биуретовой реакции).
Студент должен уметь:
1 Проводить качественные реакции на белки и пептиды.
Структура занятия
Теоретическая часть
1.1 Введение в биохимию. Краткая история биохимии. История отечественной биохимии. Общая характеристика обмена веществ. Понятие об анаболизме, катаболизме и метаболизме. Значение биохимии для врача.
1.2 Характеристика основных биохимических методов, используемых в эксперименте и клинике:
а) на уровне целого организма:
· наблюдение за организмом:
- при удалении органа;
- изменении диеты (голодание или усиленное питание);
- приеме лекарств;
- введении специфических ядов и токсинов;
· наблюдения за человеком и животными со специфическими заболеваниями;
· использование ЯМР-спектроскопии и др.;
б) перфузия изолированного органа;
в) использование тканевых срезов;
г) использование целых клеток;
д) использование гомогенатов;
е) выделение изолированных клеточных органелл;
ж) метод субфракционирования клеточных органелл;
з) выделение метаболитов и ферментов;
и) клонирование генов, кодирующих ферменты и другие белки.
1.3 Белки – важнейшие компоненты организма. Функции белков, строение, классификация и свойства аминокислот. Обзор уровней структурной организации белковой молекулы. Молекулярная масса белков. Форма и размеры белковой молекулы.
Практическая часть
2.1 Особенности работы в биохимической лаборатории.
2.2 Инструктаж по технике безопасности.
2.3 Применение Международной системы единиц (СИ) в международной лабораторной практике.
2.4 Решение задач.
2.5 Лабораторные работы.
2.6 Проведение контроля конечного уровня знаний.
Задачи
1 Рассмотрите указанные группы аминокислот и отметьте, какие из них являются гидрофобными: а) тир, асп, глу; б) ала, лиз, сер; в) иле, лей, лиз; г) вал, лей, ала; д) арг, гли, цис?
2 Многие белки, содержащие 2 и более доменов, обнаруживают гомологию аминокислот. Эти белки образуются путем: а) посттрансляционной модификации (процессинга); б) генетических изменений; в) дупликации генов и их слияния; г) аллостерической кооперации; д) транспептидных образований.
3 Остатки каких аминокислот в белках-гликопротеидах ковалентно связывают углеводы? Напишите пентапептид с этими аминокислотами (-ала-X-трп-Y-гли), где X и Y – названные аминокислоты.
4 Остатки каких аминокислот в белках-гистонах обладают положительным зарядом? Напишите пентапептид с этими аминокислотами (-ала-X-мет-Y-гли), где X и Y ‑ названные аминокислоты.
5 Из приведенных обозначений аминокислот
Асп-Асн-Глн-Сер-Глу-Вал-Тир-Лиз-Гис-Гли-Ала
а б в г д е ж з и к л
выберите и напишите формулы тех из них, которые:
а) могут образовывать водородные связи; б) могут участвовать в гидрофобных взаимодействиях; в) остальные.
Лабораторные работы
Лабораторные работы 1 и 2 выполняются по соответствующим инструкциям.
Лаборатоpная работа № 3. Количественное определение общего белка в сыворотке крови биуретовым методом (УИРС)
ВНИМАНИЕ! Соблюдать меры безопасности при работе с гидроксидом натрия.
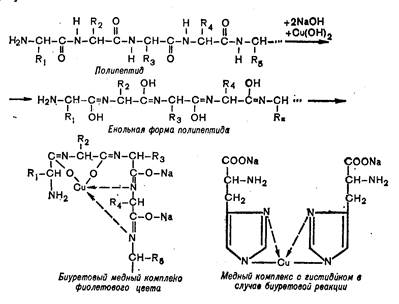
Принцип метода. В щелочной среде пептидные связи белка образуют с ионами двухвалентной меди комплекс фиолетового цвета. Интенсивность окраски раствора прямо пропорциональна концентрации белка, определяемой фотометрически.
Ход работы. В пробирку наливают 0,05 мл сыворотки крови, затем добавляют 2,5 мл биуретового реактива. Содержимое пробирки осторожно перемешивают, избегая пенообразования, и через 30 мин фотометрируют в кюветах 5 мм при 540 нм (зеленый светофильтр) против контрольного раствора (дистиллированная вода). Измерив экстинкцию исследуемого раствора, по калибровочной кривой определяют концентрацию белка.
Клинико-диагностическое значение. Нормальное содержание белка в сыворотке крови у взрослых людей – 65–85 г/л, у детей – 58–85 г/л.
Повышенное содержание белка в сыворотке крови (гиперпротеинемия) встречается редко. Это наблюдается при ревматизме, миеломной болезни. Кратковременная относительная гиперпротеинемия отмечается при сгущении крови из-за значительных потерь жидкости, например, при усиленном потоотделении, неукротимой рвоте, профузных поносах, несахарном диабете, холере, тяжелых ожогах.
Снижение уровня белка в крови (гипопротеинемия) наблюдается при нефритах, злокачественных опухолях, длительном голодании и др.
Выводы. Записать полученный результат и дать его клинико-диагностическую оценку.
Рекомендуемая литература
Основная
1 Материал лекций.
2 Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 16–64; 1998. С. 19–77.
3 Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 5–53.
Дополнительная
4 Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 13–50.
5 Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 13–92.
6 Ленинджер А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 107–225.
7 Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия. М.: Медицина, 1991. С. 313–376.
8 Албертс Б. и др. Молекулярная биология клетки, М.: Мир, 1994. Т. 1. С. 113–171.
2 Энзимология и биологическое окисление
Занятие 2
Строение и функции белков.
Строение и свойства ферментов
Цель занятия: закрепить знания по структуре белков, сформировать представления о строении и свойствах ферментов. Научиться выполнять качественные реакции на активность некоторых гидролитических ферментов.
Исходный уровень знаний и навыков
Студент должен знать:
1 Характеристику уровней структурной организации белковой молекулы (первичная, вторичная, третичная, четвертичная структуры).
2 Жизненно незаменимые микроэлементы.
3 Витамины B1, B2, B3, B6, PP.
4 Строение коферментов NAD+, NADP+.
5 Понятия: коагуляция, порог коагуляции, коллоидная защита.
Студент должен уметь:
1 Проводить качественные реакции на белки и пептиды.
Структура занятия
Теоретическая часть
1.1 Понятие о ферментах. История энзимологии. Особенности ферментативного катализа. Строение ферментов. Доказательства белковой природы ферментов.
1.2 Характеристика уровней структурной организации белковой молекулы (первичная, вторичная, третичная, четвертичная структуры) и связей, удерживающих ее. Высаливание, денатурация, причины, механизм и признаки.
1.3 Кофакторы ферментов: ионы металлов и коферменты. Участие витаминов в построении коферментов.
1.4 Структурно-функциональная организация ферментов: активный (субстратный) центр, каталитический, аллостерический участки.
Практическая часть
2.1 Решение задач.
2.2 Лабораторные работы.
2.3 Проведение контроля конечного уровня знаний.
Задачи
1 Напишите формулу пептида Глу-Тир-Про-Гис-Сер. Какие из перечисленных цветных реакций будут положительными с данным пептидом: а) биуретовая, б) Фоля, в) ксантопротеиновая, г) Милона?
2 О чем свидетельствуют цветные реакции на белки:
а) о наличии белка в биологической жидкости;
б) о первичной структуре белка;
в) о конформации белка;
г) о наличии некоторых аминокислот в структуре белка;
д) о функции белка;
е) о наличии числа уровней структурной организации?
3 Причиной различий в кривых насыщения кислородом между Hb и миоглобином является:
а) количество кислорода, переносимое этими гемопротеидами;
б) заметные различия структур;
в) конформационные переходы субъединиц;
г) различиями pH окружающей среды;
д) различное значение pCO2 крови и ткани?
4 Зимогены превращаются в ферменты путем реакций: а) аденилирования; б) фосфорилирования; в) метилирования; г) ограниченного протеолиза?
5 Примером ковалентных сшивок белков рубцовой ткани являются: а) десмозин; б) лизил-альдольная связь; в) солевые мостики; г) водородные связи; д) дисульфидные связи?
6 Активный центр фермента:
а) содержит каталитические и вспомогательные аминокислоты;
б) создает благоприятное окружение для взаимодействия фермента и субстрата;
в) является основным в формировании свойств третичной структуры фермента;
г) может содержать дополнительные сайты небелкового строения, необходимые для каталитического действия;
д) обязательно содержит SH-группы?
Лабораторные работы
Лабораторная работа № 1. Цветные реакции на белки
и аминокислоты
Биуретовая реакция.
Принцип метода. В щелочной среде пептидные связи белка образуют с ионами двухвалентной меди комплекс фиолетового цвета (см. уравнение).
 |
ВНИМАНИЕ! Соблюдать меры безопасности при работе с гидроксидом натрия.
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 5 капель 10 %-го раствора гидроксида натрия и по 1 капле 1 %-го раствора медного купороса. Во всех пробирках наблюдают устойчивое сине-фиолетовое окрашивание.
Выводы по результатам работы.
Нингидриновая реакция.
Принцип метода. Основан на образовании димера нингидрина и азота аминогруппы сине-фиолетового цвета (комплекс Руэмана ‑ см. уравнение).
Ход работы. К 5 каплям раствора белка прибавить 5 капель раствора нингидрина и прокипятить 1–2 мин. Появляется сине-фиолетовое окрашивание.
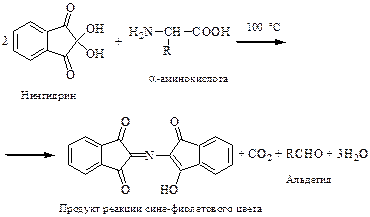 |
Выводы по результатам работы.
Ксантопротеиновая реакция (Мульдера).
Принцип метода. Основан на образовании нитросоединений ароматических и гетероциклических аминокислот, окрашенных в ярко-желтый цвет (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с концентрированной азотной кислотой.
 |
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 3 капли концентрированной азотной кислоты и осторожно кипятят. В первой пробирке образуется осадок желтого цвета, а во второй – слабое окрашивание, т. к. желатин не содержит циклических аминокислот. В 3‑й пробирке образуется осадок белого цвета, переходящий в желтый цвет. Пробирки охлаждают и добавляют в каждую по 10–15 капель 20 %-го едкого натра до изменения окраски растворов вследствие образования натриевой соли динитротирозина.
Выводы по результатам работы.
Реакция на тирозин (Миллона).
Принцип метода. Основан на образовании осадка ртутной соли динитротирозина кроваво-красного цвета (см. уравнение).
 |
ВНИМАНИЕ! Соблюдать меры безопасности при работе с реактивом Миллона (содержит Hg и HNO3).
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 3 капли реактива Миллона (раствор ртути в азотной кислоте) и осторожно нагревают. Отмечают изменение цвета в пробирках, характеризующее наличие в указанных белках тирозина.
Выводы по результатам работы.
Реакция Фоля (на аминокислоты, содержащие слабосвязанную серу).
Принцип метода. Основан на щелочном гидролизе сульфгидрильных групп SH белка с последующим отщеплении серы в виде сульфида свинца (PbS) черно-бурого цвета (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с реактивом Фоля (содержит NaOH и Na2PbO2).
 |
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 5 капель реактива Фоля. Затем интенсивно кипятят и дают постоять 1–2 мин. При этом в 1-й и в 3-й пробирках образуется черный или бурый осадок сульфида свинца. Желатин осадка не образует, т. к. в нем нет серосодержащих аминокислот.
Выводы по результатам работы.
Лабораторная работа № 2.Реакции осаждения белков
Принцип метода. Основан на денатурации и осаждении белков различными факторами.
Осаждение белков при кипячении.
ВНИМАНИЕ! Соблюдать меры безопасности при работе с нагреванием пробирок.
Ход работы. В 5 пробирок наливают по 5 капель раствора белка. Первую пробирку нагреть до кипения. Жидкость мутнеет, т. к. разрушаются водные оболочки вокруг молекулы белка, и происходит укрупнение его частиц. Мицеллы белка несут заряд и удерживаются во взвешенном состоянии.
Во 2-й пробирке нагреть раствор до кипения и добавить 2 капли 1 %-го раствора уксусной кислоты до слабого подкисления. При отстаивании выпадает осадок белка. Частицы белка теряют заряд и приближаются к изоэлектрическому состоянию.
В 3-ю пробирку добавить 5 капель уксусной кислоты для сильнокислой реакции среды. При кипячении жидкости осадка не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость.
В 4-ю пробирку налить 5 капель раствора уксусной кислоты, 2 капли насыщенного раствора хлористого натрия и нагреть. Выпадает белый хлопьевидный осадок, т. е. частицы белка теряют заряд.
В 5-ю пробирку добавить 2 капли раствора гидроксида натрия. При кипячении осадок не образуется, т. к. в щелочной среде отрицательный заряд на частицах белка увеличивается.
Выводы по результатам работы.
Осаждение белков концентрированными минеральными кислотами.
ВНИМАНИЕ! Соблюдать меры безопасности при работе с концентрированными азотной и серной кислотами.
Ход работы. В 2 пробирки наливают по 10 капель концентрированных кислот: азотной и серной. Наклонив пробирки под углом 45 градусов, осторожно по стенке пробирки приливают равный объем раствора белка так, чтобы обе жидкости не смешивались. На границе двух жидкостей образуется осадок в виде небольшого белого кольца. При добавлении избытка азотной кислоты осадок не исчезает, а при добавлении серной кислоты осадок растворяется.
Выводы по результатам работы.
Осаждение белков органическими растворителями.
Ход работы. В 2 пробирки вносят по 5 капель раствора белка и прибавляют по 15–20 капель этилового спирта и ацетона.
Выводы по результатам работы.
Осаждение белков органическими кислотами.
ВНИМАНИЕ! Соблюдать меры безопасности при работе с трихлоруксусной кислотой.
Ход работы. В две пробирки наливают по 5 капель раствора белка и добавляют по 2 капли раствора ТХУ (трихлоруксусной кислоты) в одну и 2 капли сульфосалициловой – в другую. Следят за изменением растворов.
Выводы по результатам работы.
Лабораторная работа № 3.Разделение альбуминов и глобулинов методом высаливания (УИРС)
Принцип метода. Основан на обратимой реакции осаждения белков из растворов с помощью высоких концентраций нейтральных солей (NaCl, NH4Cl, MgSO4 и др.).
Ход работы. К 1 мл неразведенного яичного белка добавляют 1 мл насыщенного раствора сульфата аммония и перемешивают. Получается полунасыщенный раствор сульфата аммония, в котором выпадает осадок яичного глобулина. Через 5 мин осадок отфильтровывают, в фильтрате остается яичный альбумин. Для высаливания альбуминов к фильтрату добавляют порошок сульфата аммония до полного насыщения, т. е. пока новая порция порошка остается нерастворенной. Выпавший осадок альбумина отфильтровывают. С фильтратом проделывают биуретовую реакцию. Отрицательная реакция указывает на отсутствие белка.
Выводы по результатам работы.
Рекомендуемая литература
Основная
1 Материал лекций.
2 Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 92–102; 1998. С. 114–143.
3 Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 5–92.
Дополнительная
4 Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
5 Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 93–99.
6 Ленинджер А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 226–302.
7 Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия, М.: Медицина, 1991. С. 313–376.
8 Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 113–171.
Занятие 3
Механизм действия ферментов
Цель занятия: закрепить знания по структуре ферментов, сформировать представления о механизме действия ферментов.