Зависимость скорости реакции от рН
 На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
Влияние рН.
Ферменты, как и все белки содержат много зараженных положительно и отрицательно групп (-NH2 ,-COOH), которые входят в состав аминокислот арг, лиз, асп, глу. Общий заряд зависит от соотношения между этими группами. Заряд белка-фермента изменяется в зависимости от концентрации в клетке ионов водорода, которые нейтрализуют (подавляют диссоциацию) карбоксильной группы:

и образуют положительно заряженные группы: 
Таким образом увеличение положительного заряда или уменьшение отрицательного заряда на поверхности фермента обусловлено повышением концентрации ионов водорода.
Состояние белковой молекулы, при котором суммарный заряд белка равен 0, называется изоэлектрическим состоянием.
Значение рН, при котором заряд белковой молекулы равен 0, называется изоэлектрической точкой (ИЭТ).
Большинство ферментов отличаются наибольшей активностью и стабильностью в области изоэлектрической точки.
Резкие колебания рН способствуют денатурации белка, т.е. уменьшению ферментативной активности.
Значение рН, при котором фермент проявляет максимальную активность, называется оптимумом рН, который характерен для данного фермента, реагирующего с определенным субстратом.
Внутриклеточные ферменты обычно имеют оптимум рН соответствующий нейтральной среде (рН =7) близкой к нормальному значению рН для жидкостей организма. Есть ферменты оптимум рН которых находится в сильнокислой и сильнощелочной среде

Классификация ферментов.
Выделяют шесть классов ферментов:
1. Гидролазы – ферменты, расщепляющие субстрат при участии молекул воды.
2. Лиазы – ферменты, расщепляющие молекулы субстрата без участия воды, при этом часто образуются низкомолекулярные продукты – СО2, NH3, Н2О.
3. Изомеразы – ферменты, вызывающие в молекуле изомерные превращения.
4. Феразы (трансферазы) – ферменты, переносящие группы от одной молекулы на другую или из одного положения в другое в пределах одной молекулы.
5. Оксидоредуктазы - ферменты, катализирующие перенос протонов и электронов (т.е.окислительно-восстановительные реакции).
6. Лигазы(синтетазы) – ферменты, катализирующие синтез крупных молекул из более мелких.
Номенклатура ферментов.
Рабочее название фермента складывается из названия субстрата, типа катализируемой реакции и окончания –аза.
Систематическое название складывается из названия субстратов, названия типа катализируемого химического превращения и окончания –аза.

Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы – уточняет действие фермента, так как указывает на природу химической группы субстрата, атакуемой ферментом. Подкласс делится на подподклассы. Подподклассы конкретизируют действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
I. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Оксидоредуктазы называют также дегидрогеназами или редуктазами. Оксидоредуктазы переносят протоны и электроны. Оксидоредуктазы делят на подклассы:
1. Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
Коферментами оксидоредуктаз являются:
НАД – никотинамидадениндинуклеотид – содержит витамин В5 – никотинамид.
НАДФ – никотинамидадениндинуклеотид фосфат, содержит витамин В5.
ФАД – флавинадениндинуклеотид, содержит витамин В2 – рибофлавин.
ФМН – флавинмононуклеотид, содержит витамин В2 – рибофлавин.
Оксидоредуктазы катализируют реакции дегидрирования, т.е. отщепление водорода.
Оксидоредуктазы окисляют следующие функциональные группы:
-ОН, -С=О, -NH2
|
Н
Коферменты дегидрогеназ присоединяют протоны и электроны.
НАД-зависимые дегидрогенизы окисляют следующие функциональные группы: спиртовый гидроксил (ОН), альдегидную группу (СОН), аминогруппу (NH2).
НАД-зависимые дегидрогеназы катализируют следующие типы реакций:
1. Дегидрирование гидроксильных групп
СН3 СООН
| лактатдегидрогеназа |

 HC-O С=О
HC-O С=О
| |
COOH НАД+ НАДН +Н+ СН3
Лактат пируват
Молочная кислота
2. Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 – фосфата)
СН3 СООН
| + НАД+ + Н3РО4  | + НАДН + Н+
| + НАДН + Н+
HC-OH НC-OН
| |
CH2OPO3H2 CH2OPO3H2
Глицеральдегид-3-фосфат 1,3-бифосфоглицериновая кислота
3. Дегидрирование аминогрупп
СООН СООН
| |
СН2 +НАД СН2
 | | + НАДН + Н+
| | + НАДН + Н+
СН2 глутаматдегидрогеназа СН2
| |
СНNH2 С=О
| |
COOH СООН
Глутаминовая кислота 
ФАД – зависимые дегидрогеназы окисляют (дегидрируют) следующие функциональные группы: отщепление водорода от групп –СН2- СН2- с образованием двойной связи.
Пример:
СООН СООН
| ФАД ФАДН2 |
 СН2 СН
СН2 СН
 | ||
| ||
СН2 сукцинатдегидрогеназа СН
| |
СООН СООН
Сукцинат фумарат
2. Анаэробные дегидрогеназы переносят протоны и электроны не на кислород, а на какой-то другой субстрат. Эти ферменты называют также оксигеназами.
II. Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому.
Подклассы трансфераз:
1. Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту. Катализируют реакцию трансаминирования.
2. Метилтрансферазы катализируют перенос метильных групп (СН3-).
3. Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. В подкласс фосфотрансфераз входят киназы, которые используют АТФ в качестве донора фосфатного остатка.
III. Лиазы – ферменты, катализирующие разрыв С-О, С-С, С-N и других связей, а также обратимые реакции отщепления различных групп, без участия воды.
1. Карбоксилазы – присоединение карбоксильной группы (СО2).
2. Дегидратазы – отнятие молекулы воды от субстрата.
3. Альдолазы – расщепляют связь С-С.
4. Гидратазы – ферменты воды по двойной связи.
IV. Изомеразы – ферменты, катализирующие превращение в пределах одной молекулы.
Катализируют реакции изомеризации. Подклассы: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы.
V. Гидралазы – ферменты, катализирующие разрыв связей в присутствии воды.
VI. Лигазы (синтетазы) – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи АТФ.
Влияние низкомолекулярных веществ на активность фенрментов.
Ингибиторы.
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
1. Активаторы – ускоряющие протекание ферментативной реакции.
2. Ингибиторы – замедляют протекание ферментативных реакций.
Активаторы делят на 2 группы:
1. В качестве активатора могут выступать коферменты или простетическая группа (в основном витамины).
Для этой группы характерны те же закономерности, что описаны для взаимодействия фермента и субстрата F+S и A+Ko подчиняются одним закономерностям 

Km определяет сколько вводить Ko.
2. Активаторы, являющиеся связующим звеном между F и S (ориентирование фермента и субстрата) и обеспечивающим взаимодействие фермента и субстрата (F A S), взаимодействие апофермента и кофактора Апоф А Ко
Часто это ионы Ме – Со, Mn, Mg, Zn.
Значение ингибирования активности ферментов.
1. Ингибирование лежит в основе действия лекарственных веществ и токсических агентов.
2. Ингибирование – один из подходов к изучению ферментативного действия (например, структуры активного центра).
Ингибирование бывает 2-х видов:
1. Необратимое
2. Обратимое
Необратимое ингибирование имеет место тогда, когда присоединение ингибитора к ферменту носит необратимый характер.
 Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
F-S-H + J-CH2CONH2  F-S-CH2-CONH2 + HJ
F-S-CH2-CONH2 + HJ
Необратимым является действие токсических фосфоорганических соединений, которые называют нервно-паралитическими ядами, они ингибируют ацетилхолинэстеразу, участвующую в передаче нервных импульсов.
Необратимое ингибирование
Многие ингибиторы необратимо связываются с Е или ES, и, поскольку это влияет на Vmax, такое ингибирование относят к неконкурентному.
Ингибиторы этого типа часто ковалентно связываются с ферментом или с комплексом фермент-субстрат, необратимо изменяя нативную конфигурацию. Это объясняет токсическое действие Hg2+, Pb2+ и соединений мышьяка.
На необратимом ингибировании основано действие пенициллина. Пенициллин ингибирует действие одного из ферментов, участвующих в сборке клеточной стенки бактерий. Клетки, не имеющие клеточной стенки, легко лизируются.
Действие аспирина основано на ковалентной модификации фермента. Аспирин снижает скорость синтеза простагландинов, выступая в роли ингибитора циклооксигеназного компонента эндопероксид-синтетазы. Считается, что возникновение болей, воспалений, температуры связано с простагландинами.
При интоксикации связывание яда или его вытеснение из комплекса фермент-ингибитор возможно с помощью реактиваторов, или противоядий. К ним относятся все SH – содержащие комплексоны (цистеин, димеркаптопропанол), лимонная кислота.
Обратимое ингибирование бывает 2-х видов:
1. Конкурентное
2. Неконкурентное
Обратимое конкурентное ингибирование – активность фермента восстанавливается после удаления ингибитора путем увеличения концентрации субстрата.
Отличительный признак конкурентного ингибитора – конкурентный ингибитор по структуре близок субстрату. Конкурентный ингибитор конкурирует с субстратом за активный центр фермента.
Пример: сукцинатдегидрогеназа катализирует превращение сукцината в фумарат. Конкурентным ингибитором сукцинатдегидрогеназы является малоновая кислота, которая содержит на одну группу СН2 меньше, чем сукцинат.
СООН СООН COOH
| СДГ | |
 СН2
СН2  СН CH2
СН CH2
 | || |
| || |
СН2 СН COOH
| | малоновая кислота
СООН СООН
Сукцинат и малоновая кислота являются структурными аналогами и конкурируют за активный центр фермента. (Это является подтверждением тому, что активный центр не является жестким образованием, подходящим субстрату, как «ключ-замок».)
При конкурентном ингибировании степень ингибирования фермента не зависит от абсолютной концентрации ингибитора, а от соотношения ингибитора и субстрата, если это соотношение J:S=1:50, то активность фермента ингибируется на 50%.
Действие конкурентного ингибитора снимается повышением концентрации субстрата, так как сродство фермента и субстрата выше, чем сродство фермента и ингибитора.
Кm F и S и Km F и J различны и это узнают путем построения графиков Михаэлиса-Ментен и Лайнуэвера-Бэрка


Vmax – одинакова
Km с ингибитором увеличивается.
Действие многих химиотерапевтических средств основано на конкурентном ингибировании. Например, сулфаниламидные препараты, используемые для лечения болезней, вызываемых микробными инфекциями. Сульфаниламидные препараты по структуре сходны с п-аминобензойной кислотой. ПАБК является предшественником в микробиологическом синтезе фолиевой кислоты, из которой кофермент, необходимый для синтеза нуклииновых кислот микроорганизмов. При введении сульфаниламидных препаратов наблюдается угнетение фермента и гибель микроорганизмов.
На конкурентном ингибировании основано применение и фторурацила, который используется при лечения рака.
Неконкурентное, обратимое ингибирование.
Действие неконкурентного ингибитора не может быть устранено увеличением концентрации субстрата.
Неконкурентный ингибитор не связывается с активным центром, он может связываться со свободным ферментом  , либо с комплексом FS
, либо с комплексом FS  , либо с тем и другим, но обе формы JF и JFS – не активны.
, либо с тем и другим, но обе формы JF и JFS – не активны.


Km- не изменяется, т.к. нет связывания с активным центром.
Vmax – уменьшается.
Наиболее общий тип неконкурентного ингибирования имеет место при действии реагентов, обратимо связывающих SH-группы цис, входящего в каталитический центр или близко от него. Это ионы Cu2+, Hg2+, Ag+ и их производные с образованием меркаптидов:

Ферменты, для активации которых необходимы ионы Ме ингибируются по такому способу агентами связывающими эти ионы:
 ферро или ферроцианид.
ферро или ферроцианид.
Регуляция активности ферментов.
Использование ферментов в фармации, медицине.
Виды регуляции активности ферментов:
1. Аллостерическая модификация.
2. Активация зимогенов.
3. Регуляция путем химической модификации.
Аллостерическая модификация.
 Этот вид активации характерен для ключевых обменных процессов:
Этот вид активации характерен для ключевых обменных процессов:


Ключевой фермент начинает (открывает) процесс.
Ферменты, от активности которых зависит скорость процесса, называются регуляторными или аллостерическими.
Особенности аллостерических ферментов.
1. Регуляторные ферменты – это олиго или мультиферменты.
2. Регуляторные ферменты имеют аллостерический центр или центры, которые формируются за счет 2 или нескольких протомеров.
3. Для регуляторных ферментов характерен сигмоидный характер зависимости скорости реакции от концентрации субстрата.
S-образная форма кривой объясняется по-видимому тем, что регуляторный фермент состоит не из одной полипептидной цепи, а из нескольких. Каждый протомер обладает свойством связывать субстрат (есть субстратные и каталитические центры на каждом протомере) с образованием F-S-комплекса. Активные центры конкурируют между собой за субстрат до тех пор пока не произойдет полного насыщения всех активных центров, после этого скорость реакции быстро достгает максимума.
 I.- простой фермент
I.- простой фермент
II – регуляторный фермент.
Вещества, связывающиеся с активны центром и изменяющие структуру белковой молекулы фермента, а следовательно и пространственную ориентацию функциональных групп аминокислот, составляющих субстратный и каталитический центры называют модификаторами.
Модификаторы бывают двух видов:
1. Положительные модификаторы (+) – после присоединения активность ферментов повышается.
2. Отрицательные модификаторы(-) после взаимодействия с ферментом снижают его активность.
Модификаторы обычно низкомолекулярные вещества. Это субстраты конечные продукты реакции.
Различают три вида регуляторных ферментов:
1. Гомотропные – для этого класса ферментов субстрат является положительным модулятором или регуляция по принципу прямой положительной связи.
2. Гетеротропные – активируются другими модификаторами, ингибируются конечным продуктом или регуляция по принципу обратной отрицательной связи.
3. Гомогетеротропные – для этих ферментов характерно смешанное регулирование и субстратом и другими соединениями.
Активация зимогенов.
Многие пищеварительные ферменты синтезируются в неактивной форме – в виде зимогенов (пепсиноген, трипсиноген и др.).
Эти неактивные зимогены активируются после попадания в ЖКТ, благодаря этому не происходит переваривания клеток, где происходит синтез ферментов. Зимогены не активны, так как содержат дополнительные участки или группы, которые препятствуют доступу субстрата к активному центру. Удаление этой блокирующей группы протеолитическими ферментами приводит к необратимой активации зимогена.
Трипсиноген 

Эндопептидаза расщепляет пептидную связь между лиз в положении 6 и лей в положении 7, в результате отщепляется пептид и образуется активный трипсин.
Схема активации зимогена:

По такой схеме происходит активация целого ряда зимогенов:
1. Пищеварительные ферменты
2. Ферменты свертывания крови
3. Белковые гормоны
4. Кининовая система, компонент
5. Фибриллярный белок проколлоген  коллоген.
коллоген.
Основная черта активации зимогенов заключается в каскадном (последовательном) включении зимогенов с образованием активных ферментов например 12-перстной кишки.
Регуляция путем химической модификации.
По существу это изменение химической структуры активного центра. В некоторых случаях фермент может существовать в клетке в неактивной форме или слабоактивном состоянии, но присоединение фосфатной группы при участии фосфорилирующего фермента, называемого киназой, к аминокислоте вблизи от активного центра, активирует фермент. Такая система может быть возвращена в исходное состояние под действием фермента, отщепляющего фосфатную группу.
Киназа Ф
 F (актив)
F (актив)
 F(неакт) Ф
F(неакт) Ф
Фосфотаза – Ф
Такой механизм очень важен, т.к. активность киназы и фосфатазы могут изменяться под действием гормонов.
Уровни организации ферментов в клетке.
Большинство ферментов в клетке имеют сложное строение, т.е. это мультиферменты.
По сложности молекулярная организация мультиферменые системы, осуществляющие последовательные реакции можно разделить на 3 уровня.
I уровень организации
В простейших мультиферментных системах отдельные ферменты растворены в цитозоле и работают независимо друг от друга; предполагается, что во время своего действия они физически друг с другом не связаны. Небольшие молекулы субстрата, характеризующиеся высокой скоростью диффузии, очень быстро находят дорогу от одного фермента к другому:

II уровень организации
Отдельные ферменты, относящиеся к этим системам, могут ассоциировать друг с другом в форме ферментных комплексов.
Например: синтетаза жирных кислот, представляющая систему из семи разных ферментов, молекулы которых объединены в тесно связанный комплекс, который с трудом распадается на отдельные ферменты, причем после диссоциации все они оказываются неактивными (биологически выгодно – сокращается скорость образования конечного продукта).
III уровень организации
Это наиболее высокоорганизованные ферментные системы, связанные с крупными надмолекулярными структурами (мембраны, рибосомы).
Цепь дыхательных ферментов, прикрепленных к мембране митохондрий и представляющих собой по существу часть мембраны. Мембраны могут изменять специфичность ферментов, изменяя пространственную конформацию белковой молекулы фермента (четмертичная структура). Например, АТФ-аза, связанная с мембраной синтезирует АТФ, а свободная разрушает.
Биологическое окисление.
В процессе обмена веществ пищевые продукты (углеводы, липиды) подвергаются катаболизму.
Катаболизм – это процесс расщепления высокомолекулярных веществ до низкомолекулярных веществ, идущий с выделением энергии. В процессе катаболизма происходит упрощение структуры высокомолекулярных веществ.
Энергия, выделившаяся в процессе катаболизма, используется для синтеза новых веществ, т.е. в процессе анаболизма.
Взаимодействие превращения вещества и энергии называются метаболизмом.
Процессы окисления протекают в организме и вне организма. Эти процессы имеют сходства и различия.
Сходство между окислением в организме и вне организма.
1. В результате окисления образуются одинаковые конечные продукты СО2 и Н2О.
2. Выделяется одинаковое количество энергии.
Различия между окислением в организме и вне организма.
1. Вне организма энергия выделяется за счет окисления атомов углерода, а в организме за счет окисления атомов водорода.
2. Вне организма кислород соединяется с окисляемым субстратом. В организме кислород не соединяется с субстратом.
3. Вне организма энергия выделяется одномоментно и не аккумулируется, т.е. не запасается. В организме энергия выделяется порциями, «каскадно» и аккумулируется (запасается). «Каскадное» выделение энергии предохраняет клетку от перегрева.
4. Основной реакцией окисления в организме является реакция дегидрирования, т.е. отщепление водорода (протонов). Вспомогательными реакциями являются реакции дегидратации и декарбоксилирования.
5. Процесс окисления в организме многоступенчатый, ферментативный процесс.
Процесс окисления субстратов в биологических объектах называется биологическим окислением.
Виды биологического окисления.
1. Тканевое дыхание
2. Субстратное окисление
Тканевое дыхание – многоступенчатый ферментативный процесс, в котором конечным акцептором электронов является кислород.
В процессе тканевого дыхания участвую ферменты – оксидоредуктазы, образующие дыхательную цепь.
Дыхательная цепь – это комплекс оксидоредуктаз, участвующих в переносе протонов и электронов от окисляемого субстрата к кислороду.
Дыхательная цепь локализована в кристах митохондрий.
Строение дыхательной цепи.
Дыхательная цепь включает 4 группы ферментов:
1. Пиридинзависимые дегидрогеназы – коферментом является НАД, НАДФ.
2. Флавинзависимые дегидрогеназы – коферментом является ФАД, ФМН.
3. Коэнзим Q или убихинон.
4. Цитохромы b, c, a, a3.
Цитохромы являются геминовыми белками, в качестве небелковой части содержат гем. В составе гема содержатся атом железа, который может изменять степень окисления с +3 до +2, присоединяя или отдавая электрон.
В составе дыхательной цепи выделяют два участка:
1. Участок, включающий пиридинзависимые дегидрогеназы – коэнзим Q обеспечивает перенос протонов и электронов. На уровне коэнзима Q протоны уходят в среду митохондрий, т.к. цитохромы по своему строению способны переносить только электроны.
2. Участок цитохромов, обеспечивающий перенос только электронов.
Основное значение цитохромной системы перенос электронов от окисляемого субстрата на молекулярный кислород с образованием воды:

Схема переноса электронов и протонов по дыхательной цепи.
 По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона.
По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона.
Коферменты дыхательной цепи принимая протоны и электроны превращаются в восстановленную форму, а отдавая их снова превращается в окисленную форму.
Движущей силой, обеспечивающей перенос протонов и электронов от субстрата к кислороду, является разность редокс-потенциалов. В дыхательной цепи происходит нарастание редокс-потенциала (от –0,32 в до +0,81 в О2)
Для синтеза одной макроэргической связи АТФ требуется перепад редокс-потенциалов между участками дыхательной цепи примерно в 0,22 в на пару перенесенных электронов.
Длина дыхательной цепи (количество ферментов) может быть различна и зависит от природы окисляемого субстрата.
Для клетки важно, чтобы молекула кислорода, присоединив 4 электрона, полностью восстановилась до двух молекул воды. При неполном восстановлении кислорода в случае присоединения двух электронов образуется перекись водорода, а в случае присоединения одного электрона – супероксидный радикал  . Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов.
. Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов.
Аэробные клетки защищают себя от действия перекиси и супероксида с помощью двух ферментов: супероксиддисмутазы и каталазы.

Пути использования энергии переноса электронов.
При переносе пары электронов происходит изменение свободной энергии и эта энергия используется по двум путям:
1. Энергия переноса электронов используется на синтез АТФ.
2. Энергия переноса электронов используется для выработки тепла.
При переносе пары электронов по дыхательной цепи происходит изменение свободной энергии, равная 52,6 ккал. Этой энергии достаточно для синтеза 3 молекул АТФ. Синтез трех молекул АТФ в стандартных условиях требует затраты  ккал.
ккал.
В трех пунктах переноса электронов происходит наибольшее изменение свободной энергии и эти пункты называются пунктами сопряжения тканевого дыхания и окислительного фосфорилирования.
Окислительное фосфорилирование это процесс ресинтеза АТФ из АДФ и Фн, сопряженный с тканевым дыханием.
Пункты сопряжения находятся на участках:
1. НАД/ФАД
2. ц в/ц с
3. ц а/а3  О2
О2
Пункты сопряжения постоянны, но их количество зависит от природы окисляемого субстрата.
При окисления НАД – зависимых субстратов имеет место 3 пункта сопряжения, т.е. выделяется 3АТФ, при окислении ФАД – зависимых субстратов имеет место 2 пункта сопряжения и выделяется 3 АТФ, при окислении цитохромзависимых субстратов, количество АТФ, зависит от того, на какой цитохром сбрасываются электроны: при сбросе электронов на цитохром b выделяется 2АТФ в процессе окислительного фосфорилирования, а на цитохром с – 1АТФ.
 Коэффициент фосфорилирования – это соотношение Р/О как показатель сопряжения дыхания и фосфорилирования.
Коэффициент фосфорилирования – это соотношение Р/О как показатель сопряжения дыхания и фосфорилирования.
Было установлено, что при поглощении одного атома кислорода (или при переносе пары электронов от субстрата к кислороду) поглощается не один атом неорганического фосфата, а примерно три т.е. коэффициент Р/О примерно равен 3. Т.е. в дыхательной цепи имеется как минимум три пункта сопряжения, где неорганический фосфат участвует в образовании АТФ.
Процесс биологического окисления может не сопровождаться синтезом АТФ.
Окисление, не сопровождающееся синтезом АТФ, называется свободным окислением. В этом случае энергия выделяется в виде тепла. Это может наблюдаться при действии токсинов и сопровождается повышением температуры тела.
Причины нарушения биологического окисления.
1. Недостаток субстратов окисления (углеводов, липидов, т.е. пищи).
2. Нарушение работы ферментов в дыхательной цепи:
1. Дефект апофермента (нарушен синтез белковой части фермента).
2. Дефект кофермента (нарушение синтеза коферментов из-зи недостатка витаминов В2,В5, К).
3. Недостаток кислорода.
4. Действие ингибиторов.
Аминобарбитал ингибирует перенос протонов и электронов на участке НАД/ФАД, окисление НАДзависимых субстратов прекращается.
Антимицин ингибирует перенос электронов на участке цитохром b, цитохром с.
Цианады ингибируют перенос электронов на участке цитохромоксидазы/кислород.
При большинстве физиологических состояний перенос электронов сопряжен с окслительным фосфорилированием.
Ряд соединений может вызвать разобщение тканевого дыхания и окислительного фосфорилирования. Разобщителями этих процессов являются следующие соединения: 2,4 – динитрофенол, гормон щитовидной железы – тироксин, дикумарин и его производные, жирные кислоты.
Разобщение окислительного фосфорилирования и тканевого дыхания может быть биологически полезным. Разобщение представляет собой способ генерирования тепла для поддержания температуры тела у зимнеспящих животных и млекопитающих адаптированных к холоду. В качестве разобщителя выступают жирные кислоты, которые накапливаются в бурой жировой ткани. Такой бурый жир есть и у новорожденных детей, что позволяет поддерживать температуру тела при еще несовершенной системе терморегуляции.
У больных с гиперфункцией щитовидной железы отмечается повышение температуры тела, что обусловлено разобщением процессов тканевого дыхания и окислительного фосфорилирования, вызванного тироксином.
При недостатке кислорода в тканях процесс тканевого дыхания затруднен и в тканях протекает субстратное окисление.
Субстратное окисление – это процесс окисления, при котором конечным акцептором электронов является субстрат, а не кислород.
Субстратное окисление – это аварийный источник получения энергии при недостатке кислорода.
Недостаток кислорода (гипоксия) возникает в организме при физической работе, при подъеме в горы, опускании под воду, при заболеваниях органов дыхания, сердечно-сосудистой системы и кроветворной системы.
Субстратное окисление энергетически менее выгодно, чем тканевое дыхание, т.к. редокс-потенциалы субстратов отличаются незначительно.
В организме наряду с окислительным фосфорилированием процессом, дающим энергию является субстратное фосфорилирование.
Субстратное фосфорилирование – это процесс образования макроэргических соединений за счет макроэргических связей субстрата.
Важнейшим макроэргическим соединением является АТФ.
Энергия макроэргических связей аккумулируется в ряде соединений: креатинфосфат, 1,3-дифосфоглицерат, ГТФ и др.
Биологическое окисление
Тканевое дыхание Свободное окисление Субстратное окисление
Связано с Энергия
окислительным выделяется
фосфорилированием в виде тепла
Энергия выделяется
в виде АТФ
Фосфорилирование
Окислительное фосфорилирование Субстратное фосфорилирование
связано с мембранами митохондрий не связано с мембранами
митохондрий
| Процесс | Ингибиторы тканевого дыхания | Разобщители тканевого дыхания и окислительного фосфорилирования | Ингибиторы синтеза АТФ |
| Аминобарбитал, ротенон, антимизин, цианиды | 2,4-динитрофенол, жирные кислоты, дикумарин и его производные, тироксин | Антибиотики олигомицин, рутамицин | |
| Ионофоры: | Валиномицин, грамицидин |
Одно время пытались использовать некоторые разобщающие агенты для борьбы с ожирением за счет понижения эффективности синтеза АТФ. Но эти вещества оказались крайне токсичны, и потому от такого их применения отказались.
Существует еще группа веществ как ионофоры, т.е. переносчики
ионов. Это жирорастворимые вещества, способные связывать определенные ионы и переносить их через мембрану. Ионофоры отличаются от разобщителей тем, что ионофоры переносят через мембрану не ионы водорода, а какие-нибудь другие катионы. Например, токсичный антибиотик валиномицин образует жирорастворимый комплекс с ионами К+, легко проходящий через внутреннюю мембрану митохондрий, тогда как в отсутствие валиномицина ионы К+ проникают сквозь нее с трудом. Ионофор грамицидин облегчает проникновение ионов К+ и Na+.
Ионофоры и разобщители подавляют окислительное фосфорилирование, увеличивая проницаемость мембраны для ионов Н+, К+ или Na+.
Окислительное фосфорилирование
Ферменты ЦПЭ фиксированы в митохондриальной мембране и их действие характеризуется не только величиной, но и пространственной направленностью, т.е. действуют векторно.
Проявлением векторности является перенос ионов Н+ с внутренней стороны мембраны (со стороны матрикса) на наружную. С НАДН электроны переходят на ФМН, а протоны освобождаются с внутренней стороны мембраны. Протоны, необходимые для восстановления ФМН, поступают из матрикса. На следующем этапе электроны с ФМН Н2 переходят на убихинон, а протоны – в межмембранное пространство; убихинон получает протоны из матрикса и так далее. ЦПЭ работает как протонный насос, перекачивая ионы Н+ из матрикса на наружную сторону мембраны. В результате по сторонам мембраны возникает разность концентраций протонов и одновременно разность электрических потенциалов со знаком + на наружной повехности.
Электрохимический потенциал заставляет протоны двигаться в обратном направлении – с наружной поверхности внутрь. Движение протонов идет по протонным каналам, где располагается АТФ-аза, катализирующая реакщию:
АДФ + Н3РО4 = АТФ + Н2О
АТФ при участии транслоказы поступает из матрикса на наружную сторону мембраны, а затем в цитозоль.
Гипотеза Митчелла
Согласно этой гипотезе, цепь переноса электронов – насос, перекачивающий ионы Н+. Энергия, высвобождаемая при переносе электронов используется для перемещения ионов Н+ из митохондриального матрикса наружу, что приводит к возникновению электрохимического Н+- градиента сболее высокой концентрацией ионов Н+ в наружной водной фазе. Этот же процесс ведет к появлению трансмембранного электрического потенциала – наружная сторона мембраны оказывается электроположительной. Ионы Н+ из окружающей среды вновь устремляются внутрь, т.е. в митохондриальный матрикс, на этот раз по электрохимическому градиенту. Этот переход ионов Н+ из зоны с более высокой в зону с более низкой их концентрацией сопровождается выделением свободной энергии, за счет которой синтезируется АТФ.
Электрохимический Н+-градиент с более высокой концентрацией Н+ на наружной мембране.
Трансмембранный электрический потенциал – наружная мембрана заряжена положительно, а внутренняя – отрицательно.
Ионы Н+ из окружающей среды по электрическому градиенту идут внутрь митохондрии и этот процесс сопровождается выделением свободной энергии, которая идет на синтез АТФ.
Обмен углеводов.
Обмен углеводов в организме человека складывается из следующих процессов:
1. Расщепление в желудочно-кишечном тракте до моносахаридов поступающих с пищей полисахаридов с пищей полисахаридов и дисахаридов. Всасывание моносахаридов из кишечника в кровь.
2. Синтез и распад гликогена.
3. Анаэробное окисление глюкозы. В тканях существует два основных пути распада глюкозы: анаэробный путь гликолиза, который идет без потребления кислорода, и аэробный путь прямого окисления глюкозы или пентозофосфатный путь.
4. Аэробный метаболизм пирувата, включающий окислительное декарбоксилирование пирувата и превращение ацетил-КоА в ЦТК.
5. Глюкогенез, т.е. образование углеводов из неуглеводных продуктов, таких как пируват, лактат, глицерин, аминокислоты.
Обмен углеводов.
| Обмен углеводов | |||
| Распад (гликогенолиз) и синтез (гликогенез) гликогена | Гликолиз | Пентозо- фосфатный путь | глюконеогенез |
| Окислительное декарбоксилирование пирувата | |||
| ЦКТ |
Значение углеводов в организме:
1. Углеводы – это основной энергетический материал.
2. Углеводы выполняют пластическую функцию. К ним относятся пентозы нуклеотидов и гликопротеинов, гетерополисахариды межклеточного вещества.
3. Углеводы могут превращаться в липиды и некоторые аминокислоты.
Источником углеводов организма служат углеводы пищи – крахмал, сахароза и лактоза. Кроме того, глюкоза, может образовываться в организме из аминокислот, глицерина.
Углеводы пищи в пищеварительном тракте распадаются на мономеры. В переваривании принимают участие гидролазы.
Специфические гидролазы: мальтаза, сахараза, лактаза вырабатываются клетками кишечника и содержатся в кишечном соке.
Продукты полного переваривания углеводов – глюкоза, галактоза и фруктоза – через клетки кишечника поступают в кровь. При всасывании из кишечника в кровь моносахариды проникают через клеточные мембраны путем облегченной диффузии и с помощью активного транспорта. Активный транспорт обеспечивает перенос моносахаридов против градиента концентрации, и поэтому может функционировать тогда, когда концентрация глюкозы или галактозы в кишечнике невелика.
Важнейшие сахара через воротную вену проникают в печень, где идет превращение фру и гал в глю.
Гликолиз.
Гликолиз (от греч. glykys – сладкий, lysis - распад) – один из центральных путей катаболизма глюкозы.
В процессе гликолиза происходит расщепление шестиуглеродной молекулы пирувата. Первые пять этапов составляют подготовительную стадию гликолиза. Продуктом первой стадии гликолиза является глицеральдегид-3-фосфат. Подготовительная стадия гликолиза служит для того, чтобы превратить углеродные цепочки всех метаболизируемых гексоз в один общий продукт – глицеральдегид-3-фосфат.
Вторая стадия гликолиза, состоящая тоже из 5 ферментативных реакций, сопровождается образованием энергии.
Стадии гликолиза.
I. 1. Фосфорилирование глюкозы: реакция протекает необратимо, катализируется гексокиназой и требует затраты АТФ:

Необратимые реакции – это реакции, протекающие в прямом направлении под действием одного фермента, а в обратном под действием другого.
Связывание гексогеназы с гексозой происходит по типу индуцированного соответствия: молекула фермента претерпевает конформационные изменения. Активность гексокиназы ингибируется глю-6-фосфатом.
В печени присутсвует другая форма фермента – глюкокиназа. Глюкокиназа специфична в отношении D-глюкозы. Глюкокиназа печени действует при возрастании концентрации глюкозы, например после приема пищи, богатой углеводами.
Гликолиз включает химические превращения 3 разных типов:
1. Распад углеродного скелета глюкозы с образованием пирувата (путь атомов углерода).
2. Фосфорилирование АДФ высокоэнергетическими фосфорилированными содинениями с образованием АТФ (путь фосфатных групп).
3. Перенос водородных атомов или электронов.
Ферменты, катализикующие гликолиз, локализованы в цитозоле.
Ферменты, катализирующие те этапы окисления углеводов, которые требуют присутствия О2, локализируются в митохондриальных мембранах.
В этих условиях глюкокиназа действует на избыточную глюкозу крови и переводит ее в глюкозо-6-фосфат для отложения в запас в виде гликогена.
В мышечной ткани глюкокиназа отсутствует.
2.Превращение глю-6-ф во фру-6-ф

3. фосфорилирование фру-6-ф во фру-1,6-дф

4. Расщепление фру-1,6-дф на триозы:

В дальнейших превращениях принимает участие глицеральдегид-3-ф, который образуется в результате изомеризации дигидроксиацетонфосфата:
Дигидроксиацетонфосфат  глицеральдегид-3-фосфат
глицеральдегид-3-фосфат
В количественном отношении больше образуется дигидроксиацетонфосфата.
II. На второй стадии гликолиза запасается энергия.
Из одной молекулы глю образуется две молекулы глицеральдегид-3-фосфата, которые участвуют в дальнейших превращениях.
1. Окисление глицеральдегид-3-фосфата до 1,3-фосфоглицероилфосфата: дифосфоглицериновая кислота (гликолитическая оксидоредуктация)
СН2ОРО3Н2 СН2ОРО3Н2
| глицеральдегид- 2 |
СНОН фосфатдегидрогеназа CHOH


 | |
| |
С=О C=O
| 2НАД++Фн 2НАДН+Н+ |
Н OPO3H2
3-ФГА 1,3-фосфоглицератфосфат
Коферментом глицеральдегидфосфатдегидрогеназы является НАД+ . Механизм действия этого фермента очень сложен.
2. Образование 3-фосфоглицерата:

3. Образование 2-фосфоглицерата:

4. Образование фосфоенолпирувата – субстратное фосфорилирование:
 Высокоэнергетическое фосфорилированное соединение фосфоенолпируват.
Высокоэнергетическое фосфорилированное соединение фосфоенолпируват.
5. Образование пирувата:

Дальше процесс идет в зависимости от наличия или отсутствия кислорода в клетке.
При анаэробных условиях, например в напряженно работающих скелетных мышцах. Пируват превращается в лактат:

В этих условиях образовавшийся при гликолизе НАДН регенерируется за счет пирувата, d восстанавливается до лактата.
Электроны, пришедшие сначала от глицеральдегид-3-фосфат к НАД+, переносятся в форме НАДН на пируват. Восстановление НАД катализируется ЛДГ.
С накоплением лактата в скелетных мышцах связано возникновение чувства усталости. ЛДГ представлена 5 различными изоферментами. ЛДГ сердечной мышцы характеризуется низкой Кm для пирувата, а ЛДГ мышечной ткани имеет более высокую величину Кm для пирувата.
Суммарная реакция:
Глю + 2АДФ + 2Фн  2Лак + 2 АТФ
2Лак + 2 АТФ
При анаэробном гликолизе образуется 4 молекулы АТФ, но выделяется только 2 молекулы, т.к. 2 молекулы АТФ затрачиваются в процессе фосфорилирования.
Значение анаэробного гликолиза:
Окисление глю в условиях недостатка кислорода в тканях позволяет получить энергию клеткой при гипоксии, которая может быть вызвана физической нагрузкой, а также нарушениями со стороны сердечно-сосудистой и дыхательной систем. При ИБС наблюдается анаэробный гликолиз, т.к. нарушается при дефиците О2 работа дыхвтельной цепи, а следовательно окисление глю и жирных кислот, которые является главнейшими источниками энергии.
II. При достаточном содержании О2 в клетке глю окисляется до конечных продуктов – СО2, Н2О и этот процесс называется аэробным окислением глю.

Конечным продуктом аэробного гликолиза является пируват, а энергетический баланс складывается из 3 молекул АТФ образовавшихся в результате субстратного фосфорилирования и остается еще 2 молекулы восстановленного НАДН, от концентрации которого зависит активность процесса. Для продолжения процесса необходим сброс Н2 на ферменты дыхательной цепи, но сама молекула НАДН через мембрану митохондрий проникнуть не может, для этого используются переносчики и перенос осуществляется с помощью 2-х механизмов:
1. Глицерофосфатный челночный механизм;
2. Малатно-аспартатный челночный механизм.
Глицерофосфатный челночный механизм.
| Цитоплазма | Митохондрии | |
  
| 
|
Малатный челночный механизм.
| Цитоплазма | Митохондрии | |
   
| 
|
В процессе гликолиза образуется восстановленная форма НАДН, которая не может непосредственно передавать водород на дыхательную цепь, т.к. митохондриальная мембрана непроницаема для НАДН. Перенос водорода с цитозольного НАДН в митохондрии происходит при участии специальных механизмов, называемых челночными. Суть механизмов сводится к тому, что НАДН в цитозоле восстанавливает какое-то соединение, способное проникать в митохондрию; в митохондрии это соединение окисляется, восстанавливая внутримитохондральный НАД, и вновь переходит в цитозоль.
Баланс аэробного гликолиза:
1. Анаэробный гликолиз – субстратное фосфорилирование – 2АТФ
Глю  2пир
2пир
2. 2Пир  2 СН3СОSKoА – окислительное декарбоксилирование 2 НАДН- 6АТФ
2 СН3СОSKoА – окислительное декарбоксилирование 2 НАДН- 6АТФ
3. Регенерация 2 НАДН в челночном механизме - 6 АТФ
4. ЦТК  2 СН3СОSKoА
2 СН3СОSKoА  СО2 24 АТФ
СО2 24 АТФ
 Н2О
Н2О
38 АТФ
СХЕМА ГЛИКОЛИЗА.

Включение в гликолиз других моносахаридов.
В гликолиз вовлекаются, кроме глюкозы и другие моносахара. Такие как D-фруктоза, манноза и галактоза.
Фруктоза и манноза фосфорилируются с помощью неспецифической гексокиназы с образованием фруктозо-6-фосфата и является метаболитом гликолиза. Маннозо-6-фосфат изомеризуется фосфоманнозоизомеразой во фруктозо-6-фосфат.
Имеется и другой путь включения фруктозы в гликолиз. Фруктоза под действием фруктокиназы печени превращается во фруктозо-1-фосфат, а под действием альдолазы расщепляется на дигидроксиацетонфосфат и глицеральдегид.
Галактоза сначала также фосфорилируется в печени с помощью галактокиназы: D-галактоза + АТФ  галактозо-1-Ф +АДФ Затем галактозо-1-фосфат превращается в глюкозо-1-фосфат. Для этой реакции изомеризации необходимы уридиндифосфат-глюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уридилтрансфераза:
галактозо-1-Ф +АДФ Затем галактозо-1-фосфат превращается в глюкозо-1-фосфат. Для этой реакции изомеризации необходимы уридиндифосфат-глюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уридилтрансфераза:
Галактозо-1-фосфат + УДФ-глюкозо  УДФ-галактоза + глюкозо-1-фосфат
УДФ-галактоза + глюкозо-1-фосфат
Глюкозо-1-фосфат подключается к гликолизу, а УДФ-галактоза превращается в УДФ-глюкозу с помощью УДФ-глюкозо-эпимеразы.

Пентозофосфатный (апотамический) путь окисления глюкозы.
Большая часть глюкозы расщепляется в тканях по гликолитическому пути с образованием пирувата. В свою очередь большая часть пирувата окисляется через цикл лимонной кислоты. Главный смысл расщепления глюкозы в процессе гликолиза заключается в обеспечении клетки энергией в форме АТФ. Наряду с этим существуют, однако, и другие пути катаболизма глюкозы, имеющие специальное назначение. На этих путях вырабатываются особые продукты, в d нуждается клетка.
Пентозофосфатный или фосфоглюконатный путь является источником в организме специальных продуктов:
Значение:
1. НАДФН, d используется как источник восстановительных эквивалентов в процессах биосинтеза жирных кислот, стероидов.
2. Рибозо-5-фосфата (пентозы), d используется для синтеза нуклеиновых кислот.

3. Образование АТФ.
По другому вторичному пути катаболизма глюкозы в животных тканях образуются два специализированных продукта: D-глюконат, важная роль которого связана с обезвреживанием и выведением из организма чужеродных органических веществ, и L-аскорбиновая кислота (витамин С).
Реакции пентозофосфатного пути протекают в цитозоле.
Взаимосвязь пентозного пути и гликолиза.

Обмен гликогена.
Глюкоза как моносахарид свободно диффундирует через мембрану печеночных клеток, она не может служить резервом углеводородов в печени. Так как фосфатные эфиры глюкозы и фруктозы не столь легко проникают через мембраны, фосфорилирование этих сахаров создает как бы ловушку для них, эффективно изолируя реакции гликолиза и фосфоглюконатного пути в пределах внутриклеточного отсека. Тем не менее фосфаты сахаров не могут накапливаться в больших количествах в печени, так как благодаря осмосу увеличение их запасов будет сопровождаться накоплением больших количеств воды.
В печени происходит превращение избытка углеводов в нерастворимый полимер – гликоген. Эта резервная форма глюкозы может составлять одну десятую всей массы печени. При голодании запас гликогена почти полностью истощается.
Обмен гликогена включает в себя 2 процесса: гликогенез или синтез гликогена и гликогенолиз или распад гликогена.
Гликогенез – синтез гликогена – это анаболический процесс, требующий затраты энергии в форме как АТФ, так и уридинтрифосфата (УТФ). Исходным источником для синтеза гликогена является глю, d под действием глюкокиназы превращается в глю-6-фосфат.
Глю-6-ф занимает ключевое положение как общий промежуточный продукт ряда процессов углеводного обмена: он способен к обратимому превращению в пируват путем гликолиза или глюконеогенеза, а также к необратимому – в пентозы в ходе фосфоглюконатного пути. Глю-6-ф может обратимо превращаться в гликоген.
Затем глю-6-ф превращается в глю-1-ф. В процессе активации глю-1-ф участвуют уридиннуклеотиды. В ходе этого процесса два концевых фосфорных остатка УДФ освобождаются в виде неорганического пирофосфата, остаток УМФ соединяется с глю-1-ф, образуя УДФ-глюкозу.
Источником глю при синтезе гликогена является УДФ-глю, d образуется из глюкозо-1-ф и УТФ:
Глю-1-ф + УТФ  УДФ=глю + Н4Р2О7
УДФ=глю + Н4Р2О7
На следующей стадии происходит перенос остатка глю с УДФ-глю на затравку гликогена с помощью гликогенсинтетазы:
УДФ-глю + (глю)n  УДФ +(глю)n+1
УДФ +(глю)n+1
Гликогенсинтетаза катализирует образование только 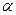 -1,4-гликозидных связей. «Ветвящий» фермент образует
-1,4-гликозидных связей. «Ветвящий» фермент образует 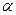 -1-6 гликозидные S (точки ветвления).
-1-6 гликозидные S (точки ветвления).
Гликогенолиз – распад гликогена идет путем фосфоролиза.

Биосинтез углеводов.
Гликолиз, пентозофосфатный путь, гликгенолиз – это катаболические пути, которые сходятся в цикле лимонной кислоты, чтобы передать свои богатые энергией электроны в дыхательную цепь. Перемещаясь по дыхательной цепи к кислороду, эти электроны поставляют энергию для синтеза АТФ. Теперь нам предстоит рассмотреть анаболические пути. На этих путях химическая энергия в форме АТФ и НАДФН используется для синтеза клеточных компонентов из простых предшественников.
Организационные принципы биосинтеза.
1. Пути биосинтеза и пути расщепления тех или иных биомолекул, как правило, не идентичны. Эти пути могут включать какую-нибудь общую обратимую реакцию или даже несколько таких реакций, но у них всегда имеется хотя бы одна ферментативная стадия, по которым они различаются.
2. Биосинтетические пути и соответствующие им катаболические пути контролируется разными регуляторными ферментами. Обычно регуляция соответствующих биосинтетических и катаболитических путей осуществляется координированным образом, реципрокно, так что стимулирование биосинтетического пути сопровождается подавлением катаболитического пути и наоборот. Кроме того, биосинтетические пути регулируются обычно на одном из первых этапов. Это избавляет клетку от непроизводительных трат: она не расходует предшественники на синтез тех промежуточных продуктов, которые ей не понадобятся.
3. Требующие затраты энергии биосинтетические процессы обязательно сопряжены с поставляющем энергию расщеплением АТФ, вследствие чего весь процесс в целом является практически необратимым, точно также как в целом необратим катаболизм. Таким образом, общее количество АТФ (или НАДН), используемое на данном биосинтетическом пути, всегда превосходит то минимальное количество свободной энергии, которое требуется для превращения предшественника в биосинтетический продукт.
Центральным биосинтетическим путем является образование глюкозы из неуглеводных предшественников. У всех высших животных и человека биосинтез глюкозы абсолютно необходимый процесс. Глюкоза крови служит единственным или главным источником энергии для нервной системы (в том числе и для мозга), а также для почек, семенников, эритроцитов и для всех тканей эмбриона. У человека один только мозг потребляет 120 г глюкозы в сутки.
Образование глюкозы из неуглеводных предшественников называется глюконеогенезом (образование нового сахара).
В процессе глюконеогенеза глюкоза синтезируется из лактата, пирувата, глицерола, и большинства аминокислот, из промежуточных продуктов цикла лимонной кислоты.
Глюконеогенез протекает в печени и значительно менее интенсивно – корковом веществе почек.
При гликолизе глю превращается в пируват, при глюконеогенезе пируват превращается в глюкозу. Глюконеогенез это не обращение гликолиза, т.к. в гликолизе есть 3 необратимые стадии, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой.
Пути глюконеогенеза обходят эти 3 необратимые реакции гликолиза при помощи следующих новых этапов:
1. Фосфоенолпируват ббразуется из пирувата через оксалоацетат.
Первый этап в обходной последовательности реакций катализируется митохондриальной пируваткарбоксилазой. Этот биотинзависимый фермент катализирует образование оксалоацетата из пирувата:
Пируват + СО2+АТФ  оксалоацетат+АДФ+Рн
оксалоацетат+АДФ+Рн
Пируваткарбоксилаза – регуляторный фермент; в отсутствии ацетил-КоА который служит для нее положительным регулятором, она почти полностью лишена активности.
Оксалоацетат, образующийся в митохондриях из пирувата обратомо восстанавливается за счет НАДН с образованием малата:
Митох. НАДН+Н+ + Оксалоацетат  НАД+малат
НАД+малат
Малат из митохондрий поступает в цитозоль. В цитозоле малат под действием цитозольной НАД-зависимой малатдегидрогеназы превращается в оксалоацетат:
Цитозоль Малат + НАД+  Оксалоацетат+ НАДН+Н+
Оксалоацетат+ НАДН+Н+
Дальше оксалоацетат под действием фосфоенолпируваткарбоксикиназы превращается в фосфоенолпируват:
Оксолоацетат+ГТФ  ФЭП+СО2 +ГДФ
ФЭП+СО2 +ГДФ
Донором фосфата в этой реакции служит ГТФ – гуанозинтрифосфат.
2. Вторая реакция гликолиза, которая не может использоваться для глюконеогенеза – это реакция фосфорилирования фру-6-ф, катализируемая фосфофруктокиназой.
В глюконеогенезе действует обходной путь с участием фруктозодифасфатазы, которая катализирует необратимый гидролиз фру-1,6-дф с образованием фру-6-ф
Фру-1,6-дф  фру-6-ф
фру-6-ф
Фруктозодифосфотаза – регуляторный фермент, нуждается в ионах Mg2+ . Ингибируется АМФ, активируется АТФ.
3. Третьей обходной реакции в синтезе глюкозы является дефосфорилирование глю-6-ф с образованием глю.
Дефосфорилирование осуществляется под действием глюкозы-6-фосфатазы:
Глю-6-ф  глю
глю
Глюконеогенез требует значительных затрат энергии. Стадии глюконеогенеза, требующие затрат энергии:
Пир + СО2 + АТФ  оксалоацетат + АДФ + Фн
оксалоацетат + АДФ + Фн
Оксалоацетат + ГТФ  ФЕП + СО2 + ГДФ
ФЕП + СО2 + ГДФ
3ФГК  1,3ФГК
1,3ФГК
На каждую молекулу глю потребуется 6 высокоэнергетических фосфатных групп – 4 от АТФ и 2 от ГТФ.
Кроме того, для восстановительных этапов требуется 2 молекулы НАДН:
1,3 ДФГК + НАДН + Н+  3ФГА + НАД+
3ФГА + НАД+
Суммарная реакция:
2Пир + 4 АТФ + 2 ГТФ + 2 НАДН + 2 Н+ + 4 Н2О  Глю + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Рн
Глю + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Рн