Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают "слипаться", образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок "замаскирован" в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте).
Так как "серповидные" эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли "даже некроз клеток в данной области.
Серповидно-клеточная анемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена бета-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
№4 Гемоглобин плода и его физиологическое значение. Роль 2.3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду
Олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина. в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
№5Буферная роль гемоглобина
Гемоглобиноваябуферная система– самая мощная буферная система крови. На ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СO3—> КНСO3 + ННb.
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови.
№6 Гемоглобинопатии, биохимические основы нарушений.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов.
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина. В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Талассемии- наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются, поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НbА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз.Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемияразвивается при дефиците фолиевой кислоты или витамина В12. Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Персистенция фетального гемоглобина — наследственная гемоглобинопатия, при которой после рождения ребёнка не происходит постепенной замены фетального гемоглобина на гемоглобин А, обладающий большей функциональной стабильностью в широком интервале pH, хотя и меньшей кислород-связывающей способностью. При этом, поскольку фетальный гемоглобин менее стоек и стабилен, у страдающих этой формой гемоглобинопатии укорочен срок жизни эритроцитов, повышен гемолиз и повышено разрушение эритроцитов в селезёнке, со всеми вытекающими последствиями в виде перегрузки организма железом и желчными пигментами и хронического «перенапряжения» эритроцитарного ростка костного мозга.
№7 Метаболизм эритроцита. Транспорт кислорода кровью. Транспорт двуокиси углерода кровью. Эффект Бора.
Эритроциты - высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка. Организм взрослого человека содержит около 25×1012 эритроцитов, при этом каждые сутки обновляется примерно 1% этого количества клеток, т.е. в течение одной секунды в кровоток поступает около 2 млн эритроцитов.
Транспорт кислорода кровью. Кровь ежедневно должна переносить из лёгких в ткани около 600 л ,О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма. С другой стороны, О2 - сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина - его способность регулировать сродство к О2 в зависимости от тканевых условий.
Основная функция гемоглобина - доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина - Нb(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец гема и атомом азота Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7. Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания.
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Гемоглобин способен присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
Перенос Н+ и С02 из тканей в лёгкие
с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
СО2 + Н2О - H2CO 3 - H+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α -аминогруппам двух α -цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём . Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора.
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О - Н2СО3 - Н+ + НСО3-сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым α -аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α 1 β 1 и α 2 β 2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β -цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2. Присоединение БФГ к дезоксигемоглобину происходит в аллостерическом центре.
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
ионных связей между димерами α 1 β 1 и α 2 β 2 приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
№8 Карбоксигемоглобин. Метгемоглобин. Анемические гипоксии.
Карбоксигемоглобин (COHb) — трудноразъединимое соединение гемоглобина и угарного газа. Переизбыток в крови карбоксигемоглобина приводит к кислородному голоданию, головокружению, тошноте, рвоте или даже смерти, т.к. угарный газ, связанный с гемоглобином, лишает его возможности присоединять к себе кислород.
Карбоксигемоглобин искусственно разъединяется медицинским путём, также он может распасться естественным путём, период полураспада — 4-6 часов. Это возможно, если его содержание в крови мало, и жизнедеятельность организма не нарушается.
Карбоксигемоглобин, HbCO, продукт присоединения CO (углерода окись, угарный газ) с гемоглобином (Hb). Растворы карбоксигемоглобина ярко-красного цвета, их спектр поглощения характеризуется максимумами при длине волны 570 и 539 ммк.
Расщепление карбоксигемоглобина на Hb и CO происходит в 10 000 раз медленнее, чем расщепление оксигемоглобина на Hb и O2. Поэтому при наличии во вдыхаемом воздухе CO кислород постепенно вытесняется из гемоглобина. Уже при концентрации 0,1 % CO в воздухе больше половины Hb крови превращается в карбоксигемоглобин; в результате нарушается перенос кислорода от лёгких к тканям и развивается так называемое угарное отравление, химическое соединение, образующееся при взаимодействии окиси углерода с красящим пигментом крови гемоглобином.
Карбоксигемоглобин образуется очень быстро, поскольку способность присоединяться к гемоглобину у угарного газа примерно в 200 раз выше, чем у кислорода. Карбоксигемоглобин не способен переносить кислород к тканям организма, поэтому при отравлении окисью углерода у человека может быстро наступить смерть. В больших количествах карбоксигемоглобин образуется при отравлении окисью углерода, а в небольших всегда присутствует в крови всех курильщиков и жителей огромных городов. СО может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
Метгемоглобин, MtHb (HbOH),гемиглобин, ферригемоглобин, форма гемоглобина, в которой железо гема находится в трёхвалентном состоянии; не способен переносить кислород. Метгемоглобин легко образуется из свободного гемоглобина под действием различных окислителей, а в организме — при некоторых отравлениях. MtHb может выделяться с мочой (метгемоглобинурия), иногда повреждая почки. Лечение метгемоглобинемии: введение противоядий (метиленовая синь, аскорбиновая кислота), кислородная терапия.
Гипоксия анемическая— кислородная недостаточность, развивающаяся из-за уменьшения количества эритроцитов или снижения в них гемоглобина. Типы анемической гипоксии (отравление СО, кровяные яды) – токсические анемии.
.№9 Миоглобин его строение и функции. Маршевая миоглобинурия.
Содержит небелковую часть - гем и белковую - апомиоглобин. Гем- молекула имеет структуру циклического тетрапиррола, где 4 пиррольных кольца соеденины метиленовыми мостиками и содержат 4 метильные,2 винильные и 2 пропионатные боковые цепи. Эта часть называется протопорфирином. В геме 4 атома азота пиррольных колец протопорфирина связаны с Fe2+, находящегося в центре молекулы. Апомиоглобин- белговая часть,первичная структрура из 153 аминокислот,кот во вторичной структуре уложены в 8 a-спиралей.a-спирали обознач. лат. буквами от А до Н,начиная с N конца полип. цепи и содержат от 7 до 23 аминокислот. для обозначен. аминокисл. используют либо порядков. номер (Гис 64) либо букву а-спирали и номер в этой спирали (Гис F8). Третичн. структура имеет вид компактной глобулы. Гем специфический лиганд апомиоглобина,присоединяется между F и E спиралями. Атом Fe2+ в геме имеет 6 координационных,4 из них связаны с атомами азота в пиррольном кольце,удерживают его в центре протопорфирина, 5 связана с Гис F8,6 связыв. с О2. Гис Е7 необходим для правильной ориентации и присоединении О2.Основная функция-связывание кислор. в мышцах.Миоглобин связывает О2,кот в капиллярах тканей высвобождает гемоглобин и сам может освобождать О2 при интенсивной физич нагрузке,возрастании потребности в мышечн. ткани. Имеет очень высокое сродство к О2.
Маршевая миоглобинурия возникает при больших физических нагрузках на мышцы, преимущественно связанных с занятием спортом: интенсивная ходьба, кросс, длительные переходы, бег, лыжные гонки, плавание, езда на велосипеде. Развивается травматический миозит с повреждением клеточных мембран и выходом миоглобина в кровь, а затем миоглобинурия. Характерны выраженный мышечный болевой синдром, отечность, припухлость пораженных мышц, судороги (крампи), повышение температуры, увеличение СОЭ, высокий лейкоцитоз, сгущение крови. Поражаются почки и печень. Темно-коричневый цвет мочи. Это связано с высоким содержанием в моче миоглобина. Почечные канальцы забиваются распавшимся миоглобином и перестают функционировать,в итоге- острая почечная недостаточность.
.№10 Каталаза и пероксидаза. Строение,локализация,биологическая функция.
Каталаза и пероксидаза не имеют прямого отношения к окислительно-восстановительным реакциям, способствуют распаду перекиси водорода, образованной при окислении. По строению эти ферменты двухкомпонентны. Коферментом является гем, идентичный гему гемоглобина, но железо имеет степень окисления 3+.Пероксидаза содержит один гем. Пероксидазы распространены, в основном, в растительном мире, но встречаются и в животных организмах, например, миелопероксидаза в лейкоцитах, лактатпероксидаза в молоке и т.д. Слабым пероксидазным свойством обладает Hb, на этом основана качественная реакция на него (бензидиновая проба). Пероксидазы ускоряет распад перекиси водорода до воды и атомарного кислорода, который является сильным окислителем. Эти ферменты участвуют в окислении ароматических соединений. Каталаза содержит 4 гема. Разлагает перекись водорода до воды и молекулярного кислорода. Присутствие каталазы обеспечивает защиту клеточных структур от действия перекиси водорода, образованной при пероксидазном типе окисления.Ткани наиболее богатые каталазой-печень, эритроциты, почки. Пероксидазой-легкие и костный мозг.Р-ии:каталазпа-2Н2О2=2Н2О+О2,пероксидаза-Н2О2+Н2SО2=2Н2О+SО2
.№11 Цитохромы, особенности структуры, биологическая роль.
Цитохромы — двухкомпонентные ферменты, относящиеся к гемсодержащим ХП, т.е. кофермент всех Цх представлен гемом. Основная биологическая функция цх – перенос электронов по цепи БО к молекулярному кислороду. Открыто около 20 цх, которые отличаются спектрами поглощения, по химической природе гема и сродству к молекулярному кислороду. Цх делятся на 4 группы в зависимости от природы входящего в них гема. Ферменты одной группы содержат одинаковые коферменты, но разные апоферменты. 5-ая и 6-ая координационные связи железа соединены с остатками гистидина и метионина (в ЦхС обе винильные группы также связаны с остатками цистеина). Железо, входящее в гемы цх может иметь степень окисления 2+ и 3+, В зависимости от способности поглащать свет в определенной части спектра цитохромы делят на группы a b c ,внутри каждой группы с уникальными спектровыми свойствами обазначают цифровыми индексами(b1 b2). В ЦПЭ участвуют а а3 b с с1. Цхb имеет гем, идентичный гему Нb и Mgb. роль цхb заключается в том, что он получает электроны от восстановленной формы КоQ, при этом КоQ окисляется, а цхb восстанавливается. . ЦхС (с1 и с) имеют одинаковые гемы, разные апоферменты. цхс1 передает электроны цхс, который восстанавливается, а цхс1 окисляется. . Цха и цха3 – имеют одинаковые коферменты, но разные апоферменты. . Цха и а3 связаны в один комплекс – цитохромоксидазу. Это крупная молекула с большим молекулярным весом, состоит из 2 молекул цха, 4-х молекул цха3 и 6 атомов меди. Медь в ЦХО переменной валентности и может служить источником электронов. Восстановленный цхс передает электроны цха, при этом окисляясь, цха восстанавливается, а цха3 окисляет ферроформу цха и передает электроны молекулярному кислороду.
№12 Поступление, переваривание и всасывание хромопротеидов.
Поступая в желудок, хромопротеиды распадаются на белок и простетическую группу. При этом белок подвергается первичному распаду на полипептиды и аминокислоты. Затем в тонком кишечнике происходит дальнейший распад полипептидов и аминокислоты начинают всасываться в кровь через ворсинки. Превращения простетических групп происходят в соответствии с их химической природой. Гем хромопротеидов окисляется в гематин, который почти не всасывается в кровь, а выделяется с калом.
№13 Метаболизм ионов железа в организме, Всасывание, транспорт, депонирование, биологическая роль, железодефицитные состояния. Гемохроматоз.
Гемоглобин имеет примерно 68% железа всего организма, ферритин - 27%, миоглобин - 4%, трансферрин - 0,1%. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки. В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 - 20 мг железа, а всасывается только около 10% этого количества. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза. Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор трансферрина и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор - апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферригине. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезёнке и костном мозге. Незначительная часть ферритина экскретируется из тканей в плазму крови. Поскольку поступление ферэитина в кровь пропорционально его содержанию в тканях, то концентрация ферритина в крови - важный диагностический показатель запасов железа в организме при железодефидитной анемии. Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, При железодефицитной анемии уменьшается размер эритроцитов и их пигментация. В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках.Гемохроматоз.Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных отложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах - сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо.
№14 Синтез порфиринов. Регуляция активности АЛК-синтазы в синтезе гема. Понятие о порфириях.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сукцинил-КоА
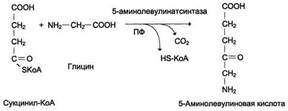
Затем АЛК подвергается дегидрогенизации

Далееà(ферм.УПГ -3-синтетаза)уропорфиноген3(ферментУПГдекарбоксилаза)àкопрофириноген3(КПГдекарбоксилазаàпротопорфирин9(Feхелатирующий фермент)àгем

Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем ,В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5'-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится.
Наследственные и приобретённые нарушения синтеза гема, сопровождающиеся повышением содержания порфириногенов, а также продуктов их окисления в тканях и крови и появлением их в моче, называют порфириями . Наследственные порфирии обусловлены генетическими дефектами ферментов, участвующих в синтезе гема. При этих заболеваниях отмечают снижение образования гема. Поскольку гем - аллостерический ингибитор аминолевулинатсинтазы, то активность этого фермента повышается, и это приводит к накоплению промежуточных продуктов синтеза гема - аминолевулиновой кислоты и порфириногенов.
В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. Эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные - в гепатоцитах.
№15, Тканевый распад железосодержащих хромопротеидов. Катаболизм гема.
16.Образование желчных пигментов, пигментов кала и мочи в норме. Диагностическое значение определения билирубина в крови и моче.
Распад хромопротеинов начинается с распада на гемм и белковую часть.Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы.Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца (рис. 13-11). В ходе реакции образуются линейный тетрапир-рол - биливердин(пигмент жёлтого цвета). Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином.Комплекс "альбумин-билирубин", доставляемый с током крови в печеНb, на поверхности плазматической мембраны гепатоцита диссоциирует.
В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты.Образуя растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, или прямой, билирубин) Секреция конъюгированного билирубина в жёлчь идёт по механизму активного транспорта, т.е. против градиента концентрации. В кишечнике поступившие билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тет-рапиррольных соединений - уробилиногеновВ подвздошной и толстой кишках небольшая часть уробилиногенов снова всасывается, попадает с кровью воротной вены в печеНb. Основная часть уробилиногена из печени в составе жёлчи выводится в кишечник и выделяется с фекалиями из организма, часть уробилиногениз печени поступает в кровь и удаляется с мочой в форме уробилина аВ норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке, под действием кишечной микрофлоры окисляется в прямой кишке до пигмента коричневого цвета уробилинаи удаляется с фекалиями. Цвет фекалий обусловлен присутствием уробилина.
В нормальном состоянии концентрация общего билирубина в плазме составляет 0,3-1 мг/дл (1,7-17 мкмоль/л), 75% от общего количества билирубина находится в неконъюгированной форме (непрямой билирубин). Когда содержание билирубина превышает норму, говорят о гипербилирубинемии. В зависимости от того, концентрация какого типа билирубина повышена в плазме - неконъюгированного или конъюгированного, - гипербилирубинемию классифицируют как неконъюгированную и конъюгированную.
№17 Роль глюкуроновой кислоты в метаболизме билирубина
Ну если в трех словах:В гепатоцитах к билирубину присоединяется 2 молекулы глюкуроновой кислоты,образуя хорошо растворимый комплекс.В этом соединении билирубин утрачивает токсичность.Попадая в кровь он уже не сорбируется на белках и освобождается с мочой
№18 Патология пигментного обмена. Виды желтух.
Пигментный обмен – совокупность процессов образования, превращения и распада в живых организмах окрашенных органических веществ сложного химического строения – пигментов. Важнейшие пигменты – порфирины, хромопротеиды, меланины, каротиноиды, флавоны и др. Такие хромопротеиды, как гемоглобин, миоглобин, каталаза, цитохромы, в качестве простетической (т. е. небелковой) группы содержат железопорфириновый комплекс (гем).Под пигментным обменом подразумевают обычно все процессы образования, превращения и распада пигмента крови (гемоглобина), точнее его пигментной небелковой части, и главного деривата этого пигмента – желчного пигмента (билирубина).В ряде случаев отмечается врожденная недостаточность энзимных систем, осуществляющих обмен билирубина, иногда отмечается временное торможение их под влиянием различных токсических и инфекционных факторов. Это приводит к возникновению желтухи. Патология пигментного обмена. При различных заболеваниях у человека могут возникать разные нарушения в обмене гемоглобина. Ярким проявлением расстройств в биосинтетических реакциях являются порфирии, при которых в результате недостаточности соответствующих ферментных систем блокируются те или иные этапы биосинтеза протопорфирина III и гемма
Виды желтух: механическая, печеночно-клеточная, гимолитическая, желтуха новорожденных.
№19 Идиопатические гипербилирубинемии. Диагностические критерии, причины.
В нормальном состоянии концентрация общего билирубина в плазме составляет 0,3-1 мг/дл (1,7-17 мкмоль/л), 75% от общего количества билирубина находится в неконъюгированной форме (непрямой билирубин). В клинике конъюгированный билирубин называют прямым, потому что он водорастворим и может быстро взаимодействовать с диазореагентом, образуя соединение розового цвета, - это и есть прямая реакция Ван дер Берга. Неконъюгированный билирубин гидрофобен, поэтому в плазме крови содержится в комплексе с альбумином и не реагирует с диазореактивом до тех пор, пока не добавлен органический растворитель, например этанол, который осаждает альбумин. Неконъюгированный билирубин, взаимодействующий с азокрасителем только после осаждения белка, называют непрямым билирубином. Когда содержание билирубина превышает норму, говорят о гипербилирубинемии. В зависимости от того, концентрация какого типа билирубина повышена в плазме - неконъюгированного или конъюгированного, - гипербилирубинемию классифицируют как неконъюгированную и конъюгированную. У больных с печёночно-клеточной патологией, сопровождающейся длительным повышением концентрации конъюгированного билирубина, в крови обнаруживают третью форму плазменного билирубина, при котором билирубин ковалентно связан с альбумином, и поэтому его невозможно отделить обычным способом. В некоторых случаях до 90% общего содержания билирубина крови может находиться в этой форме.
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени. Во всех случаях содержание билирубина в крови повышается. При достижении определённой концентрации он диффундирует в ткани, окрашивая их в жёлтый цвет. Пожелтение тканей из-за отложения в них билирубина называют желтухой. Клинически желтуха может не проявляться до тех пор, пока концентрация билирубина в плазме крови не превысит верхний предел нормы более чем в 2,5 раза, т.е. не станет выше 50 мкмоль/л.
№20 Биохимические изменения при печеночно-клеточной, гемолитической, механической желтухах.
Механическая (подпеченочная) желтухаобусловлена вне- или внутрипеченочной обструкцией желчных путей с нарушением оттока желчи либо полным перекрытием общего желчного протока (камень, воспаление, опухоль и т. д.). В этом случае из-за скопления желчи в печени печеночные капилляры растягиваются, гепатоциты сдавливаются и пропускают конъюгированный билирубин в кровеносные капилляры. Уровень конъюгированного билирубина в плазме крови повышается, и при превышении почечного порога (примерно 30 мкмоль/л) в моче появляется билирубин. Уменьшение или исчезновение билирубина в моче указывает на полное или частичное восстановление проходимости желчных путей.
При печеночно-клеточной желтухе, когда повреждена паренхима печени, одновременно повышается уровень конъюгированного и неконъюгированного билирубина. Первопричиной в этой ситуации могут быть нарушение клиренса неконъюгированного билирубина крови, нарушение выделения конъюгированного билирубина из печеночных клеток в желчные капилляры, проникновение конъюгированного билирубина из печеночных капилляров, переполненных желчью, в кровеносные капилляры через разрушенные печеночные клетки. Паренхиматозной бывает желтуха при остром, вирусном гепатите в токсической фазе, токсикозах. Уровень как конъюгированного, так и общего билирубина первично повышается при синдроме Дубина - Джонсона и при синдроме Ротора. Повышенная концентрация конъюгированного билирубина в крови сопровождается увеличенной экскрецией билирубина в мочу. При этой патологии интенсивность билирубинурии усиливается параллельно тяжести заболевания, достигает максимальных значений в разгар болезни, после чего начинает уменьшаться. В начале заболевания билирубин в моче практически не определяется, и этот тест не является ранним диагностическим признаком.
Гемолитическая желтуха характеризуется чрезмерным образованием неконъюгированного билирубина либо его задержкой в организме при нормальном выведении. В плазме крови повышается уровень общего билирубина за счет неконъюгированного билирубина. В моче же билирубин отсутствует, а реакция на уробилиноген положительная.Повышенный уровень неконъюгированного билирубина в сыворотке крови наблюдается при нарушении его метаболизма, в частности, при наследственном нарушении поглощения и транспорта желчных пигментов (синдром Жильбера). У людей с этим синдромом в большинстве случаев постоянно желтушные кожные покровы и слизистые. Причиной этого является неспособность печени захватывать, конъюгировать и выделять билирубин в желчные капилляры. Другой формой наследственной врожденной гипербилирубинемии является болезнь Криглера - Найяра, при которой значительно увеличен уровень неконъюгированного билирубина и может развиться поражение нервной системы.
№21 Физиологическая желтуха новорожденных.
Физиологическая желтуха новорожденных -временная конъюгационная желтуха, возникающая у большинства здоровых новорожденных в первые дни жизни, вследствие того, что эритроциты плода содержат особый вид гемоглобина (Нв F - фетальный) и эти эритроциты после рождения разрушаются. Кроме этого, у новорожденных имеется и дефицит специального белка, который обеспечивает перенос билирубина через мембраны печеночных клеток. Способствует избыточному накоплению билирубина запаздывание созревания ферментативных систем печени, участвующих в превращении непрямого билирубина в прямой. Еще один фактор, влияющий на скорость выведения билирубина из организма – это низкая выделительная способность печени у новорожденных детей. По мере улучшения работы системы выделения билирубина и исчезновения избыточных кровяных клеток из русла крови, желтуха исчезает (обычно через 1-2 недели) и не причиняет никакого вреда ребенку. При выраженной желтухе иногда используют фенобарбитал для ускорения выведения билирубина.
№23 Процессы дегидрирования и их роль в тканевом дыхании. Механизм действия ферментов, участвующих в окислительно-восстановительных реакциях (оксидаз, аэробных и анаэробных дегидрогеназ, гидрокисипероксидаз, оксигеназ).
Тканевое дыхание – это окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды.
Окисление начинается с дегидрирования, т. е. с того, что ферменты дегидразы активируют водород, входящий в состав окисляющегося вещества. Затем происходит окисление водорода до образования воды при участии ферментов оксидаз, которые представляют собой железосодержащие дыхательные ферменты.
Дыхательные ферменты, прочно связанные с клетками, — катализаторы тканевого дыхания, которое служит главным источником энергии. Они отличаются от оксидаз тем, что при их участии только активный О2 воспринимает водород тканей, тогда как при участии оксидаз водород может восприниматься и молекулярным О2. Кроме дегидраз и оксидаз, в окислительных процессах участвуют и другие ферменты, например пероксидазы, влияющие на образование соединений типа перекисей. Эти ферменты активируют О2, способствуют окислению трудно окисляемых в обычных условиях веществ.
Физико-химическая основа окислительных процессов в клетках — перенос электронов ферментами (цитохромами). В клеточном дыхании очень большую роль играет цитохромная система (цитохром + цитохромоксидаза). Цитохромы и флавопротеиды — переносчики водорода. В клеточном дыхании принимают также участие переносчики аминогрупп, фосфата и другие ферменты. Многие ферменты, участвующие в клеточном дыхании, являются производными витаминов группы В (В1, В2 и др.). Кроме того, в восстановительно-окислительных процессах в клетках участвует витамин С.
Таким образом, чрезвычайно сложный процесс клеточного дыхания осуществляется ферментами и витаминами. Интенсивность клеточного дыхания у людей с возрастом снижается.
№24 Цикл трикарбоновых кислот. Химические реакции цикла. Биологическая роль ЦТК.
Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) – центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух-и трехуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO 2. При этом освобожденный водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии – АТФ.
Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций.
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи, локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ. Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Основная роль ЦТК заключается в генерации атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2.
Кроме этого, в ЦТК образуетсяодна молекула АТФ, сукцинил-SКоА, участвующий в синтезе гема, кетокислоты, являющиеся аналогами аминокислот – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой.
№25 Механизмы регуляции ЦТК.
Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалоацетат(субстрат Цикла Кребса) + АДФ + Фн.
№26 Анаболические функции цикла Кребса. Биосинтез гема.
Анаболическая функция — использование субстратов цикла на синтез органических веществ:
Оксалацетат — глюкоза, Асп, Асн.
Сукцинил-КоА — синтез гема.
CО2 — реакции карбоксилирования.
Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо. Порфобилиноген-синтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I.
Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп. Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей заканчивается образованием протопорфириногена IX.
На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно
№27 Строение митохондрий. Дыхательная цепь как полиферментная система транспорта атомов водорода на кислород. Ее структура и роль.
Внешняя мембрана
Внутренняя мембрана
Матрикс м-на, матрикс, кристы. она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Ее толщина около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии, ее матрикс или митоплазму. Характерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист. Расстояние между мембранами в кристе составляет около 10-20 нм. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации. Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2-3 нм) и гранулы около 15-20нм. Теперь стало известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы – митохондриальные рибосомы.
Дыхательная цепь
Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ-синтазы.
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками. К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
№28 Взаимосвязь между циклом Кребса и работой дыхательной цепи митохондрий. Дыхательный контроль
Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н+ и одного ФАДН2.
Дыхательный контроль.
Сопряжение окисления с фосфорилированием в митохондриях отличается прочностью: если невозможен синтез АТФ, то прекращается и перенос электронов в дыхательной цепи. Эти реакции можно изучать in vitro в суспензии митохондрий. Если в инкубационной смеси есть все исходные вещества, за исключением АДФ, то поглощения 02 (дыхания) не наблюдается. После внесения АДФ сразу же начинается и дыхание, и синтез АТФ; по мере расходования АДФ скорость дыхания снижается и совсем прекращается, когда вся АДФ превратится в АТФ.
Зависимость дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Этот механизм регуляции имеет очень важное значение, так как в результате его действия скорость синтеза АТФ определяется потребностью клетки в энергии: при увеличении расходования АТФ в клеточных процессах (реакции, катализируемые синтетазами, транспорт ионов и др.) увеличивается концентрация АДФ, а это автоматически ведет к ускорению дыхания и фосфорилирования. Можно сказать, что темп работы митохондриям задается фактическими затратами АТФ.
Механизм дыхательного контроля отличается высокой чувствительностью и точностью, поэтому относительные концентрации АТФ и АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой (т. е. частота оборотов цикла АДФ-АТФ) может изменяться в десятки раз.Некоторые вещества разобщают окисление и фосфорилирование. Примером может служить 2,4-динитрофенол (рис. 8.6). Это липофильное вещество легко диффундирует через митохондриальную мембрану как в ионизированной, так и в неионизированной форме и, следовательно, может переносить ионы водорода через мембрану в сторону их меньшей концентрации.Потребление кислорода и окисление субстратов при этом продолжаются, но синтез АТФ, естественно, невозможен.
Поскольку энергия окисления при разобщении рассеивается в форме теплоты, то разобщители повышают температуру тела (пирогенное действие).
№29 Роль митохондриальной мембраны в сопряжении процессов окисления и фосфорилирования. Механизм сопряжения окисления и фосфорилирования (хемиосмотическая теория Митчелла).
Известно, что через мембрану митохондрии могут свободно проникать только небольшие незаряженные молекулы, а также гидрофобные молекулы.
Принципиально новый механизм сопряжения дыхания и фосфорилирования был разработан английским биохимиком Митчеллом (1961), гипотеза которого получила название хемиосмотической или протондвижущей. По мнению Митчела, энергия переноса электронов и протонов вдоль дыхательной цепи первоначально сосредоточивается в виде протонного потенциала, или электрохимического градиента ионов Н+, создающегося движением через мембрану заряженных протонов. Диффузия протонов обратно через мембрану сопряжена с фосфорилированием, которое осуществляется Н+ -АТФ-синтетазой. Дыхание совершает осмотическую работу (концентрирует протоны во внешней среде митохондрий) и электрическую (создает разность электрических потенциалов), которая используется АТФ-синтетазой на химическую работу, т.е. синтез АТФ. Движущей силой фосфорилирования является протонный потенциал.
Синтез одной молекулы АТФ из АДФ и фосфата сопровождается проникновением двух протонов из внешней среды внутрь митохондрий. Разность концентраций ионов Н+ выравнивается и происходит разрядкам мембраны (исчезает электрический потенциал).
Хемиосмотическая система Митчела не требует каких-либо высокоэнергетических посредников между дыханием и фосфорилированием. Общим продуктом для двух процессов является протонный потенциал. Нарушение структурной целостности мембраны или повреждение её проницаемости для протонов делает невозможным образование протонного потенциала, что вызывает разобщение между дыханием и фосфорилированием.
№30 Коэффициент сопряжения окисления и фосфорилирования.
В Цикле Кребса образуется 3 NADH, каждый имеет по 1 протону. В итоге образуется 3 АТФ, а FAD в Цикле Крэбса обрз-ся1, он имеет 2 протона=>даёт 2АТФ.
Работу дых.цепи характер-ет k сопряжения окислительн. фосфорилирован.-P/O: показыв-ет отношение кол-ва потреблённого неорганич.фосфата, идущего на синтез АДФ к атому O, поглощённого в процессе дыхания. Для NADH=3, для FAD=2.
№31 Разобщение окисления и фосфорилирования
Разобщение дыхания и фосфорилирования- это процесс переноса некторыми хим. вещ-ва(протонофорами) протонов или др. ионов(ионофоры) из межмембр.прострн-ва в матрикс, минуя протонные каналы АТФ-синтазы. В рез-те этого исчез-ет Эл/хим потенциал и прекращ-ся синтез АТФ. => кол-во АТФ сниж-ся, АДФ-увелич. В этом случае скор-ть окисл. NADH и FADH2 => кол-во поглощён-го О2 ув., но Е выд-ся в виде теплоты и K P/О сниж-ся
Разобщители:
Естественные-термогенин-образ. В мемб. H+ каналы, не связан с АТФ-синтазным комплексом.
Липофильные анионы:
1)эндогенные-анионы жирн.к-т Ув. При инт.физ.нагрзке, голодан
*косвенные-гормоны щит.железы-стимулир.распад жировой тк.; стероидн.горм(женские), билирубин
2)экзогенные-токсич вещ-ва, лек.преп( динитрофенол, барбитураты)
№32 Термогенная характеристика энергетического обмена в бурой жировой ткани.
Буровая ж.ткань – особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования, содержащая много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на разобщающий белок (РБ-1)- термогенин. По своей структуре темогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями. На внешней стороне анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембране диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующий анион возвращается на наружную сторону мембраны с помощью АТФ/АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только теплом, но и важнейшим регулятором разобщения дыхания и фосфорилирования.
№33 Значение убихинона в работе дыхательной цепи митохондрий