Учебно-методическое пособие
ЛАБОРАТОРНЫЕ РАБОТЫ
ПО КУРСУ
БИОЛОГИЧЕСКАЯ ХИМИЯ
Учебно-методическое пособие
Специальность: 050102 – «Биология»
Череповец 2006
Рассмотрено на заседании кафедры биологии и общей экологии, протокол № от 00.00.06 г.
Одобрено редакционной комиссией Физико-математического факультета ЧГУ, протокол № от г.
С о с т а в и т е л ь: И.А. Непорожняя
Р е ц е н з е н т ы:
Н а у ч н ы й р е д а к т о р: Н.П. Коломийцев, канд. биол. наук, доцент
Ó Череповецкий государственный университет,
Введение
Данное пособие предназначено для студентов II курса специальности «Биология». Пособие включает в себя темы: «Белки», «Количественные методы в биохимии», «Ферменты», «Витамины», «Нуклеиновые кислоты», «Фотосинтез», «Углеводы. Липиды», «Химия молока». В пособие включены лабораторные работы, которые могут быть выполнены в течение 4 ч, отводимых для занятия.
Выполнение данных лабораторных работ будет способствовать усвоению студентами теоретического курса «Биологической химии», развитию способности к мышлению и наблюдательности, развитию практических навыков биохимического эксперимента. Теоретической основой лабораторного занятия является краткое изложение программных вопросов по данной теме, указаны объекты исследования, оборудование и реактивы, инструкция по проведению эксперимента.
В ходе выполнения лабораторной работы каждый студент заполняет протокол работы, включающий: название темы, работы, исследуемый материал, оборудование, реактивы, краткое описание хода работы, результаты исследования. Необходимые рисунки, схемы оформлять в разделе ход работы. По окончании каждой работы необходимо записывать выводы.
Лабораторные работы в данном учебном пособии подобраны с учетом технических возможностей кафедры. В конце пособия находится приложение с описанием приготовления реактивов. Лабораторные работы разработаны на основании государственного образовательного стандарта высшего профессионального образования по дисциплине «Биологическая химия». – М.: Государственный комитет РФ по высшему образованию, 2005, для специальности 050102 – «Биология».
Особенности работы в биохимической лаборатории и инструктаж по технике безопасности
Приступая к выполнению практических занятий, следует изучить теоретический материал по учебной литературе, внимательно ознакомиться с содержанием очередного лабораторного занятия.
Работа с биологическим материалом (кровь, моча, слюна, желудочный сок, гомогенаты тканей) должна выполняться в медицинских перчатках. Следует использовать автоматические дозаторы, бюретки и мерные цилиндры. Стеклянные пипетки в области контакта со ртом перед работой обработать этанолом.
Следует использовать реагенты, маркировка которых указана на этикетке (вещество, концентрация, дата изготовления). Работа с концентрированными кислотами и щелочами, ядовитыми и огнеопасными веществами производится в вытяжном шкафу. Реагенты использовать экономно, химические реактивы необходимо брать только чистыми инструментами, после взятия необходимого количества банку с реактивом закрыть предназначенной для нее крышкой.
Все электрические приборы должны быть исправными и надежно заземленными. В рабочем состоянии крышки термостатов, сухожаровых шкафов, центрифуг должны быть закрыты. Распределительный электрический щит, к которому подключены приборы, включается только в присутствии и под контролем преподавателя.
В лабораторные центрифуги помещают парное (четное) количество тщательно уравновешенных пробирок. Ось симметрии между двумя пробирками должна проходить через ось ротора. Перед включением и в процессе работы роторная камера центрифуги должна быть закрыта. Камера может быть открыта только после полной остановки ротора.
Нельзя нагревать посуду из простого химического стекла на открытом пламени. Нагревание огнеупорных пробирок на пламени спиртовки следует производить на уровне верхней границы жидкости, при этом отверстие пробирки должно быть направлено в безопасную сторону, пробирку держат с помощью держателя. Огнеопасные вещества следует нагревать только на водяной бане (не в коем случае не на открытом пламени!), контролируя наличие воды. Спиртовки гасить колпачком и следить за правильным положением фитиля.
Работу на измерительной аппаратуре следует производить в присутствии преподавателя или ответственного лаборанта кафедры, предварительно ознакомившись с правилами работы и техникой безопасности.
Необходимо аккуратно обращаться с лабораторной посудой, чтобы в случае ее повреждения не получить травму. О любых ситуациях, способных нанести вред здоровью, незамедлительно информировать преподавателя. После завершения работы убрать рабочее место, отключить электричество, а также убедиться, что краны холодной и горячей воды закрыты.
Тема 1
БЕЛКИ
(4 ч)
Работа 1.Цветные реакции на белки и аминокислоты.
Цветные реакции дают возможность обнаружить присутствие белка в биологических жидкостях и получить представление о его аминокислотном составе.
Биуретовая реакция открывает пептидную связь в белке. Её способны дать вещества, которые содержат не менее двух пептидных связей.
Нингидриновая реакция характерна для α-аминогрупп. Нингидриновая реакция используется для количественного определения α-аминокислот в аминокислотных анализаторах.
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот – триптофана, фенилаланина, тирозина, содержащих бензольное ядро.
Реакция Миллона открывает в белке циклическую аминокислоту тирозин. Белки, не содержащие тирозин этой реакции не дают.
Реакция Фоля указывает на присутствие в белке аминокислот цистина и цистеина, содержащих слабосвязанную серу. Метионин, хотя и является содержащей серу аминокислотой, этой реакции не дает, поскольку сера в нем связана прочно.
Исследуемый материал: раствор яичного белка (способ приготовления в приложении).
Оборудование: градуированная пипетка объемом 1 мл, пипетки, мерный цилиндр – 10 мл, цилиндрические маленькие пробирки 10 шт, стеклянные палочки, пробиркодержатель, штатив, спиртовка.
Реактивы: 1) 10% раствор NaOH, 2) 1% раствор CuSO4, 3) 0,5% раствор нингидрина, 4) HNO3 (конц), 5) реактив Миллона, 6) реактив Фоля, 7) дистиллированная вода.
Ход работы
Провести цветные реакции на исследуемом растворе яичного белка. Полученные результаты оформить в виде таблицы:
| Реагент | Количество реагента, капель | |
| Опыт | Контроль | |
| Биуретовая реакция | ||
| Раствор белка | - | |
| Вода | - | |
| NaOH, 10% | ||
| CuSO4, 1% | ||
| Наблюдение окрашивания | ||
| Нингидриновая реакция | ||
| Раствор белка | - | |
| Вода | - | |
| Раствор нингидрина | ||
| Кипятить 1-2 минуты | ||
| Наблюдение окрашивания | ||
| Ксантопротеиновая реакция | ||
| Раствор белка | - | |
| Вода | - | |
| HNO3, конц. | ||
| Кипятить до появления окраски раствора белка | ||
| Наблюдение окрашивания | ||
| Реакция Миллона | ||
| Раствор белка | - | |
| Вода | - | |
| Реактив Миллона | ||
| Нагреть до окрашивания осадка белка | ||
| Наблюдение окрашивания | ||
| Реакция Фоля | ||
| Раствор белка | - | |
| Вода | - | |
| NaOH, 30% | ||
| (CH3COO)2Pb, 5% | ||
| Кипятить до появления окрашивания | ||
| Наблюдение окрашивания |
Работа 2. Реакции осаждения белков.
Реакции осаждения белков могут быть обратимыми и необратимыми. В первом случае белки не подвергаются глубоким изменениям, поэтому получаемые осадки могут быть вновь растворены в первоначальном растворителе с сохранением своих нативных свойств. При необратимых реакциях осажденные белки подвергаются глубоким изменениям — денатурации.
Реакции осаждения дают возможность: 1) изучить свойства белков; 2) освободить жидкость от присутствия белка; 3) установить наличие белка в биологических жидкостях, например в моче; 4) высаливанием с помощью различных концентраций нейтральных солей или спиртом выделить отдельные белковые фракции.
Реакция высаливания (осаждения белков с помощью высоких концентраций нейтральных солей) обусловлена дегидратацией макромолекул белка с одновременной нейтрализацией электрического заряда. Для высаливания различных белков требуется неодинаковая концентрация одних и тех же солей. Глобулины, имеющие большую молекулярную массу, легче высаливаются, чем альбумины. Глобулины осаждаются в полунасыщенном, а альбумины — в насыщенном растворе сернокислого аммония.
Осаждение белков солями тяжелых металлов (в отличие от высаливания) происходит при небольших концентрациях солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя с ними солеобразные и комплексные соединения, растворимые в избытке этих солей (за исключением солей AgNO3, HgCl2), но нерастворимые в воде. Соли тяжелых металлов вызывают необратимое осаждение белков, т.е. денатурацию.
Концентрированные минеральные кислоты вызывают денатурацию белка. Выпадение белка в виде осадка связано с денатурацией белковых частиц и образованием комплексных солей белка с кислотами. Ортофосфорная кислота (H3PO4) осадка не дает. В избытке всех минеральных кислот, за исключением азотной (HNO3), выпавший в осадок белок растворяется.
Органические кислоты вызывают необратимое осаждение белков, чаще используют растворы трихлоруксусной и сульфосалициловой кислот. Кроме белков она осаждает также продукты их распада — высокомолекулярные пептоны и полипептиды. Трихлоруксусная кислота способна осаждать только белки и не осаждает продукты распада белков.
В органических растворителях (этанол, ацетон и др.) белки не растворяются и выпадают в осадок. В зависимости от природы белка для его осаждения требуются различные концентрации спирта. Этанол связывает воду, вызывая дегидратацию мицелл белка и неустойчивость их в растворе. При осаждении этанолом раствор белка должен быть нейтральным или слабокислым, но не щелочным. Реакция облегчается присутствием электролита хлористого натрия вследствие снятия заряда с частиц белка. Реакция осаждения белка этанолом или кратковременным действием этанола обратима при охлаждении. Если осадок быстро отделить от этанола, то белок может сохранить нативное состояние.
Осаждение белков алкалоидными реактивами также относится к необратимым реакциям. К группе алкалоидных реактивов принадлежат танин, пикриновая кислота и др. Механизм осаждения белков алкалоидными реактивами связан с образованием нерастворимых солеобразных соединений с основными азотсодержащими группами белка. Белки — протамины и гистоны, несущие положительный заряд, хорошо осаждаются алкалоидными реактивами в нейтральной среде без подкисления.
Исследуемый материал: раствор яичного белка (способ приготовления в приложении).
Оборудование: градуированная пипетка объемом 1 и 5 мл, пипетки, мерный цилиндр – 10 мл, цилиндрические маленькие пробирки 15 шт, стеклянные палочки, спиртовка, воронка, фильтровальная бумага, штатив для пробирок, пробиркодержатель.
Реактивы: 1) 1% раствор СН3СООН, 2) 10% раствор NaOH, 3) NaCl (порошок), 4) насыщенный раствор NaCl, 5) (NH4)2SO4 (порошок), 6) насыщенный раствор (NH4)2SO4 , 7) 10% раствор CuSO4, 8) 5% раствор (CH3COO)2Pb, 9) HNO3 (конц.), H2SO4 (конц.), 10) 10% раствор трихлоруксусной кислоты, 11) 20% раствор сульфосалициловой кислоты, 12) насыщенный раствор пикриновой кислоты, дистиллированная вода.
Ход работы
Провести реакции осаждения белка различными способами.
Опыт 1. Осаждение белков кипячением
| № пробы | Раствор белка, капель | Ход анализа | Результат | Вывод |
| Нагреть до кипения | ||||
| Нагреть до кипения+1капля раствора СН3СООН | ||||
| 5капель раствора СН3СООН+кипячение | ||||
| 5капль раствора СН3СООН+2капли насыщ. раствора NaCl+ кипячение | ||||
| 2капли раствора NaOH+ кипячение |
Опыт 2. Осаждение белков при комнатной температуре нейтральными солями – высаливание
| Реагенты, условия опыта | Количество реагента, мл | |
| Опыт А | Опыт Б | |
| Раствор белка | ||
| NaCl, порошок | До насыщения | - |
| (NH4)2SO4, насыщенный раствор | - | |
| Отфильтровать | Через 10 мин. на фильтре глобулины | Без инкубации на фильтре глобулины |
| Исследуется фильтрат | ||
| (NH4)2SO4, порошок | - | До насыщения |
| Результат | Исследуется после кипячения |
Во втором варианте после осаждения альбуминов надосадочную жидкость проверяют на отсутствие белка с помощью биуретовой реакции.
Опыт 3. Осаждение белков солями тяжелых металлов
К 5 каплям раствора яичного белка осторожно прибавить 1 каплю раствора сульфата меди (II). Образуется бледно-голубой осадок, нерастворимый в воде. К другой такой же порции раствора белка прилить вначале 1 каплю раствора сульфата меди (II), а затем еще 10 капель и наблюдать растворение осадка в избытке реактива. К 5 каплям раствора яичного белка прибавить 2 капли раствора ацетата свинца (II), образуется осадок, нерастворимый в воде, но легко растворяющийся в избытке осадителя.
Опыт 4. Осаждение белков концентрированными минеральными кислотами.
К 5 каплям концентрированной азотной кислоты осторожно по стенке пробирки прилить 5 капель раствора белка так, чтобы обе жидкости не смешивались. На границе двух жидкостей образуется осадок в виде небольшого белого кольца (проба Геллера). Осторожно встряхнуть пробирку и добавить избыток азотной кислоты: осадок не исчезает, так как в избытке азотной кислоты он не растворяется. Осаждение серной кислотой проводится аналогично реакции с азотной кислотой. К 5 каплям концентрированной серной кислоты осторожно по стенке пробирки прилить 5 капель раствора белка. Образуется осадок, растворимый в избытке серной кислоты (при встряхивании).
Опыт 5. Осаждение белков органическими веществами:
а) органическими кислотами: к 5 каплям раствора белка добавить 2 капли раствора сульфосалициловой кислоты. Выпадает осадок белка. К 5 каплям раствора белка добавить 2 капли раствора трихлоруксусной кислоты. Выпадает осадок белка;
б) спиртом: к 5 каплям раствора белка прилить 15—20 капель этанола. Раствор мутнеет. Добавить 1 каплю насыщенного раствора хлористого натрия. Наблюдается выпадение осадка;
в) алкалоидными реактивами: к 5 каплям раствора белка добавить 2 капли насыщенного раствора пикриновой кислоты и 2 капли раствора уксусной кислоты. Выпадает осадок белка.
Тема 2
КОЛИЧЕСТВЕННЫЕ МЕТОДЫ В БИОХИМИИ
(4 ч)
Работа 3 . Хроматографический метод разделения смесей.
Хроматография – это метод, применяемый для разделения различных смесей на составляющие их компоненты. Метод основан на том, что в неподвижной среде, через которую протекает растворитель, каждый из компонентов, увлекаемых растворителем, движется со своей собственной скоростью независимо от других. В зависимости от природы используемой неподвижной среды выделяют разные типы хроматографии и различные модификации хроматографических методов: адсорбционная, распределительная, ионообменная, фронтальная ионообменная хроматографии.
Исследуемый материал: метиловый оранжевый (защищенный), фломастеры.
Оборудование: хроматографическая бумага, чашка Петри, пипетка, хроматографическая камера, ножницы, карандаш, линейка.
Реактивы: 1) 10% раствор NH3, 2) дистиллированная вода.
Ход работы
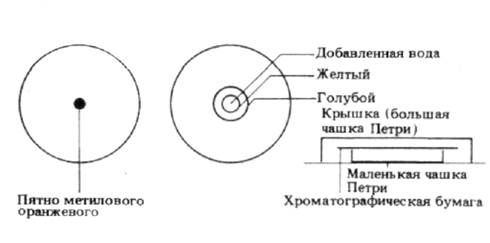
Опыт 1. Разделение индикаторов. Нанесите каплю защищенного метилового оранжевого в центр хроматографической бумаги. Высушите бумагу при комнатной температуре, немного подержите ее над открытой бутылкой раствора аммиака и затем положите на чашку Петри (рис.1).Капните одну каплю воды на пятно индикатора.
|
Рис.1 Хроматографическое разделение метилового оранжевого.
Два индикатора, содержащиеся в растворе метилового оранжевого, двигаются центробежно с разными скоростями, причем синее кольцо двигается быстрее желтого. Синее кольцо - это индикатор бромтимоловый синий, а желтое - метиловый оранжевый.
Опыт 2. Разделение цветных чернил на составляющие компоненты. На прямоугольнике из хроматографической бумаги на расстоянии 1 см от края проведите карандашом линию. Разметьте стартовую лилию крестиками через равные интервалы; на каждый цвет чернил должно приходиться по одному крестику. Фломастерами с водорастворимыми чернилами разных цветов нанесите на каждый крестик по пятну чернил разного цвета и под каждым пятном отметьте его местоположение карандашом. Пятно должно быть не более 2 мм в диаметре. Высушите пятна.
Подвесьте бумагу в хроматографическую камеру таким образом, чтобы стартовая линия находилась около поверхности растворителя, а конец бумаги был
погружен в растворитель. Растворителем служит дистиллированная вода. Продолжайте хроматографию до тех пор, пока фронт растворителя не окажется на расстоянии 1 см от верхнего края бумаги. Выньте хроматограмму и высушите ее, предварительно отметив карандашом положение фронта растворителя (рис. 2).
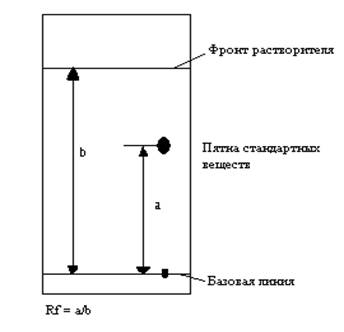
Рис. 2 Движение растворителя и вещества при хоматографии
При хроматографии подвижность растворенного вещества относительно фронта растворителя постоянна для данного вещества. Это выражается величиной Rf:
Расстояние, пройденное растворенным веществом
Rf = ------------------------------------------------------------------
Расстояние, пройденное фронтом растворителя.
Вычислите Rf для каждого цвета.
Работа 4. Разделение аминокислот методом тонкослойной ионообменной хроматографии.
Разделение аминокислот из их смеси производят на катионообменной синтетической смоле, на которую нанесен сильный катионит в натриевой форме. При нанесении образца на пластинку все аминокислоты должны сорбироваться в стартовой позиции путем их обмена с катионом натрия. Следовательно, все аминокислоты в исходной пробе должны быть в форме катионов, что достигается доведением наносимого раствора до рН<2.2. Степень удержания аминокислот смолой зависит от степени диссоциации основных и кислотных групп аминокислот, от числа этих групп в молекуле, от способности к гидрофобным взаимодействиям со смолой и некоторых других условий. Ароматические и основные аминокислоты (арг, гис, лиз, фен, тир), а также лейцин прочно удерживаются на катионите. Для их разделения применяют пропускание нитратного буфера рН 5.25 с концентрацией Na+ 0.35 моль через слой смолы. В этих условиях все остальные аминокислоты (кислые и нейтральные) приобретают высокую подвижность и идут с фронтом растворителя. Для выявления отдельных аминокислот пластинку опрыскивают раствором нингидрина. Появляются фиолетовые пятна аминокислот, располагающиеся по всей длине пластинки по степени возрастания подвижности аминокислот. Полуколичественная оценка содержания аминокислоты в смеси достигается путем сравнения величины пятна из анализируемого образца с пятном соответствующей стандартной аминокислоты.
Исследуемый материал: растворы аминокислот.
Оборудование: хроматографическая камера, пластинки для ТСХ
Реактивы: 1) стандартная смесь аминокислот, 0.01 н. НС1, 2) цитратный буфер рН 5.28, 3) нингидриновый реактив
Ход работы
На пластинке мягким карандашом отмечают линию старта на расстоянии 1.5-2.0 см от нижнего края. На этой линии через равные промежутки отмечают 7 точек для нанесения растворов аминокислот. С помощью капилляров наносят по 1.5 мкл (3 касания) рабочих растворов каждой из шести аминокислот и смеси аминокислот (одно касание — 0.5 мкл, что соответствует 2*10-3 мкмоль каждой аминокислоты). Между касаниями пятно подсушивают. Нельзя царапать слой катионита капилляром! Таким образом, впервые шесть точек внесены последовательно арг, гис, лиз, фен, тир, лей, а в седьмую — смесь аминокислот.
В камеру для хроматографии наливают цитратный буфер с рН 5.28 на высоту 1 см и помешают пластинку с нанесенными образцами. Стартовая позиция смеси аминокислот должна быть выше уровня налитого буферного раствора. Для разделения аминокислот буфер должен подняться по пластинке ровным фронтом на высоту 15 см. Для этого требуется около 2 ч. Процесс разделения можно значительно ускорить, предварительно пропитав пластинки разбавленным (в 10 раз) буфером и высушив их.
По окончании разделения пластинки вынимают из сосуда с буфером, нижние кромки следует промокнуть фильтровальной бумагой и пластинки высушить в вытяжном шкафу при комнатной температуре. Затем их устанавливают в наклонном положении в вытяжном шкафу и опрыскивают из пульверизатора нингидрином до равномерного пропитывания. Потом их снова высушивают и прогревают в термостате при 40-50 °С 20 мин. Выявляются фиолетовые пятна аминокислот (снизу вверх): арг, гис, лиз, фен, тир, лей. Необходимо сравнить положение пятен стандартных растворов аминокислот с положением их при хроматографировании смеси аминокислот. Хроматограмму зарисовать в тетради.
Работа 5. Очистка белков методом диализа.
Диализ — освобождение коллоидов от низкомолекулярных органических и минеральных примесей с помощью диффузии последних через мембраны. Белки в растворе благодаря значительной величине молекул не диффундируют сквозь полупроницаемую мембрану.
Исследуемый материал: раствор яичного белка.
Оборудование: пипетки, мерный цилиндр – 50 мл, цилиндрические маленькие пробирки 4 шт, стеклянные палочки, штатив для пробирок, химический стакан, нитки, целлофан, спиртовки, пробиркодержатель, кристаллизатор.
Реактивы: 1) 10% раствор NaOH, 2) 1% раствор CuSO4, 3) Феллингова жидкость, 4) 1% раствор яичного белка с примесью 1% раствора глюкозы, 5) дистиллированная вода.
Ход работы
Наливают 15-20 мл исследуемого раствора в целлофановый мешочек и погружают его в стакан с дистиллированной водой таким образом, чтобы открытый край мешочка выступал над поверхностью воды. Через 1 ч с водой из стакана и раствором белка, содержащим примесь углеводов, проделывают биуретовую реакцию (на белок) и реакцию Феллинга (на глюкозу), чтобы убедиться в отсутствии белка и наличии глюкозы в воде из стакана.
Биуретовая реакция. К 5 каплям исследуемого раствора прибавить 3 капли 10% раствора гидроксида натрия и 1 каплю 1% раствора сульфата меди (II), перемешать. Содержимое пробирки приобретает сине-фиолетовый цвет, что указывает на присутствие белка в растворе.
Реакция Феллинга. К 5 каплям исследуемого раствора прибавить 5 капель феллинговой жидкости и нагреть. Наблюдается образование оксида меди (I) красного цвета (Cu2O), что указывает на присутствие глюкозы в растворе.
Работа 6. Методы количественного определения белка на примера биуретовой реакции.
Для количественного определения белков применяют физические, химические и биологические методы.
Наибольшее распространение из физических методов количественного определения белков получили три: рефрактометрический (по показателю преломления белковых растворов), спектрофотометрический (по поглощению в ультрафиолетовой области спектра) и полярографический (по кривым, показывающим зависимость между силой тока и напряжением, приложенным к системе, содержащей белок). Пикнометрический метод (по плотности белковых растворов) употребляется редко.
Химические методы количественного определения белков разнообразны. Наиболее простым химическим методом определения белка является количественное определение общего или белкового (после осаждения белка и отделения его от растворимых азотсодержащих веществ) азота. Умножая величину процентного содержания общего азота на коэффициент 6.25 (среднее содержание азота в белках—16%, отсюда 100:16 = 6.25), получают данные о содержании сырого протеина. Проделывая ту же операцию с величиной, характеризующей содержание белкового азота, получают данные о количестве белка. Эти способы условны, так как дают приблизительную оценку о количестве белка.
Биологические методы количественного определения белков применимы лишь к белкам, обладающим ферментативной и гормональной активностью. Измеряя степень биологической активности препарата, можно составить представление о содержании в нем белка, обладающего данной активностью. Этот метод тоже не дает абсолютных результатов.
Самым распространенным химическим методом количественного определения белков является колориметрический метод. Он основан на измерении интенсивности окраски цветных реакций, развивающихся при взаимодействии белков с тем или иным специфическим реагентом. Чтобы рассчитать концентрацию белка, в этом случае строят калибровочный график.
Биуретовый метод основан на способности растворов белка давать фиолетовое окрашивание при взаимодействии с раствором сульфата меди в щелочной среде. Интенсивность окраски пропорциональна концентрации белка в растворе.
Материал для исследования: растворы яичного белка концентрации 5, 10 и 15 мг/мл, и раствор белка неизвестной концентрации.
Оборудование: штативы с пробирками; бюретки для биуретового реактива; склянки с растворами белка; пипетки на 1 мл; ФЭК с кюветами с толщиной слоя 1 см, миллиметровка.
Реактивы: биуретовый реактив.
Ход работы.
1. В первые 3 пробирки помещают стандартные растворы с содержанием белка 5, 10 и 15 мг в 1 мл. Эти пробирки служат для построения калибровочной кривой. В 4-ю пробирку наливают раствор с неизвестной концентрацией белка, которую нужно определить.
2. В каждую пробирку добавляют по 4 мл биуретового реактива. Содержимое пробирок хорошо перемешивают и оставляют при комнатной температуре на 20 мин для развития окраски. Окрашенные растворы колориметрируют на ФЭКе в кюветах с толщиной слоя 1 см, пользуясь зеленым светофильтром (длина волны 540 нм). В качестве контрольного раствора при измерении на ФЭКе используют биуретовый реактив.
3. Строят калибровочный график, откладывая на оси абсцисс концентрации стандартных растворов белка, а на оси ординат - соответствующие значения оптической плотности. Зная оптическую плотность раствора белка с неизвестной концентрацией, по калибровочной кривой определяют в нем содержание белка.
Записывают принцип метода; зарисовывают калибровочный график зависимости оптической плотности от концентрации стандартного раствора белка. Пользуясь этим графиком, рассчитывают содержание белка в испытуемом растворе и записывают результат.
Тема 3
ФЕРМЕНТЫ
(4 ч)
Работа 7. Ферменты как биологические катализаторы.
Ферменты, энзимы – специфические белки всех живых клеток, играющие роль биологических катализаторов. С их помощью осуществляется обмен веществ и энергии в организмах.
Свойства ферментов
1. Все ферменты белковой природы (простые и сложные).
2. Все ферменты характеризуются термолабильностью, т. е. оптимум действия 0°- 45°С.
3. Ферменты специфичны; различают абсолютную и относительную специфичность.
4. Ферменты действуют в мягких условиях среды, с определенным значением рН.
5. Ферменты обладают высокой каталитической активностью (например, холинэстераза за 1 сек расщепляет 300000 молекул ацетилхолина).
Исследуемый материал: раствор слюны.
Оборудование: пипетки, мерный цилиндр – 50 мл, цилиндрические маленькие пробирки 15 шт, стеклянные палочки, штатив для пробирок, химический стакан, пробиркодержатель, спиртовка, спички.
Реактивы: 1) 1% раствор крахмала, 2) 10% раствор NaOH, 3) 1% раствор CuSO4, 4) фосфатный буфер, 5) 1% раствор NaCl, 6) водный раствор I2 в КI.
Ход работы
Для исследования активности амилазы слюны и ее свойств используют собственную слюну, разведенную в 10 раз. Для этого в мерную пробирку собирают 1 мл слюны (предварительно полость рта ополаскивают водой) и доводят до метки 10 мл.
Опыт 1.Определение термолабильности амилазы слюны.
| Реагенты, условия опытов | Количество реагента, капель | ||
| Опыт А | Опыт Б | Контроль | |
| Раствор слюны | - | - | |
| Кипяченая слюна (кипятить 2 мл раствора слюны 5-8 мин, охладить) | - | - | |
| Вода | - | - | |
| Крахмал | |||
| Термостат, 38ºC, 10 мин | |||
| Реакция с иодом (5 капель раствора из пробирки + 1капля I2 в КI), окраска | |||
| Реакция Троммера (5 капель раствора из пробирки + 5 капель 10% NaOH + 3 капли 1% CuSO4, кипятить 1 мин), окраска | |||
| Вывод: |
Опыт 2. Влияние температуры на скорость ферментативной реакции.
| Реагенты, условия опытов | Проба 1 | Проба 2 | Проба 3 | Проба 4 |
| Крахмал, мл | ||||
| Раствор слюны, мл | ||||
| Температура, ºC | ||||
| Инкубировать 10 мин и затем добавить по 1-2 капли I2 в КI | ||||
| Зарегистрировать окрашивание |
Опыт 3. Определение оптимума рН для действия амилазы.
| Условия опытов Реагенты | Значение рН | |||||
| 6.0 | 6.4 | 6.8 | 7.2 | 7.6 | 8.0 | |
| Буферный раствор, мл | ||||||
| Крахмал, 0,5%, мл | ||||||
| Раствор слюны, мл | ||||||
| Термостат, 38ºC, 10 мин | ||||||
| Раствор I2 в КI, капель | ||||||
| Окраска | ||||||
| Вывод: |
Опыт 4. Влияние активаторов и ингибиторов на активность амилазы.
| Реагенты, условия опытов | Количество реагента | ||
| Проба 1 | Проба 2 | Контроль | |
| Раствор слюны, мл | |||
| Вода, капель | - | - | |
| NaCl, капель | - | - | |
| CuSO4 , капель | - | - | |
| Крахмал, капель | |||
| Экспозиция, 5 мин | |||
| Раствор I2 в КI, капель | |||
| Результат, окраска | |||
| Вывод: |
Работа 8. Свойства ферментов
Исследуемый материал: раствор слюны, срезы клубней вареного и сырого картофеля.
Оборудование: пипетки, мерный цилиндр – 50 мл, цилиндрические маленькие пробирки 10 шт, стеклянные палочки, штатив для пробирок, химический стакан, пробиркодержатель, спиртовка, спички.
Реактивы: 1) 1% раствор крахмала, 2) Феллингова жидкость, 3) 1% раствор сахарозы, 4) гваяковая настойка, 5) NaI (порошок), 6) NaCl (порошок), 7) КClO3 (порошок), 8) фильтрат дрожжей.
Ход работы
Опыт 1.Специфичность действия ферментов
Для действия ферментов характерна специфичность: а) абсолютная — фермент катализирует превращение строго определенного вещества (уреаза расщепляет только мочевину на СО2 и NH3); б) относительная — фермент катализирует превращения одного типа связей в ряду близких по химическому строению веществ (например, липаза катализирует разрыв сложноэфирных связей независимо от типа радикала); в) групповая относительная — то же, но для разрыва связи важны образующие ее атомные группировки. Все протеолитические ферменты расщепляют пептидные связи, но пепсин, трипсин и химотрипсин расщепляют пептидные связи, образованные только определенными аминокислотами; г) стереохимическая — фермент катализирует превращение только одного стереоизомера при наличии рацемата (L-оксидазы превращают L-аминокислоты, но не D-аминокислоты).
Приготовить раствор слюны - 1мл слюны + 4 мл воды.
| Реагенты, условия опытов | Количество реагента, капель | |||
| Проба 1 | Проба 2 | Проба 3 | Проба 4 | |
| Раствор слюны | - | - | ||
| Фильтрат дрожжей | - | - | ||
| Крахмал | - | - | ||
| Сахароза | - | - | ||
| Термостат, 37ºC, 10 мин | ||||
| Реакция Феллинга (по 5 капель раствора из каждой пробирки+3 капли реактива Феллинга, кипятить 1 мин), окраска | ||||
| Вывод: |
Опыт 2. Исследование свойств фермента тирозиназы из картофеля.
Тирозиназа – фермент, окисляющий аминокислоту тирозин в темный пигмент за счет кислорода. Этот фермент может окислить и гвоякову смолу. В результате образуется озонид синего цвета.
| Реагенты, условия опытов | Срез сырого картофеля | Срез вареного картофеля |
| Гваяковая настойка, капель | ||
| Результат | ||
| Вывод |
Опыт 3. Ингибирующее действие хлорид-ионов на дегидрогеназный комплекс картофеля.
Хлорид-ионы ингибируют дегидрогеназный комплекс и в их присутствии поверхность среза картофеля остается без изменений; в остальных случаях она - темнеет.
| Срезы клубней картофеля | Нанесение порошка | Результат, окраска (15-20 мин) | Вывод |
| - | |||
| NaCl | |||
| NaI | |||
| КClО3 |
Тема 4
ВИТАМИНЫ
(8 ч)
Работа 9. Качественные реакции на витамины.
Витамины — это низкомолекулярные органические соединения различной химической природы, необходимые для осуществления жизненно важных биохимических и физиологических процессов в живых организмах. При этом витамины не используются для пластических и энергетических нужд организма. Человек в сутки потребляет около 600 г пищи (в пересчете на сухое вещество), из этого количества на долю витаминов приходится 100-200 мг. В настоящее время существует несколько номенклатур витаминов: 1) по предложению Э. Мак-Коллума (1913 г.), их обозначают латинскими буквами А, В, С, D, Е, К и др.; 2) наименование по физиологическому действию — к названию болезни, которую предупреждает или излечивает витамин, добавляется приставка aнmu- (антискорбутный, антигеморрагический, антистерильный и др.); 3) химическое наименование.
В 1974 г. принята временная классификация витаминов.
Витамины, растворимые в воде: В1 — тиамин, антиневротический; В2 — рибофлавин, витамин роста; В3 — пантотеновая кислота, антидерматитный; В5 (РР) — никотиновая кислота, антипеллагрический; В6 — пиридоксол, антидерматитный; В12 — цианкобаламин, антианемический; Вс — фолиевая кислота, антианемический; Н -биотин, антисеборейный; С — аскорбиновая кислота, антискорбутный; Р — рутин, капилляроукрепляющий.
Витамины, растворимые в жирах: А — ретинол, антиксерофтальмический; D — кальциферол, антирахитический; Е — токоферол, антистерильный; К — филлохинон, антигеморрагический;
Витаминоподобные вещества: холин, липоевая кислота, оротовая кислота, витамин В15, инозит, ПАБК (парааминобензойная кислота), карнитин, витамин U.
Биологическое действие большинства витаминов сводится к участию их в ферментативных реакциях в качестве кофакторов ферментов (коферментная функция). Для витаминов, растворимых в воде, известны антивитамины. Это аналоги витаминов, которые оказывают противоположное витаминам действие (например, антивитамином тиамина является окситиамин). Среди жирорастворимых витаминов антивитамины известны только к витамину К — производные кумарина (дикумарин, варфарин, тромексан).
Недостаточное поступление витаминов с пищей вызывает заболевания, называемые гиповитаминозами. При отсутствии одного из витаминов в пище развивается авитаминоз, при недостатке нескольких — полигиповитаминозы, а при их отсутствии в пище — полиавитаминозы. При чрезмерном введении витаминов (как правило, жирорастворимых) могут развиваться гипервитаминозы.
Исследуемый материал: фармакопейные препараты витаминов А, С, Е, D, Р, В1, В6, В12, викасола.
Оборудование: пипетки, мерный цилиндр – 10 мл, цилиндрические маленькие пробирки 10 шт, стеклянные палочки, штатив для пробирок, пробиркодержатель, спиртовка, спички, воронка, фильтровальная бумага, химический стакан, флюороскоп.
Реактивы:
1) H2SO4 (конц.), 23 % раствор хлороформа, 5 % раствор FeCl3;
2) анилиновый реактив (15 частей анилина и 1 часть HCl (конц.)), 23 % раствор хлороформа;
3) раствор цистеина — 0.25 г/л, раствор NaOH -100 г/л, раствор викасола — 0.5 г/л;
4) HNO3 (конц.), сахароза (порошок), 1%раствор FeCl3;
5) 10% раствор NaOH, 10% раствор HCl, 5% раствор K4[Fe(CN)6]; 1%раствор FeCl3, 0.01% раствор метиленового синего, 10% раствор Na2CO3, раствор Люголя (0.1% раствор иода в растворе йодистого калия);
6) 1% раствор FeCl3, рутин, насыщенный раствор, H2SO4 (конц.), 0.5% раствор HCl, феллингова жидкость, 10% раствор NaOH;
7) диазореактив - 5 капель 1% раствора сульфаниловой кислоты + 5 капель 5% раствор NaNO2, 10% раствор Na2CO3,
8) HCl (конц.), Zn (мет.);
9) 1%раствор FeCl3;
10) H2SO4 (конц.), 30% раствор NaOH, 10% раствор тиомочевины,.
Ход работы
Провести качественные реакции на витамины А, С, Е, D, Р, В1, В6, В12.
Опыт 1. Качественные реакции на витамин А.
Реакция на витамин А с концентрированной серной кислотой. В сухую пробирку вносят 1 каплю раствора витамина А и 5 капель раствора хлороформа, перемешивают и добавляют 1 каплю концентрированной серной кислоты. Реакцию проводить в вытяжном шкафу! Отмечают результат реакции.
Реакция на витамин А с хлорным железом. В сухую пробирку вносят 1 каплю витамина А и 5 капель раствора хлороформа. Перемешивают, добавляют 3 капли хлорида железа. Реакцию проводить в вытяжном шкафу! Отмечают результат реакции.
Опыт 2. Качественные реакции на витамин D.
В сухую пробирку вносят 2 капли витамина D, 10 капель раствора хлороформа и 1—2капли анилинового реактива, осторожно нагревают при постоянном помешивании. Реакцию проводить в вытяжном шкафу! Отмечают результат реакции.
Опыт 3. Качественная реакция на викасол.
К 5 каплям раствора викасола добавляют равное количество раствора цистеина и 1 каплю раствора едкого натра. Отмечают результат реакции.
Опыт 4. Качественные реакции на витамин Е.
Реакция с азотной кислотой. В сухую пробирку вносят 6 капель витамина Е, добавляют несколько крупинок сахарозы. Осторожно по стенке пробирки прибавляют 10 капель концентрированной азотной кислоты. Реакцию проводить в вытяжном шкафу! Отмечают результат реакции.
Реакция с хлорным железом. В сухую пробирку вносят 0,5 мл витамина Е, затем 0,5 мл раствора хлорного железа (III) и тщательно перемешивают содержимое пробирки. Отмечают результат реакции.
Опыт 5. Качественные реакции на витамин С.
Реакция с железосинеродистым калием K4[Fe(CN)6]. В две пробирки вносят по 1 капле раствора NaOH и по 1 капле раствора железосинеродистого калия. В одну пробирку добавляют 5 капель раствора витамина С, в другую — столько же воды. Перемешивают, добавляют по 3 капли раствора соляной кислоты и по 1 капле раствора хлорного железа. В пробирке с витамином С образуется осадок берлинской лазури, в контрольной пробирке наблюдается бурое окрашивание, обусловленное образованием железосинеродистой соли окиси железа.
Реакция с метиленовым синим. В две пробирки вносят по 1 капле раствора метиленового синего, по 1 капле раствора соды. В одну из них добавляют несколько капель раствора аскорбиновой кислоты, в другую — 1 мл воды. В пробирке с аскорбиновой кислотой происходит обесцвечивание метиленового синего (при нагревании).
Реакция с раствором Люголя. В две пробирки вносят по 10 капель дистиллированной воды и по 2 капли раствора Люголя. В одну пробирку прибавляют 10 капель дистиллированной воды, в другую -10 капель раствора аскорбиновой кислоты. В пробирке с аскорбиновой кислотой раствор Люголя обесцвечивается в результате восстановления йода до йодистоводородной кислоты.
Опыт 6. Качественные реакции на витамин Р.
Реакция с хлоридом железа. Хлорид железа образует с рутином комплексное соединение, окрашенное в изумрудно-зеленый цвет. К 12 мл насыщенного водного раствора рутина прибавляют несколько капельраствора хлорида железа. Отмечают результат реакции.
Реакция с концентрированной серной кислотой. Концентрированная серная кислота образует с флавонами и флавоноидами оксониевые соли, растворы которых имеют ярко-желтую окраску. На границе двух жидкостей возникает окрашенное в желтый цвет кольцо. К 1 —2 мл насыщенного водного раствора рутина осторожно по стенке пробирки добавляют 1 мл концентрированной серной кислоты. Реакцию проводить в вытяжном шкафу! Отмечают результат реакции.
Реакция с феллинговой жидкостью. При кислотном гидролизе рутина отщепляется молекула рутинозы, которая далее распадается на глюкозу и рамнозу, обладающими восстанавливающими свойствами. К 0,5 г рутина добавляют 5 мл раствора соляной кислоты. Смесь доводят до кипения, кипятят в течение 1 мин, затем отфильтровывают. К полученному фильтрату приливают 3 мл раствора едкого натра и 3 мл феллинговой жидкости, нагревают до кипения. Отмечают результат реакции.
Опыт 7. Качественная реакция на витамин В1.
Диазореакция. В щелочной среде витамин В1 с диазореактивом образует сложное комплексное соединение оранжевого цвета, которое образуется на границе двух жидкостей в виде кольца.К диазореактиву добавляют еще 1—2 капли раствора витамина В1. Затем по стенке, наклонив пробирку, осторожно добавляют 5—7 капель раствора Na2CO3. Отмечают результат реакции.
Опыт 8. Качественная реакция на витамин В2.
Реакция восстановления витамина В2. Окисленная форма витамина В2 представляет собой желтое флюоресцирующее в ультрафиолетовых лучах вещество. Реакция на витамин В2 основана на его способности легко восстанавливаться; при этом раствор витамина В2, имеющий желтую окраску, приобретает сначала розовый цвет (за счет образования промежуточных соединений), а затем обесцвечивается (восстановленная форма витамина В2 бесцветна).В пробирку наливают 10 капель раствора витамина В2, добавляют 5 капель концентрированной соляной кислоты и опускают зернышко металлического цинка. Реакцию проводить в вытяжном шкафу! Начинается выделение пузырьков водорода, жидкость постепенно розовеет, затем обесцвечивается. Сравнивают обе формы витамина В2 по флюоресценции, поместив пробирку у флюороскопа.
Опыт 9 . Качественные реакции на витамин В6.
Реакция с хлоридом железа. Витамин В6 при взаимодействии с раствором хлорида железа (III) образует комплексную соль типа фенолята железа красного цвета. К 5 каплямраствора витамина В6 приливают равное количество раствора хлорного железа и перемешивают. Отмечают результат реакции.
Флюоресценция витамина В6. В пробирку вносят 10 капель раствора витамина. Поместив пробирку у флюороскопа, наблюдают голубую флюоресценцию.
Опыт 10. Качественная реакция на витамин В12.
При взаимодействии ионов кобальта с тиомочевиной при нагревании образуется роданид кобальта (II) зеленого цвета.Содержимое одной ампулы витамина В12 переливают в пробирку, добавляют 3 капли концентрированной серной кислоты и производят сжигание до обесцвечивания в вытяжном шкафу! По окончании минерализации осторожно добавляют в пробирку сначала 10 капель воды, затем 10 капель раствора NaOH. Воду и щелочь добавляют осторожно при помешивании. На беззольный фильтр наносят 2—3 капли раствора тиомочевины и высушивают над плиткой. После этого наносят на фильтр 1—2 капли полученного минерализата и снова нагревают над плиткой. На фильтре, чаще по краю пятна, появляется зеленое окрашивание, свидетельствующее о наличии кобальта.
Работа 10. Выделение и обнаружение фолиевой кислоты из дрожжей
Материалы для исследования: прессованные дрожжи
Оборудование: ступка с пестиком, песок, центрифуга, штатив с пробирками, химический стаканчик, стеклянная палочка, лакмусовая бумага, флюороскоп, фильтр, воронка для фильтрования.
Реактивы: 1) 0.1 н и 0.005 н растворы NaOH, 2) ледяная уксусная кислота, 3)0.4% KMnO4, 4) 3% раствор Н2О2
Ход работы
В ступку помещают 10 г дрожжей, добавляют 10 мл 0.1 н раствора гидроксида натрия, 2 г песка и растирают 5 мин. Затем центрифугируют 15 мин при 3000 об/мин. Соблюдать все правила работы с центрифугой! Фильтруют. К 10 каплям над осадочной жидкости приливают 20 капель ледяной уксусной кислоты и 10 капель раствора перманганата калия так, чтобы розовое окрашивание не исчезало в течении 10 мин. Реакцию проводить в вытяжном шкафу! Через 10 мин удаляют избыток перманганата калия добавлением 4-5 капель раствора перекиси водорода и приливают 0.005 н раствор гидроксида натрия (приблизительно 5 мл) до рН 4.0 – 4.5. При ультрафиолетовом облучении фолиевой кислоты в щелочном растворе в флюороскопе наблюдается голубая флюоресценция.
Работа 11. Разделение смеси водорастворимых витаминов методом тонкослойной хроматографии
Материалы для исследования: раствор смеси витаминов: В1, В2, В5, В6, С в 50% растворе этанола.
Оборудование: хроматографическая камера, силуфоловые пластинки, капилляры, УФ лампа.
Реактивы: 1) подвижная фаза 1 (бензол – этанол - уксусная кислота - ацетон, 70:20:5:5),2) подвижная фаза 2 (бензол – этанол - уксусная кислота – ацетон, 55:35:5:5)
Ход работы
В угол силуфоловой пластинки на расстоянии 2 см от каждой стороны наносят раствор смеси витаминов. Проводят двухмерную хроматографию. Для первого направления используют подвижную фазу 1, затем подсушивают и проводят разделение в перпендикулярном направлении подвижной фазой 2. Затем пластины высушивают и выявляют пятна в УФ свете. Для выявления витаминов используют значения Rf с подвижной фазой 1: В1 – 0.00, В6 – 0.17, В2 – 0.48, В5 – 0.53, С – 0.68; с подвижной фазой 2: В1 – 0.00, В6 – 0.60, В2 – 0.16, В5 – 0.22, С – 0.44.
Работа 12.Количественное определение витамина Р (рутина) в черном и зеленом чае
Количественное определение рутина основано на его способности окисляться перманганатом калия. В качестве индикатора применяется индигокармин, который вступает в реакцию с перманганатом калия, после того как окисляется весь рутин. Экспериментально установлено, что 1 мл 0.05 н. раствора перманганата калия окисляет 3.2 мкг (0.00506 мкмоль) рутина. В черном чае содержится 300-500 мг/кг (474-790 мкмоль/кг) рутина, в зеленом — несколько больше.
Материал для исследования: различные сорта черного и зеленого чая.
Оборудование: весы, разновесы, 4 конические колбы на 50 мл, пинцет, мерный цилиндр, бюретки для титрования.
Реактивы: 1) 0,05 н. раствор KMnO4, 3) индикатор индигокармин;
Ход работы
К 0,1 г черного и зеленого чая приливают по 50 мл горячей дистиллированной воды и проводят экстрагирование (перевод одного или нескольких компонентов из твердого пористого тала в жидкую фазу с помощью избирательного растворителя) в течение 5 мин. Отмеривают в конические колбочки по 10 мл экстракта, добавляют по 10 мл дистиллированной воды и 10 капель индигокармина. Титруют раствором перманганата калия до появления устойчивой желтой окраски. Расчеты производят по формуле
3,2(0,00506)·а·50·1000
Х = -------------------------------- (мкг(мкмоль)/кг)
10·0,1
где 3,2(0,00506) — количество рутина (мкг, мкмоль), соответствующее 1 мл 0,05 н. раствора перманганата калия; а — количество 0,05 н. раствора перманганата калия, израсходованное на титрование, мл; 10 — количество вытяжки, взятое для титрования, мл; 50 — общий объем экстракта, мл; 0,1 — масса сухого вещества, мг; 1000— коэффициент пересчета на 1 кг сухого вещества.
Работа 13.Количественное определение витамина С методом йодометрического титрования
Аскорбиновая кислота является сильным восстановителем и может быть определена йодометрически при определенном значении рН раствора (например рН = 7). При титровании йодом аскорбиновая кислота окисляется, образуя дегидроаскорбиновую кислоту.
Материал для исследования: капуста, картофель, лимон, яблоко;
Оборудование: 4 конические колбы на 50—100 мл, бюретка для титрования, терка, ступка с пестиком, фильтр, воронка для фильтрования, вата, толченое стекло или песок;
Реактивы: 2% раствор НС1, 0,5% раствор крахмала, 0,003 н. раствор I2
Ход работы
Подготовка экстракта из пищевых продуктов для определения витамина С.
2 г капусты или картофеля натереть на терке в чашке Петри или мелко порезать и растереть в ступке с небольшим количеством толченого стекла или песка. Затем, если измельчали на терке, собрать массу из чашки Петри в стаканчик, если в ступке — прямо в ступку добавить 10 мл раствора НС1. Хорошо перемешанную массу отфильтровать через стеклянную воронку с ватой в коническую колбу на 50—100 мл. Массу на ватном фильтре промыть несколькими каплями воды. В фильтрат прилить 1 мл раствора крахмала и титровать рабочим раствором I2 до появления синего окрашивания.
При расчете содержания витамина С в продукте использовать формулу определения массы при помощи титра по определяемому веществу:
н · Э · V
М = -------------- (г), где
н - молярная концентрация эквивалента йода;
Э - молярная масса эквивалента аскорбиновой кислоты в г, равная в данном случае 88 г;
V — объем пошедшего на титрование йода, в мл.
Для пересчета на содержание витамина С в 100 г продукта использовать формулу:
М·1000
Х = ------------- (г)
Полученный результат сравнить с нормой: содержание витамина С в капусте 45 мг, в картофеле — 20 мг (на 100 г растения).
Тема 5
НУКЛЕИНОВЫЕ КИСЛОТЫ
(4 ч)
Работа 14. Выделение дезоксирибонуклеопротеина из ткани селезенки, печени, мышц.
Дезоксирибонуклеопротеины содержатся преимущественно в ядрах клеток, в то время как рибонуклеопротеины преобладают в цитоплазме. Дезоксирибонуклеопротеины хорошо растворяются в щелочных и солевых растворах и выпадают в осадок при нейтрализации щелочных растворов и при разведении водой солевых растворов.
Исследуемый материал: ткани селезенки, печени, мышц курицы или рыбы.
Оборудование: ступка с пестиком, марля, центрифуга, штатив, пробирки, деревянные палочки, спиртовка, спички, воронка, 2 химических стакана, лакмусовая бумага, весы, разновесы, обратный холодильник, электроплитка.
Реактивы: 1) песок, 2) 1 М раствор NaCl, 3) 0,4% раствор NaOH, 4) 10% раствор H2SO4, 5) 10% раствор NH3, 6) дифениламин, 7) аммиачный раствор серебра, 8) реактив для биуретовой реакции, 9) 10% раствор уксусной кислоты, 10) молибденовый реактив.
Ход работы
3 г селезенки (печени, мышц) растирают в ступке с 0,6 г песка, затем небольшими порциями добавляют в ступку 1 М раствор хлористого натрия, растирая содержимое в течение 15— 20 мин.
Полученный вязкий раствор процеживают через марлю в химический стакан, переносят в центрифужные пробирки, уравновешивают их и центрифугируют в течение 10—15 мин. Соблюдать все правила работы с центрифугой! Измеряют объем полученного центрифугата, отмеряют 5-кратный объем воды (по отношению к центрифугату), подкисленный уксусной кислотой до рН = 4.5, в стакан и, медленно вращая в нем деревянную палочку, вливают центрифугат.
Нерастворимый в воде дезоксирибонуклеопротеин выпадает в осадок и наматывается в виде нитки на деревянную палочку. Нити дезоксирибонуклеопротеина вынимают вместе с палочкой и переносят в чистую пробирку. Эту часть дезоксирибонуклеопротеина используют для обнаружения дезоксирибозы дифениламиновой пробой. Для этого содержимое пробирки растворяют в 10 каплях раствора гидроксида натрия и прибавляют 10 капель дифениламинового реактива. После 10-минугного нагревания в кипящей водяной бане жидкость в пробирке приобретает синее окрашивание.
Остальную часть выделившегося в виде осадка нуклеопротеина отделяют центрифугированием, переносят и пробирку, прибавляют 5 мл раствора серной кислоты и закрывают пробирку пробкой с обратным холодильником. Осторожно нагревают пробирку в течение часа, держа ее на расстоянии от спирали электроплитки. Время нагревания отмечают с момента закипания раствора.
Гидролизат после охлаждения отфильтровывают и проводят ряд реакций. Белок и полипептиды обнаруживают биуретовой реакцией. Для обнаружения пуриновых оснований к 1 мл гидролизата прибавляют 5—6 капель раствора аммиака до щелочной реакции по лакмусу и добавляют 0,5 мл аммиачного раствора серебра. Образуется хлопьевидный осадок серебряных солей пуриновых оснований, который постепенно оседает на дно.
Фосфорную кислоту обнаруживают фосфорно-молибденовой пробой по появлению желтого осадка фосфорно-молибденовокислого аммония. К 0,5 мл гидролизата прибавляют равный объем молибденового реактива и кипятят несколько минут. Жидкость окрашивается в лимонно-желтый цвет. При охлаждении образуется желтый осадок фосфорно-молибденовокислого аммония.
Работа 15. Извлечение нуклеопротеинов дрожжей
Для изучения химического состава нуклеопротеинов удобно пользоваться дрожжевыми клетками. При непродолжительном гидролизе дрожжевой массы или выделенных из нее нуклеопротеинов, последние (нуклеопротеины) распадаются на полипептиды, пуриновые и пиримидиновые основания, рибозу и дезоксирибозу и фосфорную кислоту. Продукты гидролиза могут быть обнаружены в гидролизате качественными для каждого вещества реакциями.
Исследуемый материал: прессованные дрожжи.
Оборудование: ступка с пестиком, марля, центрифуга, штатив, пробирки, деревянные палочки, спиртовка, спички, воронка, 2 химических стакана, лакмусовая бумага, стеклянный песок.
Реактивы: 1) диэтиловый эфир, 2) 0.4%-го раствор NaOH, 3) 10% уксусная кислота.
Ход работы
Извлечение нуклеопротеинов из дрожжей. В фарфоровую ступку помещают 1 г дрожжей, добавляют 1 каплю диэтилового эфира, 2 капли дистиллированной воды, около 0,1 г стеклянного песка. Дрожжевую массу растирают пестиком 1—2 мин для разрушения клеток. В ступку добавляют 4 мл раствора гидроксида натрия и растирание продолжают в течение 5 мин. Содержимое ступки пипеткой переносят в центрифужную пробирку, уравновешивают на весах с другой пробиркой, в которую налита вода, и центрифугируют в течение 10 мин. Надосадочную жидкость переносят пипеткой в стакан с 80—90 мл воды, подкисленной до рН = 4.5 уксусной кислотой. Выпавший осадок РНК-протеина отделяют центрифугированием.
Работа 16. Изучение химического состава рибонуклеопротеинов дрожжей
Исследуемый материал: прессованныедрожжи
Оборудование: коническая колба 150 мл, ступка с пестиком, марля, центрифуга, штатив, пробирки (маленькие и большие), деревянные палочки, спиртовка, спички, воронка, 2 химических стакана, лакмусовая бумага, весы, разновесы, водяная баня, обратный воздушный холодильник.
Реактивы: 1) 10% раствор H2SO4, 2) 10% раствор NaOH, 1 % раствор CuSO4, 3) 10% раствор NH3, 4) аммиачный раствор серебра, 5) молибденовый реактив.
Ход работы
200 мг дрожжей помещают в широкую пробирку и добавляют 5 мл 10%-го раствора серной кислоты и 5 мл дистиллированной воды. Перемешивают и закрывают пробкой с обратным воздушным холодильником. Пробирку помещают на кипящую водяную баню и кипятят при слабом нагревании 1 час. Затем пробирки охлаждают, фильтруют содержимое и с гидролизатом проводят реакции на составные части нуклеотидов.
А) Биуретовая реакция на белок.
К 5—6 каплям гидролизата прибавляют 10 капель 10% -го раствора NaOH и 1 каплю 1 % -го раствора медного купороса. При наличии белка жидкость окрашивается в фиолетовый цвет.
Б) <