
Категории:
АстрономияБиология
География
Другие языки
Интернет
Информатика
История
Культура
Литература
Логика
Математика
Медицина
Механика
Охрана труда
Педагогика
Политика
Право
Психология
Религия
Риторика
Социология
Спорт
Строительство
Технология
Транспорт
Физика
Философия
Финансы
Химия
Экология
Экономика
Электроника
Молекулярный механизм мышечного сокращения
До момента возникновения в мышце возбуждения головки выростов миозина контактируют с тропонином на поверхности актина (рис. 1.12, А).
При проведении возбуждения по мышечному волокну изменяется проницаемость поверхностной мембраны и саркоплазматического ретикулума и внутрь саркомеров устремляются ионы Са2+. Эти ионы электростатически взаимодействуют с тропонином, что обеспечивает сдвиг его в сторону (рис. 1.12, Б). Головки миозина, в которых находится АТФ-аза, вступают в контакт с актином. Фермент АТФ-аза дефосфорилирует АТФ, превращая ее в АДФ с выделением энергии, необходимой для мышечного сокращения. Молекулы АДФ выходят из головок миозина в цитоплазму. Энергия АТФ используется на изменение четвертичной структуры головок миозина, что напоминает гребковые движения весел на лодке. При этом миозин остается на месте, а нити актина сдвигаются к центру сар-комера, и длина саркомера уменьшается на незначительную величину (рис. 1.12, В). С помощью окислительного фосфорилирования АДФ в митохондриях превращается в АТФ и снова встраивается в полости головок миозина (рис. 1.12, Г). При этом головки миозина теряют связь с актином и выпрямляются без затраты энергии. Затем головки миозина вступают в контакт со следующими молекулами тропонина на поверхности актина (рис. 1.12, Д). С помощью ионов Са2+ происходит очередной цикл уменьшения длины саркомера.
За счет уменьшения длины всех саркомеров миофибрилл происходит сокращение мышечного волокна и всей мышцы. Количество взаимодействующих контактов между актином и миозином и количество циклов уменьшения длины саркомера определяют силу мышечного сокращения.
Спастические сокращения скелетной мускулатуры могут наступать при нарушении кровообращения в мышце и, как следствие, гипоксии в мышечной ткани. Падение парциального давления 02 приводит к увеличению проницаемости саркоплазматического ретикулума для ионов Са2+, и возникает сильное длительное сокращение мышцы. Снижение интенсивности окислительногофосфорилирования мышцы препятствует расслаблению.
Образующееся после смерти человека трупное окоченение связано с использованием запасенной при жизни энергии АТФ на сокращение скелетной мускулатуры. Отсутствие в мышечной ткани окислительного фосфорилирования приводит к невозможности головок миозина выйти из контакта с актином, что сопровождается отсутствием расслабления мышц.
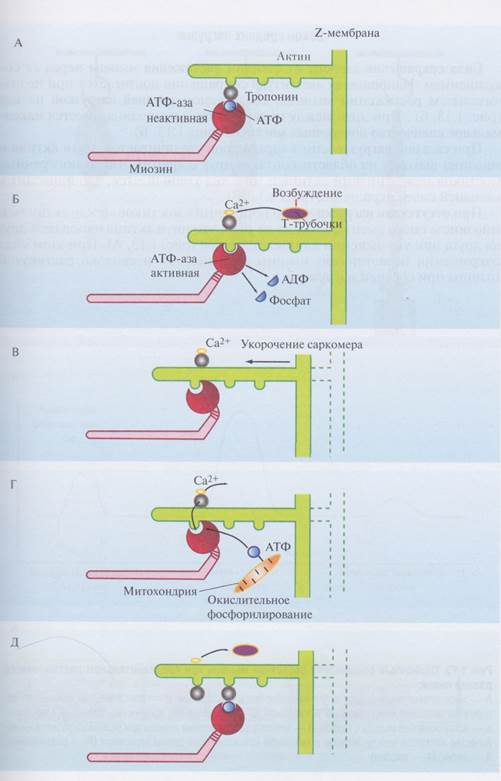
Рис. 1.12. Изменение положения поперечного мостика между актином и миозином в динамике мышечного сокращения: А - исходное положение во время покоя мышцы; Б — выход ионов Са2+ при возбуждении мышцы и сдвиг тропонина в сторону; В — за счет энергии АТФ головка выроста миозина поворачивается под новым углом; Г — Ca2t активно закачивается в Т-трубочки и саркоплазматический ретикулум. Тропонин возвращается на место. Новые молекулы АТФ заполняют головку миозина; Д — головка выпрямляется и контактирует со следующей молекулой тропонина на актине