Теоретичні відомості про крохмаль
Загальні положення
Ферменти– це специфічні білки, які виконують в організмі роль біологічних каталізаторів. Являючись білками, ферменти мають первинну, вторинну, третинну і багато з них – четвертинну структуру.
З їх допомогою здійснюються багаточисельні хімічні реакції, які можуть іти з великою швидкістю при температурах, що підходять для даного організму, тобто в межах від 5 до 400С. Щоб ці реакції з тією ж швидкістю протікали зовні організму, потрібні були б високі температури та різкі зміни деяких інших умов. Для клітини це означало б загибель. Тому ферменти абсолютно необхідні, оскільки без них реакції в клітинах або взагалі не відбувались або відбувались би надзвичайно повільно і не могли б підтримувати життя.
При гідролізі ферментів утворюється суміш амінокислот. Відомо більше, як 20 різних амінокислот, які входять в склад білків.
Молекулярна маса ферментів має широку варіацію – від декілька десятків тисяч до декілька мільйонів.
Ферменти відрізняються по своїй структурі. Їх поділяють на 2 групи – прості і складні. Прості, або однокомпонентні; - ферменти складаються тільки із амінокислот. До них відносяться невелика кількість ферментів (рибонуклеаза, амілаза, альдолаза, уреаза, пепсин та ін.). Але більшість ферментів складається з двох компонентів: небілкової частини, або простетичної групи, і білкової – апофермент. Ці дві частини фермента окремо не мають сили, але тільки в комплексі одне з іншим вони проявляють каталітичну здатність.
Небілковий компонент розпаду ферментів називається кофермент.
Багато коферментів являються вітамінами або їх похідними. В даний час нам відомо понад 300 окремих ферментів (а, може набагато більше, бо наука не стоїть на місці), в склад яких входять в якості коферментів вітаміни або їх похідні. Як наслідок, при авітамінозах спостерігається розпад діяльності всіх ферментних систем.
На початку 20 ст. Еміль Фішер провів перші систематичні дослідження по вивченню специфічності ферментів. Тоді ж почали з’являтись роботи, присвячені кінетиці ферментативних реакцій, були сформовані теорії дії ферментів. Лише в 1926 р. вперше був отриманий очищений фермент в кристалічному вигляді. Це була уреаза, виділена Джеймсом Самнером, який виявив, що кристали уреази повністю складаються з білка. Тому ним була висунута гіпотеза, що всі ферменти представляють собою білки, але проти цього активно заперечував дуже авторитетний німецький біохімік Ріхард Вільштеттер, який дотримувався думки, що ферменти - низькомолекулярні сполуки, а знайдений в кристалах уреази білок - лише забруднення. І лише в 30-ті роки, після того як Джон Нортроп та його співробітники отримали в кристалічному вигляді пепсин та трипсин і встановили, що ці ферменти теж представляють собою білки, точка зору про білкову природу ферментів отримала загальне визнання. На сьогодні ідентифіковано близько 2000 ферментів.
Властивості ферментів
Ферменти мають загальні з білками фізично-хімічні властивості: при гідролізі розщеплюються на амінокислоти; створюють колоїдні розчини; погано кристалізуються; дуже нестійкі до високих температур солей, важких металів, кислот, лугів і т. п.; мають антигенні властивості.
Властивості ферментів як біокаталізаторів
1. Специфічність (вибірковість) дії. Виділяють:
· абсолютну специфічність – фермент каталізує перетворення єдиного S (уреаза, аргіназа).
· відносну – фермент каталізує перетворення речовин, які мають однакові зв’язки (пептидази, естерази тощо).
· стереоструктурну – фермент каталізує перетворення певного стереоізомеру (L – лактатдегідрогеназа → L – лактат).
2. Термолабільність – відповідно до своєї білкової природи ферменти є термочутливими,
тобто термолабільними утвореннями. Оптимум to =37-38 оС. При зростанні to вище
оптимального значення швидкість ферментативної реакції різко зменшується за рахунок
конформаційних (денатураційних) змін у структурі ферментного білка, та практично
повністю зникає після 56о С (денатурація білка). При зниженні температури (холодова
денатурація) швидкість ферментативної реакції значно сповільнюється, але необоротнє
руйнування білка не відбувається, що використовується в медичній практиці .
3. Залежність ферментативної активності від рН середовища. Кожен фермент має свій рН–
оптимум - значення рН, при якому його активність максимальна. При зміні рН відбувається
дисоціація іоногенних груп активного центру та конформаційні зміни молекул. Більшість
ферментів найактивніші в діапазоні рН 6-8. Екстремальні значення мають пепсин (рН=1,5-2),
аргіназа (рНопт=10-11).
4. Ферменти прискорюють швидкість як прямої, так і зворотньої реакції.
5. Активність ферментів суттєво змінюється під впливом певних хімічних сполук, що
збільшують (активатори) або зменшують (ільгібітори) швидкість реакції, яка каталізується.
6. Ферманти значно підвищують швидкість біохімічних реакцій (один моль карбангідрази розщеплює 36 млн. молекул Н2СO3)
Поняття про “енергію активації” та “енергетичний бар’єр”
Ферменти прискорюють хімічну реакцію за рахунок зниження енергії активації.
Енергія активації – це енергія для для переведення всіх молекул моля речовин в
активований стан. Фермент знижує енергію активації за рахунок збільшення числа
активованих молекул. Ферментативна реакція йде в обхід енергетичному бар’єру.
Енергетичний бар’єр – енергія, яку треба подолати молекулам, щоб вступити в хімічну
взаємодію. Фермент знижує енергетичний бар’єр. Величина енергії активації дорівнює
величині енергетичного бар’єру.
Ферментативна реакція має більш низьку енергію активації та низький енергетичний
бар’єр.
Будова ферментів
Хімічна природа та структура ферментів.
В основному ферменти мають білкову природу, за винятком мя-РНК, яка теж володіє
ферментативною активністю (доведено роботами Томаса Чека).
Докази білкової природи:
· втрата активності при кип’ятінні, дії У/Ф та Rо– променів, УЗ, кислот, лугів, важких
металів;
· виділення у формі кришталів;
· гідроліз до амінокислот;
· осадження висалюванням без втрати каталітичних властивостей;
· висока молекулярна маса, амфотерність, здатність до електрофорезу;
· штучний синтез рибонуклеази у 1969 році
Структура ферментів
Ферменти є прості і складні. Прості ферменти складаються тільки з амінокислот
(наприклад, гідролази). Складні ферменти - з білкового компонента (апофермента) та
небілкового (кофактора). Кофактор може бути неорганічної (метали) та органічної природи.
Останній в залежності від ступеня зв’язку з апоферментом називається простетичною
групою (міцно зв’язаний з апоферментом) або коферментом (слабо зв’язаний з апоферментом).
Комплекс фермента з кофактором називається голоферментом, а поліпептидна частина ферменту - апоферментом.
Білкова частина + небілкова частина = складний фермент
Апофермент Кофактор Голофермент
Ізоферменти.
Майже всі ферменти існують в декількох формах. Ізоферменти – це сімейство
ферментів, які відрізняються за будовою та фізико-хімічними властивостями, але
каталізують одну реакцію. Наприклад, лактатдегідрогеназа (ЛДГ) каталізує
взаємоперетворення лактату та пірувату.
Фермент ЛДГ містить 4 субодиниці 2х-типів: субодиниця Н виділена із серцевого м’яза
(від Heart – серце), субодиниця М - із склетних м’язів (Musculus – м’яз). Субодиниці мають
свій генетичний локус в різних органах. З’єднання субодиниць відбувається в різних
відношеннях, тому виділяють такі фракції ЛДГ:
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5:
(Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 синтезується в серцевому м’язі та мозку, ЛДГ5 – в склетних м’язах та печінці.
Інші фракції - в інших органах. Гіперферментемія свідчить про ураженні клітин, тому
підвищення активності ЛДГ1 в крові спостерігається при ураженні серцевого м’яза (інфаркт
міокарда), а активності ЛДГ5 - при гепатитах та ураження склетних м’язів. Тобто визначення
активності ізоферментів дає можливість виявити локалізацію патологічного процесу.
Мультиферменти
Це надмолекулярні комплекси з різних ферментів та коферментів, що каталізують
послідовні етапиперетворення субстрата. Прикладами дії мультиферментів є реакції
окислювального декарбоксилювання α-кетокислот (пірувату та α-кетоглутарату) під впливом
піруватдегідрогеназита α-кетоглутаратдегідрогенази (складаються з трьох ензимів та 5
коферментів). Продуктами реакцїй відповідно являються ацетил-КоА та сукциніл-КоА.
Біологічне значення мультиферментів: скорочується відстань між реагуючими речовинами і зменшується (час) тривалість реакції.
Класифікація ферментів
Класифікація ферментів (побудована за типом хімічних реакцій).
Класифікація ферментів базується на типових реакціях, які вони каталізують. Відповідно до цього всі ферменти розділяють на наступні шість класів: оксидоредуктази, трансферази, гідролази, ліази, ізомерази, лігази.
Оксидоредуктази – ферменти, що каталізують окисно-відновні реакції. З цих ферментів велику роль грають дегідрогенази, що каталізують реакції дегідрування, – відщеплення і приєднання водню в різних органічних сполуках. Це двокомпонентні ферменти, в яких коферментом частіше є піридиннуклеотиди і флавінові з’єднання. Окислені і відновлені форми обох коферментів можуть взаємно перетворюватися одна в іншу і служити як донорами, так і акцепторами водню.
У цих дегідрогеназах акцептором водню можуть бути не тільки інші кофермент, але і хіноноподібні з’єднання.
В аеробах дегідрогеназах коферментом є флавінові нуклеотиди – флавінмононуклеотид (ФМН) і флавінаденіндинуклеотид (ФАД), здатні віднімати і передавати водень кисню повітря, фенолоксидазній і цитохромній системам. Деякі флавопротєїди містять іони заліза, міді, молібдену і інших металів.
Аероби дегідрогенази, для яких єдиним акцептором водню служить молекулярний кисень, називаються оксиду з а м і. Віднімаючи водень від субстрата, що окисляється, і передаючи його кисню повітря, оксидази можуть утворювати воду або перекис кисню.
З оксидаз важливу роль грають поліфенолоксидаза і глюкозооксидаза, що окисляють відповідно поліфенольні з’єднання (наприклад, пірокатехин в хінон) і глюкозу в глюконову кислоту.
Лише небагато дегідрогенази здатні передавати водень безпосередньо кисню повітря. Роль посередника виконує цитохромна система, за допомогою якої і завершується біологічне окислення.
До оксидоредуктаз відносяться також пероксидаза і каталаза. Перша каталізує окислення органічних сполук пероксидом водню або органічними пероксидами, друга – розкладання пероксида водню на воду і молекулярний кисень. Обидва ферменти двухкомпонентні, активною групою в них є гематін, що містить трьохвалентне залізо.
Трансферази – ферменти, що каталізують перенесення окремих радикалів, частин молекул і навіть цілих молекул від одних з’єднань до інших. Вони беруть участь в численних реакціях обміну речовин.
Гідролази – ферменти, що каталізують процеси як катаболізму, так і анаболізму. У першому випадку процес супроводжується приєднанням води, в другому – її виділенням. Гідролази – однокомпонентні ферменти.
Естерази – ферменти, що каталізують реакції розщеплювання і синтезу складних ефірів, наприклад жирів (ліпази), складних ефірів фосфорної кислоти (фосфатази), нуклеотидів (нуклеотидази) і ін.
Номенклатура ферментів
Ферменти мають тривіальні назви та систематичні. Назви багатьох ферментів утворюються шляхом додавання суфіксу -аза до назви субстрату. Так, фермент, що каталізує гідроліз сечовини називається уреазою (від англ. urea), фермент, що гідролізує аргінін - аргіназою. Але, багато ферментів мають назви, не пов’язані з назвами їх субстратів (пепсин, трипсин). Багато ферментів мали 2 та більше назв, що привносило плутанину в номенклатуру. Це, а також швидке зростанням кількості нових ферментів, які дослідники називали за своїм бажанням, привело до необхідності систематики номенклатури.
Пропонувалось називати ферменти в залежності від хімічної природи субстрату, на який вони діють. Але, за цим принципом важко класифікувати фермент, оскільки субстратом можуть бути різноманітні сполуки в певному класі речовин та величезна кількість проміжних продуктів обміну.
Тому, в 1961 році на V Міжнародному біохімічному конгресі в Москві Комісією по ферментам Міжнародної біохімічної спілки була розроблена сучасна класифікація та номенклатура ферментів. В основу прийнятої класифікації був покладений тип каталізованої реакції, який є специфічним для дії будь-якого ферменту. Таким чином, тип реакції разом з назвою субстрату і є основою для систематичної назви ферментів.
У відповідності з цим ферменти поділяються на шість основних класів. Кожен фермент має чотиризначний кодовий номер (шифр), кожна цифра якого позначає номер ферменту в класі (6 класів), підкласі (характеризує основні види субстратів, що беруть участь в даному типі хімічних перетворень), підпідкласі (характеризує хімічну природу сполук - донорів чи акцепторів, що приймають участь в даній підгрупі реакцій), порядковий номер ферменту у підпідкласі (згідно алфавітному порядку) і систематичну назву, яка дозволяє ідентифікувати каталізовану цим ферментом реакцію.
АТФ+D-глюкоза = АДФ+D-глюкозо-6-фосфат
Так, систематична назва фермента - АТФ: гексоза 6-фосфотрансфераза, з якої слідує, що цей фермент каталізує перенесення фосфатної групи з АТФ на гексозу. Цей фермент має шифр КФ 2.7.1.1. Де КФ – класифікація ферментів, 2 - це клас трансфераз, 7 - підклас фосфотрасферази, 1 - підпідклас фосфотрансферази з гідроксильною групою в якості акцептора, 1 - номер у підпідкласі, показує, що акцептором фосфатної групи є D-гексоза.
Якщо фермент має довгу назву, або таку, що важко вимовляється, допустимим є використання його тривіальної назви. Так, тривіальна назва вищенаведеного ферменту - гексокіназа.
Механізм дії
Для визначення механізму дії ферменту було запропоновано немало теорій. Але перемогла та, в якій мова йде про те, що каталізатори лише скорочують час, необхідний для досягнення рівноваги хімічної реакції. Більшість хімічних реакцій потребує “запуску”, що і виконують ферменти.
В основі життєдіяльності організму лежать хімічні перетворення різних речовин, швидкість яких визначають ферменти – біологічні каталізатори. Харчотравлення, використання всіх корисних речовин, які поступили в організм, ріст, згортання крові, м’язові скорочення і багато інших фізіологічних процесів – все це побудовано на чіткій, послідовній роботі ферментних систем.
Ферменти дуже чутливі до зміни ph середовища, в якому вони діють. Кожний фермент має оптимум ph, при якому він найбільш активний.
Для більшості ферментів оптимальне середовище близьке до нейтрального (ph біля 7,0), так як максимальна активність ферментів проявляється при фізіологічних значеннях ph, а в кислому або лужному середовищі їх активність знижується. З цього правила є винятки, і їх немало. Наприклад, пепсин, який знаходиться в шлунковому соці, активний лише в дуже кислому середовищі (ph 1,5 – 2,5).
Ферменти дуже чутливі до температури. При підвищенні температури до 40-500 С підвищується активність більшості ферментів, що відповідає загальновідомому закону прискорення хімічних реакцій з підвищенням температури. Встановлено, що підвищення температури на кожних 100 збільшує швидкість ферментативної реакції в 1,5 – 2 рази. І тому необхідно дотримуватись температурного режиму при проведенні проб на ферменти.
Перетворення ферментів відбувається подібно з іншим обміном білків організму. Ферменти постійно оновлюються, синтезуються і розпадаються, що забезпечує їх належний рівень в тканинах.
В результаті секреції або відмиранні клітин ферменти попадають в кров. Шляхи виведення ферментів з крові різні. В плазмі крові проходить інактивація ферментів, потім вони поглинаються клітинами ретикулоендотеліальної системи, де в наслідок катаболізму, розпадаються. Частина ферментів виводиться через сечовидільні шляхи і шлунково-кишковий тракт. Але, ектреція ферментів з сечею і жовчю займає невелику питому вагу в механізмі виведення ферментів з організму. В основному, ферменти розпадаються в плазмі крові і тканинах і виводяться їх невикористані кінцеві продукти звичайними для білків каналами.
E+S↔ES→ES*→E+S
E- фермент; S-субстракт
Теоретичні відомості про крохмаль
Крохма́ль (С6Н10О5)n — полісахарид рослинного походження, що нагромаджується в результаті
фотосинтезу 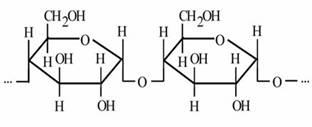 у плодах, зерні, коренях і бульбах деяких рослин як запасна форма вуглеводів.
у плодах, зерні, коренях і бульбах деяких рослин як запасна форма вуглеводів.