Острая ревматическая лихорадка
Острая ревматическая лихорадка (от др. греч. ῥεῦμα, «поток, течение» - растекание (по телу), болезнь Сокольского-Буйо) - это системное воспалительное заболевание с преимущественной локализацией процесса в различных оболочках сердца, развивающееся у предрасположенных к нему лиц, главным образом в возрасте 7-15 лет в срок от 2 до 6 недель после перенесенной острой инфекции, вызванной β-гемолитическим стрептококком группы А.
Эпидемиология:
Заболеваемость ОРЛ в РФ, снижавшаяся в течении последних десятилетий, в настоящее время составляет от 0,2 до 0,8 чел на 1000. В Иркутске отмечается устойчивая динамика снижения общей заболеваемости ревматизмом с 3.0 до 2,6 чел., первичная заболеваемость ОРЛ находится на стабильном уровне и составляет 0,023-0,024 на 1000 населения (Калягин А.Н., Горяев Ю.А.). Однако в последние десятилетие вспышки болезни продолжают регистрироваться в США, России и других странах. Данные ВОЗ свидетельствуют о высокой (от 20 до 50%) распространенности инфекций верхних дыхательных путей, вызванных стрептококком группы А.
Факторы, способствующие развитию заболеванию:
− наличие ревматизма или диффузных болезней соединительной ткани, а также врожденной неполноценности соединительной ткани у родственников первой степени родства;
− возраст 7-15 лет;
− перенесенная острая стрептококковая инфекция и частые носоглоточные инфекции;
− носительство В-клеточного маркера D8/7 у здоровых лиц и, в первую очередь, у родственников пробанда;
− женский пол.
Этиология ОРЛ:
Развитие ОРЛ тесно связано с предшествующей острой или хронической носоглоточной инфекцией, вызванной β-гемолитическим стрептококком группы А. Однако далеко не все стрептококки группы А, инфицирующие носоглотку, могут вызвать ОРЛ. Особая роль отводится М-протеину, входящему в состав клеточной стенки стрептококка, который содержит антигенные детерминанты (эпитопы), имеющие сходство с компонентами сердечной мышцы, мозга и синовиальных оболочек. Ревматогенными считают М-5, М-6, М-18, М-24 протеины. При этом определяется устойчивый гипериммунный ответ на различные антигены стрептококков с формировнанием антител – антистрептолизина-О (АСЛ-О), снтистрептогиалуронидазы (АСГ), антидезоксирибонуклеазы (анти ДНК-зы В)
Патогенез ОРЛ:
Современной теорией патогенеза ревматизма является токсико-иммунологическая. Стрептококк вырабатывает вещества, обладающие выраженным кардиотоксическим действием и способные подавлять фагоцитоз, повреждать лизосомальные мембраны, основное вещество соединительной ткани: М-протеин, пептидогликан, стрептолизин-0 и S, гиалуронидазу, стрептокиназу, дезоксирибонуклеазу и др. Существует определенная иммунологическая взаимосвязь между антигенами стрептококка и тканями миокарда. Токсины стрептококка вызывают развитие воспаления в соединительной ткани, сердечно-сосудистой системе; наличие антигенной общности между стрептококком и сердцем приводит к включению аутоиммунного механизма - появлению аутоантител к миокарду, антигенным компонентам соединительной ткани - структурным гликопротеидам, протеогликанам, антифосфолипидных антител, формированию иммунных комплексов и усугублению воспаления. Гуморальные и клеточные иммунологические сдвиги при ревматизме выражаются в повышении титров антистрептолизина-0 (АСЛ-О), антистрептогиалуронидазы (АСГ), антистрептокиназы (АСК), дисиммуноглобулинемии, возрастании процентного и абсолютного количества В-лимфоцитов при снижении процентного и абсолютного количества Т-лимфоцитов. Значительно нарушается функция тканевых базофилов, усиливается их дегрануляция, в ткань и кровяное русло выходят биологически активные вещества - медиаторы воспаления: гистамин, серотонин, брадикинины и др., что способствует развитию воспаления.
Иммунный воспалительный процесс вызывает дезорганизацию соединительной ткани (прежде всего в сердечно-сосудистой системе), протекающую в форме последовательных стадий:
1. Мукоидное набухание (обратимый патологический процесс, заключающийся в разволокнении соединительной ткани); в основе этой стадии лежит деполимеризация основного вещества соединительной ткани с накоплением преимущественно кислых мукополисахаридов.
2. Фибриноидный некроз (необратимый процесс, проявляющийся дезорганизацией коллагеновых волокон, набуханием их, отложением фибриноида, глыбчатым распадом коллагена).
3. Формирование специфических ревматических гранулем вокруг очагов фибриноидного некроза (ашоф-талалаевских гранулем); гранулема представлена крупными базофильными гистиоцитами, лимфоцитами, миоцитами, тучными и плазматическими клетками. Истинная ревматическая гранулема локализуется только в сердце.
4. Стадия склероза - исход гранулемы. Ревматический процесс проделывает указанный цикл в течение 6 мес.
Кроме названных изменений обязательно присутствует неспецифический компонент воспаления, который проявляется отеком, пропитыванием тканей плазменным белком, фибрином, инфильтрацией тканей лимфоцитами, нейтрофилами, эозинофилами.
Клинические проявления:
A. Предшествовавший стрептококковый фарингит или ангина.
B. Лихорадка.
C. Артрит (50-75%):
крупные суставы (коленный, голеностопный),
мигрирующий,
недеформирующий,
быстро отвечает на терапию.
D. Артралгия:
выраженная,
 мигрирующая.
мигрирующая.
E. Хорея – Sydenham’s chorea (<5%), только у детей.
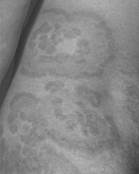
F. Кольцевидная эритема – Erythema marginatum (10-20%) (Рис.3):
чаще у детей,
никогда не бывает на лице!
G. Подкожные ревматические узелки (2-22%)(Рис.4): Рис.3
только у детей,
 в основном, в области периартикулярных тканей, Рис. 3.
в основном, в области периартикулярных тканей, Рис. 3.
в виде безболезненных горошин.
H. Кардит.
90-92% – дети до 3-х лет;
50% – дети 3-6 лет;
32% – подростки 14-17 лет;
<15% – взрослые.
Рис. 4.
Диагностика:
Лабораторные данные:
1. Общий анализ крови: увеличение СОЭ, лейкоцитоз, сдвиг лейкоцитарной формулы влево.
2. Биохимический анализ крови: повышение уровня a2 и y-глобулинов, серомукоида, гаптоглобина, фибрина, аспарагиновой трансаминазы.
3. Общий анализ мочи: нормальный или небольшая протеинурия, микрогематурия.
4. Иммунологические исследования крови: снижено количество Т-лимфоцитов, снижена функция Т-супрессоров, повышен уровень иммуноглобулинов и титров антистрептококковых антител, появляются ЦИК и СРП.
Инструментальные исследования:
ЭКГ: замедление AV-проводимости, снижение амплитуды зубца Т и интервала S-T в прекордиальных отведениях, аритмии.
Эхокардиография: при вальвулите митрального клапана выявляется утолщение и «лохматость» эхо-сигнала от створок и хорд клапана, ограничение подвижности задней створки клапана, уменьшение систолической экскурсии сомкнутых митральных створок, иногда небольшое пролабирование створок в конце систолы. При допплерэхокардиографии ревматический эндокардит митрального клапана проявляется следующими признаками: краевым булавовидным утолщением передней митральной створки; гипокинезией задней митральной створки; митральной регургитацией; куполообразным изгибом передней митральной створки.
При вальвулите аортального клапана эхокардиография выявляет мелкоамплитудное дрожание митральных створок, утолщение эхо-сигнала от створок аортального клапана.
При допплерэхокардиографии ревматический эндокардит аортального клапана характеризуется: ограниченным краевым утолщением аортального клапана; переходящим пролапсом створок; аортальной регургитацией.
ФКГ: При миокардите отмечается снижение амплитуды I тона, его деформация, патологические III и IV тоны, систолический шум, занимающий 1/2-2/3 систолы, убывающий и примыкающий к I тону. При наличии эндокардита регистрируются высокочастотный систолический шум, который усиливается в ходе динамического наблюдения, протодиастолический или пресистолический шум на верхушке при формировании митрального стеноза, протодиастолический шум на аорте при формировании недостаточности клапана аорты, ромбовидный систолический шум на аорте при формировании сужения устья аорты.
Рентгенологическое исследование сердца: увеличение размеров сердца, снижение сократительной способности.
Доказательства предшествовавшей А-стрептококковой инфекции:
1.позитивная культура из зева (≈25%) – взять 3 последовательные культуры до начала антибиотикотерапии;
2.АСЛ-О антитела > 250 (≈80%) – образцы сывороток забираются в течение острой фазы и через 2 недели;
3.титры антигиалуронидазы, дезоксирибонуклеазы β и стрептозана (≈97%).
Модифицированные критерии Джонса для диагностики ОРЛ:
| Большие критерии | Малые критерии |
| 1. Кардит 2. Артрит 3. Хорея 4. Кольцевидная эритема 5. Подкожные ревматические узелки | Клинические: Артралгия Лихорадка Лабораторные: Ускоренная СОЭ Повышенный СРБ Инструментальные: Удлиненный PR на ЭКГ Признаки митральной или аортальной регургитации на ЭХО-КГ |
| Данные, подтверждающие предшествующую А-стрептококковую инфекцию: повышенные или повышающиеся титры противострептококковых антител (АСЛ-О > 250) позитивная А-стрептококковая культура, выделенная из зева или положительный тест быстрого определения А-стрептококкового антигена |
Примечание: наличие 2 больших или 1 большого и 2 малых критериев в сочетании с данными, подтверждающими инфекцию β-гемолитическим стрептококком группы А, свидетельствует о высокой вероятности ОРЛ.
Дифференциальная диагностика ОРЛ:
A. Бактериальные инфекции:
септический артрит;
ИЭ;
лаймская болезнь.
B. Вирусные инфекции:
артрит при краснухе;
артрит, ассоциированный с гепатитом В и С, инфекционным мононуклеозом.
C. Системные заболевания соединительной ткани:
ЮРА;
РА;
синдром Стилла;
СКВ;
васкулиты;
болезнь Кавасаки.
D. Иммунокомплексная патология:
аллергические реакции на лекарства.
E. Гемоглобинопатии (серповидно-клеточная анемия).
F. Онкопатология:
лейкемии;
лимфомы.
Лечение:
- лечение ОРЛ должно быть комплексным.
1. Режим – постельный при остром процессе.
2. Диета – ограничить соль, увеличить белок, уменьшить легкоусваиваемые углеводы.
3. Этиотропное лечение:
Терапия выбора:
пенициллин 500 000 ЕД в/м 4 раза в сутки 5-10 дней;
бензатин-пенициллин G 1,2 млн. ЕД в/м 1 раз в сутки 10 дней.
Альтернативная терапия:
эритромицин 250 мг 4 раза в день внутрь 10 дней.
В дальнейшем вводится бициллин-5 или экстенциллин 1,5 млн. ЕД в/м 1 раз в 3 недели.
4. Патогенетическое лечение:
аспирин 4-6 г/сут внутрь;
другие НПВС (при непереносимости аспирина или затяжном течении):
индометацин 100-150 мг/сут;
диклофенак 100-150 мг/сут;
ибупрофен 1200-1500 мг/сут (при беременности);
продолжительность приема: 6 недель (эффективность – 80%), 12 недель (90%).
ГКС (при тяжелом кардите):
преднизолон 20-30 мг/сут или
медрол 12-16 мг/сут внутрь 10-14 дней, постепенно снижая дозу на 2,5 мг в неделю.
аминохинолиновые препараты (при затяжном течении):
делагил 250 мг или
плаквенил 200 мг/сут внутрь 6-12 месяцев.
5. Симптоматическая терапия–в зависимости от проявлений.
Профилактика:
Первичная профилактика ОРЛ:
| Препарат | Дозы | Способ введения | Продолжительность |
| Бензатин-пенициллин G | 600 000 (< 60 кг) 1 200 000 (> 60 кг) | В/м | Однократно |
| Феноксиметилпенициллин | 250 мг 3 раза/сут | Per os | 10 дней |
| При аллергии к пенициллину: | |||
| Эритромицин | 20-40 мг/кг 2-4 раза в день (max 1 г/сут) | Per os | 10 дней |
Следующие препараты могут быть использованы, но обычно не рекомендуются: амоксициллин, диклоксациллин, оральные цефалоспорины, клиндамицин.
Следующие препараты не используются: сульфаниламиды, триметоприм, тетрациклины, хлорамфеникол.
Вторичная профилактика ОРЛ(профилактика ревмоатак):
| Бензатин-пенициллин G | 1 200 000 ЕД | В/м каждые 3 недели |
| Пенициллин V | 250 мг 2 раза в день | Per os |
| Сульфадиазин | 0,5 г 1 раз/сут (< 60 кг) и 1 г (> 60 кг) | Per os |
| При аллергии к пенициллину и сульфадиазину: | ||
| Эритромицин | 250 мг 2 раза в день | Per os |
Принципы профилактики:
проводится круглогодично до 20-летнего (ВОЗ – до 25) возраста и в течение 5 лет после последней ревмоатаки. При наличии порока сердца профилактика проводится пожизненно.
обязательна при определенных эпидемиологических факторах риска: школьники, студенты, солдаты и т.д.
новое направление: вакцинация очищенным М-протеином клеточной стенки стрептококка.
обязательно должна проводиться профилактика ИЭ при дентальных вмешательствах у больных с ревматическими пороками сердца.
обязательно продолжение профилактики после хирургического лечения ревматических пороков сердца.
 3. Хронический тонзиллит.
3. Хронический тонзиллит.
Хронический тонзиллит — длительное воспаление глоточных и небных миндалин (от лат. tonsillae — миндалевидные железы) развивается после перенесённой ангины и других инфекционных болезней, сопровождающихся воспалением слизистой оболочки зева (скарлатина,
корь, дифтерия), или без предшествующего острого заболевания. Рис. 5.
Эпидемиология:
Распространенность хронического тонзиллита достигает уровня 10% среди взрослых и 15% - среди детей. В группе часто и длительно болеющих детей этот показатель еще выше и составляет более 50%. В группе диспансерного наблюдения у оториноларинголога пациенты этой категории составляют от 64 до 79% всех больных.
Этиология:
Наиболее часто хронический тонзиллит возникает после ангины - это один из основных признаков, по которому ориентируются врачи - наличие частых ангин (более двух в анамнезе считают частыми) повод для постановки этого диагноза. По данным статистики, без предшествующей ангины, тонзиллит возникает не более чем в 2-3% случаев, такой тонзиллит называют "безангинным". Однако не у всех переболевших ангиной может развиться хронический тонзиллит.
Патогенез:
Ведущим патофизиологическим процессом заболевания является репаративное замещение паренхимы миндалины соединительной тканью. Пусковым фактором в развитии хронического тонзиллита выступает возбудитель, обладающий сниженным потенциалом гноеродности, характеризующийся нивелированием антигенного стимула, выпадающий из адекватного иммунологического контроля из–за содержания в своей структуре мимикрирующих антигенов. Благодаря этому в миндалинах наряду с элементами продуктивного воспаления идет медленное замещение паренхимы миндалин соединительной тканью за счет клеточно–волокнистой трансформации фибробластов, образование инкапсулированных очагов некроза и вовлечение в воспаление регионарных лимфатических узлов. Одновременно секвестрированные антигены миндалин в очагах микронекроза и мимикрирующие антигены возбудителя индуцируют иммунопатологический фон, который проявляется формированием аутоиммунных реакций гуморального и клеточного типа по отношению к тканям миндалин и пролиферирующей соединительной ткани, что неизбежно приводит к срыву иммунологической толерантности с формированием аутоиммунного патологического статуса. Именно этот патогенез хронического тонзиллита нашел отражение в клинической классификации Б.С. Преображенского–В.Т. Пальчуна, предусматривающей три стадии.
Простая форма или начальная стадия, характеризуется не столько частыми ангинами в анамнезе, сколько местными признаками (наличие жидкого гноя или гнойно–казеозных пробок в лакунах миндалин, субэпителиальные гнойные фолликулы, сращение с дужками и треугольной складкой, увеличение и болезненность при пальпации отдельных групп регионарных лимфатических узлов), при этом могут наблюдаться сопутствующие заболевания, не имеющие единой этиологической и патогенетической основы с хроническим тонзиллитом.
Токсико–аллергическая форма I (ТАФ I) характеризуется периодическими ангинами в анамнезе, всеми признаками, рассмотренными выше, в сочетании с общими токсико–аллергическими явлениями (периодически субфебрильная температура, проявление тонзиллогенной интоксикации со слабостью, недомоганием, быстрой утомляемостью, периодические боли в суставах, боли в сердце в период обострения без объективных нарушений на ЭКГ), которые усугубляются после любого острого респираторного заболевания или перенесенной ангины, образую астенический «хвост» функциональных нарушений.
Токсико–аллергическая форма II (ТАФ II)характеризуется более выраженными признаками I формы (функциональные нарушения сердечной деятельности, регистрируемые на ЭКГ, боли в сердце и нарушение ритма сердца, как во время ангины, так и вне обострения хронического тонзиллита, длительная субфебрильная температура, функциональные нарушения в почках, печени, сосудистой системе, суставах, регистрируемые лабораторно) и сопряженными заболеваниями, имеющими с хроническим тонзиллитом единые этиопатогенетические факторы: местными (паратонзиллярный абсцесс, парафарингит, фарингит) и общими (острый и хронический тонзиллогенный сепсис, ревматизм, инфекционные артриты, приобретенные пороки сердца, заболевания мочевыделительной системы, предстательной железы, щитовидной железы, оболочек мозга).
Наиболее достоверными местными признаками хронического тонзиллита являются:
1. Гиперемия и валикообразное утолщение краёв нёбных дужек.
2. Рубцовые спайки между миндалинами и нёбными дужками.
3. Разрыхленные или рубцово-изменённые и уплотнённые миндалины.
4. Казеозно-гнойные пробки или жидкий гной в лакунах миндалин.
5. Регионарный лимфаденит - увеличение шейных лимфоузлов.
Диагноз ставят при наличии двух и более вышеперечисленных местных признаков тонзиллита.
Принято также выделять две основные формы тонзиллита: компенсированная и декомпенсированная.
При компенсированной форме имеются лишь местные признаки хронического воспаления миндалин, барьерная функция которых и реактивность организма ещё таковы, что уравновешивают, выравнивают состояние местного воспаления, т.е. компенсируют его, поэтому выраженной общей реакции организма не возникает.
При декомпенсированной имеются не только местные признаки хронического воспаления, а бывают ангины, паратонзиллиты, паратонзиллярные абсцессы, заболевания отдалённых органов и систем (сердечно-сосудистой, моче-половой и др.)
Лечение:
Выбор метода лечения зависит от формы тонзиллита и, если она декомпенсированная, то учитывают вид декомпенсации.
Перед началом лечения следует вылечить кариозные зубы и воспалительные процессы в носу и придаточных пазухах носа. Различают два основных метода лечения: хирургический и консервативный. В каждом методе имеются ещё свои разновидности, варианты.
В подавляющем большинстве случаев сначала должно быть проведено консервативное лечение, и только при отсутствии эффекта или недостаточном эффекте необходимо поставить вопрос о хирургическом вмешательстве. Исключение составляют те больные, у которых имеются абсолютные и срочные показания к тонзиллэктомии.
Консервативные методы лечения условно можно разделить на общие и местные. К общим методам принадлежат закаливающие процедуры: физические занятия на свежем воздухе, обтирания комнатной, а затем холодной водой, систематические занятия спортом. Они, безусловно, имеют большое значение в лечении хронического тонзиллита и предупреждении рецидивов ангины, однако надо твердо помнить, что с успехом их можно применять лишь при компенсированном тонзиллите, вне стадии обострения. Следовательно, больные хроническим компенсированным тонзиллитом вне стадии обострения в специальном лечении не нуждаются. Физиотерапевтические процедуры (коротковолновое УФ-облучение, диатермия на подчелюстную область и пр.), лечебная гимнастика могут быть применены как составные части комплексного течения больных субкомпенсированным хроническим тонзиллитом. Однако такие больные нуждаются в освобождении от всех физических работ, и их лечение проводит ларинголог, либо под его непосредственным руководством (по усмотрению специалиста) - лечащий врач. К «местным» консервативным методам лечения хронического тонзиллита относятся: смазывания миндалин и их лакун различными растворами (1-5% йодная настойка, люголевский раствор, йодглицерин и пр.), промывание лакун, местное ультрафиолетовое облучение миндалин и многое другое.
Терапевтические показания к хирургическому лечению хронического тонзиллита можно условно разделить на: 1) абсолютные и 2) относительные.
К абсолютным показаниям надо отнести назревание или возникновение у больного хроническим тонзиллитом метатонзиллярных заболеваний, особенно ревматизма, миокарда, нефрита и холангиогепатита. Хотя при уже развившейся метатонзиллярной болезни тонзиллэктомия не приводит к немедленной ее ликвидации, но облегчает лечение, уменьшает вероятность обострения и рецидивов уже развившегося тонзиллогенного заболевания. К абсолютным показаниям надо отнести также декомпенсированный тонзиллит, не поддающийся консервативному лечению.
Относительные показания - это умеренные расстройства функций различных органов и систем (умеренная тонзиллогенная интоксикация). В таких случаях целесообразно провести пробное консервативное лечение хронического тонзиллита (промываниями лакун, например). Если при этом наряду со стиханием воспалительного процесса в миндалинах исчезнут и явления дисфункции других органов, то имеются все основания рассчитывать на положительный эффект тонзиллэктомии. Хирургическое лечение тонзиллита, с одной стороны, прост (небольшая операция), не отнимает много времени и эффективен - так как миндалины удаляются, хронического тонзиллита быть не может. Но с другой стороны, не всегда удаление миндалин благоприятно для организма. У таких пациентов могут развиваться хронические фарингиты, ларингиты и бронхиты, они чаще подвержены простудным заболеваниям, поскольку миндалины участвуют в формировании иммунитета, то слабеют защитные механизмы организма.
Гломерулонефрит
- диффузное воспалительное заболевание почек с преимущественным поражением клубочков.
Этиология:
Основным этиологическим фактором ГН являются стрептококк, главным образом в-гемолитический XII типа группы А, и заболевания, связанные со стрептококковой (чаще очаговой) инфекцией (ангина, хронический тонзиллит, отит, гайморит, скарлатина, фурункулез и др.). Фактор охлаждения, особенно воздействие влажного холода, является предрасполагающим у лиц, сенсибилизированных к стрептококку.
Патогенез:
 В настоящее время общепризнана иммуновоспалительная концепция генеза этого заболевания. Иммунные процессы определяют не только возникновение, но и прогрессирование гломерулонефрита, переход острых его форм в хронические. Возможны два варианта иммунопатогенеза гломерулонефрита. При одном из них (аутоиммунном) иммунные комплексы образуются в результате взаимодействия антител (аутоантител) с антигенами (аутоантигенами), являющимися белковыми
В настоящее время общепризнана иммуновоспалительная концепция генеза этого заболевания. Иммунные процессы определяют не только возникновение, но и прогрессирование гломерулонефрита, переход острых его форм в хронические. Возможны два варианта иммунопатогенеза гломерулонефрита. При одном из них (аутоиммунном) иммунные комплексы образуются в результате взаимодействия антител (аутоантител) с антигенами (аутоантигенами), являющимися белковыми
Рис. 6.частицами самой почечной ткани, главным образом базальных мембран клубочковых капилляров. Эти комплексы формируются и располагаются на базальных мембранах, вызывая их повреждение. При другом варианте иммунопатогенеза образование иммунных комплексов происходит в крови в результате взаимодействия антител с внепочечными антигенами (в том числе со стрептококковыми). Эти иммунные комплексы вначале циркулируют в крови, затем осаждаются на базальных мембранах клубочков либо в мезангии и вызывают развитие воспалительного процесса, характерного для гломерулонефрита. Это иммунокомплексный вариант гломерулонефрита, на который приходится 60-80 % всех случаев этого заболевания. В патогенезе гломерулонефрита определенная роль отводится и реакциям клеточного иммунитета с участием Т- и В-лимфоцитов. Из не иммунных факторов в механизме развития этого заболевания существенное значение имеют нарушения почечной гемодинамики, микроциркуляции и реологических свойств крови.
Клиническая картина:
Основные, кардинальные признаки ГН - отечный, гипертензивный и мочевой синдромы. При типичном (классическом) варианте начала и течении ОГН выражены все признаки заболевания. При атипичном (стертом) варианте, который встречается значительно чаще, чем типичный, внепочечные признаки (отеки, гипертензия) отсутствуют либо слабо выражены, выявляется лишь умеренный или минимальный мочевой синдром.
В типичных случаях ГН начинается остро, бурно, четко связан с перенесенной ангиной, обострением хронического тонзиллита, фарингита или другой очаговой стрептококковой инфекцией, предшествовавшей возникновению первых признаков заболевания за 1-3 нед. На первый план выступают головная боль, слабость, общее недомогание, снижение аппетита, одышка, сердцебиение, боли в области сердца, поясницы, в ряде случаев учащенное и болезненное мочеиспускание, малое количество и изменение цвета мочи, появление отеков. Отмечается бледность кожных покровов, одутловатость лица. В тяжелых случаях больные принимают вынужденное сидячее или полу сидячее положение в постели вследствие явлений острой (чаще левожелудочковой) сердечной недостаточности. Наблюдаются цианоз губ, акроцианоз, дыхание учащенное и глубокое, затрудненное.
Часто первым проявлением ГН служат отеки, для которых характерны быстрое возникновение (иногда в течение нескольких часов, суток) и повсеместность распространения (на лице, туловище, конечностях); в отдельных случаях они сопровождаются развитием асцита, гидроторакса, гидроперикарда. Могут иметь место и так называемые скрытые отеки. Задержку жидкости в организме у таких больных можно выявить лишь путем их систематического взвешивания и контроля за количеством выпитой ими жидкости и выделенной в течение суток мочи. В большинстве случаев при благоприятном течении заболевания отеки исчезают к 10-14-му дню. В происхождении отечного синдрома участвует комплекс патогенетических факторов, в том числе почечных (снижение клубочковой фильтрации и усиление канальцевой реабсорбции воды и натрия) и внепочечных (повышение общей сосудистой проницаемости, снижение онкотического давления в крови, усиление секреции альдостерона и задержки натрия в организме, увеличение концентрации в крови АДГ и связанное с этим нарастание реабсорбции воды в дистальных отделах почечных канальцев, гидрофильности самих тканей.
К наиболее важным и ранним признакам ГН относится гипертензия. Чаще АД повышается умеренно: до 140-160 мм рт. ст. систолическое и до 95-110 мм рт. ст. диастолическое, реже достигает высокого уровня - 220/115-230/130 мм рт. ст. и выше. При благоприятном течении заболевания АД нормализуется на протяжении 2-3 нед, при неблагоприятном гипертензия может держаться и более длительный срок. Патогенез гипертензивного синдрома сложен и окончательно не выяснен. Важная роль в его возникновении отводится увеличению ОЦК и повышению периферического сопротивления; определенное значение имеет повышение активности системы ренин-ангиотензин-альдостерон, особенно при затянувшемся и неблагоприятном течении ОГН с тенденцией к переходу в ХГН.
Частым признаком ГН является брадикардия, которая возникает в первые дни заболевания и держится 1-2 нед. Сочетание брадикардии, гипертензии и отеков служит важным дифференциально-диагностическим критерием для различия отеков, обусловленных гломерулонефритом и заболеваниями сердца, при которых они, как правило, сочетаются с тахикардией. Сужение артерий глазного дна встречается примерно в 5-10 % случаев. Иногда при тяжелом течении заболевания и высокой стойкой гипертензии наблюдаются точечные кровоизлияния на глазном дне.
В первые дни заболевания у большинства больных наблюдается олигурия (до 400-500 мл/сут). Более значительное снижение суточного диуреза отмечается редко и держится недолго (1-3 сут), затем сменяется полиурией. Выраженная олигурия или анурия, продолжающаяся более чем 1-3 сут, опасна в отношении развития ОПН.
Протеинурия, за редким исключением, встречается у всех больных ОГН. Степень ее выраженности - от 1 г/л и меньше до 16-30 г/л и больше. Соответственно и суточная протеинурия варьирует от нескольких сот миллиграммов до 3-5-10 г и выше. Наиболее высокая протеинурия наблюдается в начале заболевания, затем она постепенно уменьшается и полностью исчезает в интервале от 2-4 нед до 1-3 мес. При затянувшемся течении может сохраняться 1-1,5 года. В редких случаях, при наличии внепочечных признаков ОГН, протеинурия может отсутствовать.
Гематурия, или эритроцитурия, также появляется в начале заболевания, чаще в виде микрогематурии (от 5-15 до 50-100 эритроцитов в поле зрения), реже в виде макрогематурии, когда моча приобретает цвет мясных помоев. Возникая в первые часы и дни заболевания и исчезая позже других клинических и лабораторных проявлений ОГН, протеинурия и гематурия наиболее ярко отражают динамику заболевания, его активность, течение, процесс выздоровления. Сохраняясь иногда длительное время (до 3-6 мес) в виде так называемых остаточных явлений острого нефрита, они свидетельствуют о том, что воспалительный процесс в почках еще не закончен.
Изменения периферической крови при ГН не специфичны и не имеют определенной закономерности. В первую фазу заболевания может наблюдаться небольшой лейкоцитоз (9-12- 109/л) с лимфоцитопенией. Часто обнаруживается эозинофилия. Увеличение СОЭ до 20-50 мм/ч в определенной мере является показателем активности патологического процесса; она снижается по мере затухания воспалительного процесса в почках и возвращается к норме при выздоровлении. Незначительная гиперазотемия встречается лишь у больных с олигурией, держится недолго и обычно с нарастанием диуреза исчезает. Уровень общего белка в сыворотке крови сохраняется в пределах нормы и лишь в редких случаях, сопровождающихся нефротическим синдромом, снижается до 60 г/л и меньше. Диспротеинемия выражается в умеренном снижении концентрации альбуминов и увеличении содержания глобулинов, главным образом а,- и а2-глобулинов, реже у-глобулинов. Иногда отмечаются преходящая умеренная гиперхолестеринемия и гиперлипидемия.
Диагноз ГН в типичных случаях не представляет трудностей, тем более если имеется отчетливая связь со стрептококковой инфекцией. В то же время диагностика моносимптомных, стертых форм часто вызывает большие затруднения.
Тщательный анамнез, знание клиники упомянутых заболеваний, использование клинико-лабораторных, биохимических, рентгеноурологических, радиоизотопных и специальных методов исследования, определение состояния функции почек позволяют избежать существенных ошибок в диагностике и в большинстве случаев установить правильный диагноз.
Прогноз:
Летальность при ОГН не превышает 0,1 %, чаще связана с острой сердечной и острой почечной недостаточностью. При благоприятном течении выздоровление наступает в первые 2-4 нед или в первые 2-3 мес, однако может длиться 1-1,5 года.
Лечение:
Все больные ОГН должны госпитализироваться в нефрологическое либо терапевтическое отделение. Назначаются постельный режим продолжительностью не менее 2-4 нед, диета, основной принцип которой - ограничение поваренной соли, жидкости (в тяжелых случаях до 400-600 мл/сут).
Симптоматическая медикаментозная терапия направлена на ликвидацию основных внепочечных проявлений гломерулонефрита (отеков, гипертензии, сердечной недостаточности)
В начале заболевания, в связи со стрептококковой этиологией ОГН, целесообразны антибиотики, не оказывающие нефротоксического эффекта.
В комплексной терапии и при долечивании остаточных явлений и затянувшихся форм ОГН весьма важная роль отводится санаторно-курортному лечению.
Профилактика:
ГН основывается на современных представлениях о его этиологии и заключается в проведении мероприятий, направленных на предупреждение и тщательное лечение острых и обострения хронических очагов стрептококковой инфекции (ангины, хронического тонзиллита, фарингита и др.). Необходимо избегать длительного переохлаждения и особенно действия влажного холода, соблюдать особую осторожность в отношении повторных введений сывороток, лекарственных препаратов и вакцин лицам, у которых ранее на их введение наблюдались аллергические реакции, сопровождающиеся патологическими изменениями в моче.
Больным, перенесшим стрептококковую или вирусную инфекцию либо подвергшимся воздействию других факторов, угрожающих развитием ОГН, рекомендуется в течение месяца проводить 2-3 исследования мочи с интервалами 10-14 дн.
Пиелонефрит.
Пиелонефрит – это инфекционно-воспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы, тубулоинтерстициальной ткани и нередко с вовлечением клубочкового аппарата.
Эпидемиология.
Наибольшему риску заболеть подвержены 3 группы населения: девочки, беременные и лица преклонного возраста. В детском возрасте частота составляет 7,3-27.7случаев на 1000, у взрослых 0,82-1.46 на 1000. В год по России регистрируется 0,9-1,3млн новых случаев пиелонефрита, из них 0,3 обусловлены перенесённой стрептококковой инфекции.
Этиология:
Наиболее частый возбудитель пиелонефрита - кишечная палочка, реже - протей и синегнойная палочка. Грамположительные микробы (стафилококк и энтерококк) также могут быть возбудителями этого заболевания. Нередко отмечается смешанная бактериальная флора, особенно при хроническом течении пиелонефрита.
В последние годы признаются 2 основных пути проникновения микробной инфекции в почку: восходящий и гематогенный. Лимфогенный путь инфицирования почек маловероятен, так как лимфатическое сообщение между мочевым пузырём, лоханкой и почками отсутствует.
Гематогенным путь. При этом первичный воспалительный очаг может находиться в другом органе (ангина, тонзиллит, отит, синусит, кариес, бронхит, фурункул и т.д.) или в другой части мочеполовой системы. С током крови микроорганизмы попадают в почки. Для того, чтобы инфекция задержалась в почках, необходимы предрасполагающие факторы: часто это нарушение оттока мочи и расстройство кровообращения в почке. Но некоторые микроорганизмы могут поражать и абсолютно здоровую почку, например, несколько видов стафилококков. Занесенные кровью в почки микробы оседают на сосудистых петлях почечных клубочков, вызывают изменения внутренней оболочки сосудов, разрушают ее, проникают в просвет почечных канальцев и выводятся с мочой. Вокруг этих микробных тромбов развивается воспалительный процесс. К десятому дню от начала инфекции острый период заканчивается. Через три недели начинается восстановление ткани почки, и к шестой неделе на месте воспаления формируется рубец.
Клиника:
Заболевание начинается внезапно, резко повышается температура до 39-40 °С, появляются слабость, головная боль, обильное потоотделение, возможны тошнота и рвота. Одновременно с температурой появляются боли в пояснице, как правило, с одной стороны. Боли носят тупой характер, но интенсивность их может быть различная.
При отсутствии лечения заболевание либо переходит в хроническую форму, либо развиваются нагноительные процессы - апостематозная форма пиелонефрита, абсцесс или карбункул почки. Нагноительные процессы проявляются ухудшением состояния больного, резкими скачками температуры (от 35-36 °С утром до 40-41 °С вечером).
Хронический пиелонефрит, как правило, является следствием не долеченного острого пиелонефрита, когда удалось снять острое воспаление, но не удалось ни полностью уничтожить всех возбудителей в почке, ни восстановить нормальный отток мочи из почки. Хронический пиелонефрит может постоянно беспокоить пациента тупыми ноющими болями в пояснице, особенно в сырую холодную погоду. Кроме того, хронический пиелонефрит время от времени обостряется, и тогда у больного появляются все признаки острого процесса.
Диагностика:
- общий анализ крови, мочи, УЗИ почек.
Лечение:
- Питьевой режим
- Антибактериальная терапия в течение 7-10 дней, эмпирическая (до высева возбудителя) и целенаправленная (после определения чувствительности микрофлоры к антибиотикам).
- Иммунокоррекция
- При анемии — препараты железа, переливание крови, эритроцитарной массы.
- Хирургическое лечение. При гнойном пиелонефрите в случае безуспешности консервативной терапии — декапсуляция почки, пиелонефростома и дренирование почечной лоханки.
Течение и прогноз.
Прогноз ухудшается по мере увеличения длительности пиелонефрита, при внутрибольничных пиелонефритах, устойчивости микробов к антибактериальным средствам, закупорки мочевых путей, наличии гнойных осложнений, иммунодефицитных состояниях, частых рецидивах. Полное выздоровление при остром пиелонефрите возможно при ранней диагностике, рациональной антибиотикотерапии, отсутствии отягощающих факторов. У 10—20% больных хроническим пиелонефритом развивается хроническая почечная недостаточность. У 10 % больных с артериальной гипертензией происходит её озлокачествление.
Профилактика:
Основной рекомендацией по профилактике пиелонефрита является лечение основного заболевания, которое может привести к его развитию.
Сепсис
Сравнительно редко встречается общее осложнение ангины — сепсис.
Сепсис- инфекционная болезнь, обусловленная различными возбудителями, которая развивается у лиц с резко сниженными защитными силами организма. Характеризуется наличием первичного очага, из которого происходит повторная гематогенная диссеминация возбудителя с поражением различных органов и систем, в связи с этим процесс теряет цикличность, характеризуется тяжелым прогрессирующим течением и отсутствием тенденции к спонтанному выздоровлению.
Практически единственной причиной сепсиса являются условно-патогенные
бактерии. К ним относятся грам (+) кокковая флора, прежде всего золотистый
стафилококк, а также стрептококки, пневмококки, энтерококки и
грамотрицательная палочковидная флора – кишечная и синегнойная палочки,
клебсиеллы, энтеробактер, протей и др.
Патогенез:
Развитие бактеремии, циркуляция возбудителей в сосудистом русле сами по себе еще не свидетельствуют о развитии или даже облигатной угрозе развития сепсиса. Ключевым звеном патогенеза является срыв защитных механизмов ответной реакции, что и определяет стабилизацию бактеремии, развитие необратимого генерализованного инфекционного процесса ациклического течения. В первую очередь–это неспецифические защитные механизмы. Роль снижения иммунного ответа существенно меньшая, иммунитет не предназначен для подавления условно-патогенной флоры, иначе симбиоз был бы невозможен. Вместе с тем механизмы неспецифической и специфической защиты в значительной степени взаимосвязаны.
Важнейшим механизмом развития и прогрессирования сепсиса является быстрое, практически ничем не ограничиваемое гематогенное распространение возбудителя с образованием вторичных метастатических очагов инфекции в мягких тканях и внутренних органах. Макро- и микрофаги способствуют проникновению возбудителей в разные ткани (феномен незавершенного фагоцитоза).
В результате повреждения эндотелия сосудов повышается их проницаемость,усиливаются процессы внутрисосудистой гипокоагуляции. В конечном счете это приводит к повреждению сосудистой стенки, развитию распространенного септического васкулита, образованию множественных микротромбозов.
Центральным звеном патогенеза сепсиса считают прогрессирующее накопление эндотоксинов, взаимодействующих с рецепторами макрофагов. Это актвизирует синтез провоспалительных цитокинов – ФНО, ИЛ-1, ИЛ-6, ИЛ-8, гамма ИФН и др. Их накопление сопровождается нарушением гемопоэза, обменных процессов, способствует прогрессированию септического васкулита и расстройств микроциркуляции.
Классификация:
Единой классификации сепсиса нет.
По этиологии – сепсис грам(+), грам(-), аэробный, анаэробный, микобактериальный, полибактериальный, стафилококковый, стрептококковый, колибациллярный и др.
По локализации первичных очагов и входных ворот инфекции –
тонзиллогенный, отогенный, одонтогенный, уриногенитальный, гинекологический, раневой сепсис и др. В определенных пределах она позволяет предположить этиологию сепсиса. Если входные ворота неизвестны, то сепсис называется криптогенным.
По течению – острейший, или молниеносный (необратимая генерализация в первые 24 часа), острый (необратимая генерализация в 3-4дня) и хронический сепсис.
По фазам развития – 1. токсемическая, 2. септицемия, 3. септикопиемия
Выделяют стадийность заболевания: сепсис, тяжелый сепсис и септический шок.
Основным отличием сепсиса от тяжелого сепсиса является отсутствие органной дисфункции. При тяжелом сепсисе возникают признаки органной дисфункции, которые при неэффективном лечении прогредиентно нарастают и сопровождаются декомпенсацией. Результатом декомпенсации функции органов является септический шок, который формально отличается от тяжелого сепсиса
гипотензией, однако представляет собой полиорганную недостаточность, в основе которой лежит тяжелое распространенное поражение капилляров и связанные с этим грубые метаболические нарушения.
Клиника:
В отличие от всех других инфекционных болезней сепсису присуще ациклическое течение с прогрессирующим гематогенным распространением возбудителя, не контролируемым защитными механизмами.
Клинические проявления сепсиса варьируют в широких пределах от не привлекающих к себе внимания начальных микросимптомов до крайне тяжелого состояния, требующего езотлагательной интенсивной терапии.
Наиболее характерные клинические проявления сепсиса: