Механизм действия ферментов
Изменение свободной реакции при катализируемой и некатализируемой реакции представлено на рисунке 1.
Энергия активации – это дополнительное количество энергии, которое необходимо дать молекуле для преодоления энергетического барьера (или для достижения переходного состояния), т.е. это энергия, необходимая для перевода всех молекул моля вещества в активированное состояние. Ферменты ускоряют реакцию путем снижения энергии активацииза счет увеличения числа активизированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне.
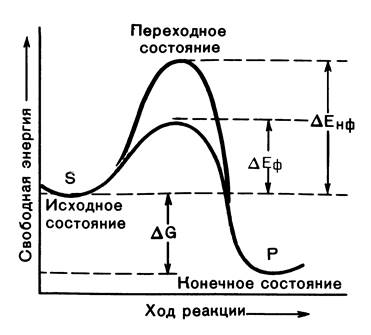
Рис.1. Изменения свободной энергии катализируемой и некатализируемой реакции. S – исходный субстрат; Р – продукт; ΔЕнф – энергия активации неферментативной реакции; ΔЕф – энергия активации ферментативной реакции; ΔG – стандартное изменение свободной энергии.
Ферментативный катализ идет в 3 стадии:
| k1 k3 E + S ® ES ® (EZ - EP) —®E + P k2 |
I стадия – присоединение молекулы субстрата к молекуле фермента и образование фермент-субстратного комплекса: E + S « ES
Изменение энергии активации на этой стадии незначительно. В образовании фермент-субстратного комплекса участвуют водородные связи, электростатические и гидрофобные взаимодействия. Для этой стадии важно сближение и правильная ориентация фермента и субстрата. Сближение и необходимая ориентация реагентов значительно повышают вероятность образования продуктивного фермент-субстратного комплекса. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата. В результате удаления молекул воды в активном центре фермента во время катализа создаются совершенно другие условия, чем в растворе. В сумме эти факторы дадут ускорение реакции в 104 раз.
Существует 2 теории объясняющие взаимодействие фермента и субстрата.
1. В соответствии с теорией Э.Фишера (1890) фермент и субстрат подходят друг другу как ключ к замку. Это означает, что структура фермента и субстрата строго комплементарны.
2. Согласно гипотезе Д.Кошланда (1958) «индуцированного» или «вынужденного» соответствия фермент изменяет конформацию активного центра при присоединении субстрата. Кроме того, в процессе присоединения происходит перестройка молекул субстрата.
Доказательства существования фермент-субстратного комплекса:
1. При одинаковой концентрации фермента скорость реакции повышается с повышением концентрации субстрата по гиперболической зависимости, а не катализируемая ферментом реакция не дает такого эффекта насыщения. Наличие эффекта насыщения свидетельствует в пользу образования дискретного ЕS-комплекса; если все каталитические центры фермента будут заняты скорость реакции не будет повышаться, а останется постоянной.
2. При современных вариантах рентгеновских кристаллографических исследований доказано наличие фермент-субстратных комплексов при действии многих ферментов.
3. Методы спектроскопического анализа доказали наличие фермент-субстратных комплексов по изменению спектров поглощения или флуоресценции в процессе катализируемой реакции.
II стадия – преобразование фермент-субстратного комплекса в один или несколько последовательных (переходных) комплексов с образованием на поверхности фермента конечного продукта реакции:
ES ® EZ® EP
На этой стадии происходит образование переходных состояний, продолжительность жизни которых составляет 10-14-10-13 с. При этом важным фактором является стабилизация переходного состояния вследствие взаимодействия между функциональными группами субстрата и фермента. Переходное состояние в случае ферментативной реакции требует меньшей энергии активации.
Механизмы действия ферментов на этой стадии объясняются эффектом деформации субстрата, кислотно-основным и ковалентным катализом. Эффект деформации субстрата (или так называемая теория «дыбы») объясняет действие гидролаз, лиаз и трансфераз. После связывания с активным центром молекула субстрата как бы растягивается на активном центре фермента. Чем больше длина межатомной связи в субстрате, тем меньше энергия ее разрыва.
Многие ферменты во время катализа переносят специфические группировки от субстрата или на субстрат. Особенно часто осуществляется перенос протонов. Этот ферментативный кислотно-основный катализ более эффективен, чем обмен протонов с кислотами и основаниями в растворе. При закреплении субстрата в активном центре на его молекулу влияют электрофильные и нуклеофильные группы каталитического участка, что вызывает перераспределение электронной плотности на участках субстрата, атакуемого кислотно-основными группами.
Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом. Ковалентные фермент-субстратные комплексы очень неустойчивы и легко распадаются. Ковалентный катализ подразумевает наличие реакционных групп в активном центре, чаще всего нуклеофильного типа, которые вступают во временные ковалентные связи с субстратом в процессе катализа (так реализуется протеолитическое действие химотрипсина).
Вторая стадия лимитирует скорость всего катализа. Скорость катализируемого процесса очень чувствительна к величине энергии активации. Ее изменение, соответствующее образованию всего одной водородной связи, может ускорить реакцию в миллион раз.
На этой стадии возможно разделение реакции на 2-3 этапа, каждый из которых требует меньшей энергии активации, чем если бы процесс осуществлялся в один этап. При такой разбивке суммарная энергия активации будет такой же как и при одноэтапном процессе, но энергетический барьер будет уменьшен. В результате всех механизмов второй стадии катализа скорость реакции может увеличиться до 1010 раз.
III стадия – отделение продукта реакции от фермента: EP ® E+P.
Стадия непродолжительна и определяется скоростью диффузии продуктов реакции в окружающую среду. Фермент освобождается без изменений. Суммарное повышение скорости катализируемой реакции может достигать 1014-1016 раз.