Реакция на молочную кислоту в желудочном содержимом
При отсутствии соляной кислоты, обладающей бактерицидными свойствами, в желудке могут развиться процессы брожения, сопровождающиеся накоплением короткоцепочечных (молочной, уксусной и масляной) кислот. Их обнаружение в желудочном содержимом свидетельствует о глубокой гипохлоргидрии или ахлоргидрии.
Ход работы
Для приготовления реактива на молочную кислоту к 1,5 мл 1% раствора фенола добавьте несколько капель 1% раствора хлорного железа и взболтайте. Реактив окрашивается в фиолетовый цвет. Разведите его водой до слабой окраски. В три пробирки налейте по 10 – 15 капель этого реактива, затем в 1-ую пробирку добавьте по каплям 1% раствор молочной кислоты, во 2-ю – исследуемый желудочный сок, в 3-ю - раствор соляной кислоты (контроль). В 1-ой пробирке наблюдается желто-зеленое окрашивание (окраска обусловлена образованием молочнокислого железа). Во 2-ой пробирке желто-зеленое окрашивание разовьется в случае наличия в желудочном содержимом молочной кислоты. В 3-ей пробирке раствор обесцвечивается.
18.3. Определение активности аланин-аминотрансферазы
Аланин-аминотрансфераза (АЛТ) (L-аланин: 2-оксоглутаратаминотранс-фераза) - присутствует в большинстве органов: печени, почках, скелетных мышцах, миокарде, поджелудочной железе. Максимальное количество данного фермента обнаруживается в тканях печени и почек. Его активность в сыворотке (плазме) крови здоровых людей значительно ниже, чем в тканях; при патологии (особенно при заболеваниях печени) активность АЛТ в сыворотке крови существенно повышается. В клетках этот энзим содержится в двух изоформах - цитозольной и митохондриальной, но содержание митохондриального фермента и вероятность его экскреции незначительны, поэтому основная доля плазматической активности АЛТ обусловлена действием цитозольного изоэнзима. Пиридоксальфосфат служит его коферментом. Аланинаминотрансфераза обратимо катализирует реакцию переноса амино- и кетогрупп между L-аланином и остатком -кетоглутаровой кислоты :
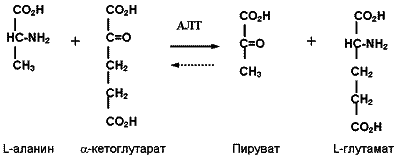
Химизм указанной реакции положен в основу большинства методов определения активности фермента в плазме / сыворотке крови. Для определения активности аланинаминотрансферазы существуют две группы методов: по конечной точке (колориметрические методы с использованием различных красителей) и кинетические (в основном, базирующиеся на методе Варбурга по считыванию восстановления/окисления НАДФН при 340 нм - в ультрафиолетовом спектре). Последние пользуются наибольшей популярностью в современной лаборатории. Метод основан на следующей реакции: пируват, образующийся в результате переаминирования аланина и α-кетоглутарата восстанавливают в лактат путем окисления НАДН+Н+, катализируемого НАД-зависимой лактатдегидрогеназой.
 Пируват + НАДН+Н+ лактатдегидрогеназа Лактат + НАД+
Пируват + НАДН+Н+ лактатдегидрогеназа Лактат + НАД+
Уменьшение концентрации НАД·Н при этой реакции ведет к снижению оптической плотности раствора при 340 нм в первые 2-3 минуты реакции и отражает активность АЛТ.
В норме активность фермента в сыворотки крови не должна превышать 45Ед/л.