К выполнению контрольной работы
Задание на контрольную работу состоит из четырех вопросов и задачи.
Для ответа на вопросы №№ 1-40 необходимо изучить материал соответствующего раздела или темы дисциплины по рекомендуемым источникам литературы, указанным в каждой теме программы, а также в разделе «Перечень рекомендуемой литературы» данного методического пособия.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
По решению задач
При решении задач 41 - 46 следует изучить тему 1.2. Строение и свойства строительных материалов учебника [1].
Внимательно прочитав условие задачи, следует разобраться, какие величины заданы и что требуется найти, написать краткое условие, используя для исходных и искомых величин принятые формулы и обозначения.
Решение задачи следует вести поэтапно, приводя в каждом действии расчетную формулу (при необходимости преобразовав ее), расшифровывая условные обозначения, принятые в формуле; а затем, подставив числовые значения и указав соответствующие им единицы измерения, произвести расчет. Обязательно написать ответ задачи, полученный в результате ее решения.
Рекомендации по использованию определений, условных обозначений, единицы измерения и формул для расчета таких физических свойств материалов, как:
Масса материала: m=p•V (кг, г)
Плотность материала истинная: 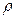 = m/Vа, ( кг/м3, г/см3)
= m/Vа, ( кг/м3, г/см3)
где Vа – абсолютный объем материала без пор и пустот
Плотность материала средняя: 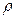 m = m/V; где V- объем материала с порами и пустотами
m = m/V; где V- объем материала с порами и пустотами
Водопоглощение материала по массе: Wm = [(m1- m2.)/ mсух.] •100%
Водопоглощение материала по объему: Wv = [(m1- m2.)/V]•100%,
где m1- масса материала в естественно влажном состоянии,
m2- масса материала, высушенного до постоянной массы
Пористость материала: П = (1- pm / p) •100%
Объем куба: Vкуба = l 3, (м 3, см3 ),
где l - длина грани куба
Объем параллелепипеда: V= l• b• h, (м 3, см3),
где l - длина, b - ширина, h – высота параллелепипеда
Объем цилиндра: Vцилиндра = П ( D2:4) • h ,
где D- диаметр цилиндра
или Vцилиндра = П ( r 2:2) • h , где r- радиус цилиндра
- соотношение между водопоглощением материала по объему и массе:
 |
При решении задачи № 47 недостающие данные и ход решения задачи можно узнать, просмотрев главу 5, лабораторную работу №4 и таблицу 5.1 по учебнику [1].
Для решения задач № 48-50 необходимо изучить главу 6 по учебнику [1]. В основу решения задач такого типа положены химические реакции получения неорганических вяжущих веществ.
При решении задачи № 48 следует рассматривать реакцию разложения карбоната кальция СаСОз (минерала кальцита, входящего в состав известняка) в результате обжига:
CaCO3 = СаО + СО2
Образующееся в результате реакции вещество оксид кальция СаО – это негашеная известь. Природный известняк содержит кроме основного минерала в своем составе примеси (глинозем и др.), которые в том же количестве, в котором содержатся в породе, переходят в образующуюся в результате реакции известь, поэтому при вычислении массы негашеной извести, необходимо сначала вычислить массу известняка без примесей. Найденную массу известняка необходимо написать в уравнение химической реакции над формулой карбоната кальция, обозначив при этом массу оксида кальция за (Х), т.к. это следует из условия задачи. Далее необходимо вычислить относительные молекулярные массы СаСО3 и СаО. Относительная масса молекулы вещества равна сумме относительных атомных масс, входящих в ее состав атомов. Найденные значения подписывают под формулами веществ в уравнение химической реакции. Составив пропорцию, найти массу СаО.
При решении задачи № 49 следует рассмотреть реакцию гашения извести:
СаО + Н2О= Ca(OН)2
Вычислив молекулярные массы СаО, Са(ОН)2 и составив пропорцию в соответствии с уравнением (массовое количество СаО задано), находят массу сухого вещества Са(ОН)2 - гидратной (гашеной) извести.
Для вычисления массы известкового теста следует использовать формулу влажности материала:
W = [(т1 — т)/т]∙100,
где m1 — масса материала во влажном состоянии,
т—масса материала, высушенного до постоянной массы.
Для вычисления объема известкового теста следует использовать определение и формулу для вычисления средней плотности материала (раздел 1, глава 2).
Решая задачу № 50, следует воспользоваться уравнением реакции дегидратации двуводного гипса, протекающей при тепловой обработке (t=110°-180°C) природного гипсового камня:
СаSО4∙2Н2О = СаSО4∙0,5Н2О + 1,5 Н2О
Также, как и при решении задач №№ 48, 49 следует вычислить относительные молекулярные массы веществ, вступающих в реакцию и образующихся в результате реакции.
Необходимо учитывать тот факт, что двуводный и полуводный гипс являются кристаллогидратами, то есть веществами, в состав которых входит кристаллизационная вода; в химических формулах этих веществ формулу воды пишут отдельно (через точку): CaSO4 • 2Н2О; CaSO4 • 0,5Н2О, а массу молекул вычисляют с учетом массы воды (2Н2О и 0,5Н2О соответственно). Затем на основании химического уравнения следует составить пропорцию и вычислить искомую величину - массу полуводного строительного гипса (также называемого алебастром).
МЕТОДИЧЕСКИЕ УКАЗАНИЯ