Закон Гесса и следствия из него
Тепловой эффект химической реакции, протекающей при постоянном объёме или при постоянном давлении характеризуется свойствами функции состояния. Изменение функции состояния не зависит от пути процесса, а определяется только конечным и начальным состоянием системы. Это положение, применённое к химическим реакциям представляет собой закон Гесса, который гласит: тепловой эффект химической реакции не зависит от пути её протекания, а определяется только начальным и конечным состоянием участников реакции и их природой. Закон Гесса можно продемонстрировать схемой превращения углерода в его диоксид

+ О2



 С(тв) СО2(газ)
С(тв) СО2(газ)

 ΔН1
ΔН1
+0,5O2 ΔH2 ΔН3 +0,5О2
CO
Тепловой эффект по пути 1 равен сумме тепловых эффектов по пути 2 и 3:
ΔН1 = ΔН2 + ΔН3 (1.32)
Из закона Гесса вытекает несколько следствий, которые широко используются для термохимических расчётов.
Первое следствие гласит: тепловой эффект химической реакции равен по величине и противоположен по знаку тепловому эффекту обратной химической реакции. Например, для реакции
СаСО3(тв) = СаО(тв) + СО2(газ) (1.33)
тепловой эффект при температуре 298 К равен 21,77 кДж, а для реакции
СаО(тв) + СО2(газ) = СаСО3(тв) (1.34)
он равен – 21,77 кДж.
Согласно второму следствию, тепловой эффект любой химической реакции равен сумме теплот образования продуктов реакции минус сумму теплот образования исходных веществ с учётом стехиометрических коэффициентов. Под теплотой образования понимают тепловой эффект химической реакции образования одного моля вещества из простых веществ. Теплота образования простого вещества принята равной нулю. Например, стандартный тепловой эффект химической реакции
2Fe2O3(тв) + С(тв) = 4FeO(тв) + СО2(газ) (1.35)
при температуре 298 К равен
ΔН  = 4ΔН
= 4ΔН  (FeO) + ΔН
(FeO) + ΔН  (CO2) - 2ΔН
(CO2) - 2ΔН  (Fe2O3) (1.36)
(Fe2O3) (1.36)
где ΔН  (i)- теплота образования i – го участника реакции.
(i)- теплота образования i – го участника реакции.
Тепловой эффект образования углерода, как простого вещества, равен нулю. Величины теплот образования различных соединений при температуре 298 К приведены в термодинамических таблицах.
Третье следствие гласит: тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ минус сумму теплот сгорания продуктов реакции с учётом стехиометрических коэффициентов. Под теплотой сгорания понимают тепловой эффект химической реакции сгорания одного моля вещества до высших оксидов. Например, тепловой эффект химической реакции
С(тв) + 2Н2(газ) = СН4(газ) (1.37)
при температуре 298 К равен
ΔН  = ΔН
= ΔН  (С) + 2ΔН
(С) + 2ΔН  (Н2) - ΔН
(Н2) - ΔН  (СН4) (1.38)
(СН4) (1.38)
где ΔН  (i)- теплота сгорания i – го участника реакции.
(i)- теплота сгорания i – го участника реакции.
1.6 Теплоёмкость и её зависимость температуры
Теплоёмкостью называется количество тепла, которое необходимо подвести к единице массы вещества, чтобы повысить его температуру на один градус. В зависимости от единицы массы вещества различают удельную (  ) и молярную (
) и молярную ( 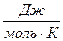 ) теплоёмкость. В химической термодинамике для практических расчётов, как правило, используется молярная теплоёмкость. Различают среднюю и истинную теплоёмкость.
) теплоёмкость. В химической термодинамике для практических расчётов, как правило, используется молярная теплоёмкость. Различают среднюю и истинную теплоёмкость.
Средней молярной теплоёмкостью  в интервале температур от Т1 до Т2 называется отношение количества теплоты, подведённого к одному молю вещества, к разности температур Т2 – Т1:
в интервале температур от Т1 до Т2 называется отношение количества теплоты, подведённого к одному молю вещества, к разности температур Т2 – Т1:
 (1.39)
(1.39)
Истинной теплоёмкостью С называется отношение бесконечно малого количества теплоты, которое необходимо подвести к одному молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается:
С =  (1.40)
(1.40)
В зависимости от условий протекания химической реакции различают теплоёмкость при постоянном объёме СV, которая определяется уравнением:
СV =  (1.41)
(1.41)
и теплоёмкость при постоянном давлении:
СР =  (1.42)
(1.42)
В интегральной форме уравнения (1.41) и (1.42) для n молей вещества можно записать в виде:
QV =ΔU =n  (1.43)
(1.43)
и
QP = ΔH = n  (1.44)
(1.44)
Если в интервале температур Т1 – Т2 теплоёмкость не зависит от температуры, т.е. является постоянной, то после интегрирования уравнений (1.43) и (1.44) получим:
QV =ΔU = nCV(T2 – T1) (1.45)
и
QP =ΔU = nCP(T2 – T1) (1.46)
Для твёрдых и жидких тел разность между СР и CV мала. Для идеальных газов эта разница достаточно велика и определяется соотношением
СР – СV = R (1.47)
Теплоёмкость вещества зависит от температуры. Для органических веществ эта зависимость выражается эмпирическим уравнением:
СР = а + bT + сТ2 (1.48)
Для неорганических веществ эта зависимость имеет вид:
СР = а + bT + с′ Т-2 , (1.49)
где а, b, c и с′- постоянные, независящие от температуры, а зависящие
только от природы вещества.
Если в уравнение (1.39) подставить (1.44), то получим уравнение, выражающее связь между средней и истинной теплоёмкостями при постоянном давлении:
 (1.50)
(1.50)
Среднюю теплоёмкость можно рассчитать графическим путём, если известны значения истинной теплоёмкости в каком–либо интервале температур.