ХИМИОТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ АНТИБИОТИКИ
Химиотерапией называют лечение инфекционных, паразитарных заболеваний или опухолей химиотерапевтическими средствами (химиопрепаратами). Химиотерапевтические препараты (ХТП) - это химические вещества природного или синтетического происхождения, которые в неизменённом виде или после превращения оказывают подавлявшее действие на паразитов во внутренней среде организма без повреждения организма хозяина. Такие вещества должны обладать выраженной этиотропностью (губительным действием, на возбудитель) и минимальной органотропностью /безвредностью для хозяина, а также хорошо растворяться и сохранять активность в организме, быстро всасываться и относительно медленно выводиться из организма, разрушаться в нем, сохранять активность при хранении.
Выделяют следующие основные группы ХТП: антибиотики, сульфаниламиды, нитрофураны, препараты висмута, ртути, мышьяка, антиметаболиты, производные имидазола. В зависимости от вида ХТП, его дозы и чувствительности возбудителя различают действие статическое (задержка роста и размножения) и цидное (полная гибель паразитов). Антимикробным спектром химиоп-репарата называют круг (перечень) чувствительных к нему микробов; спектр может быть узким или широким.
Антибиотикиявляются наиболее обширной группой ХТП. Антибиотическая промышленность - наиболее развитая отрасль биотехнологии. Всего известно около 6000 антибиотиков, из которых в практике используется 50-100. Антибиотики были открыты в начале XX века при изучении микробного антагонизма - конкурентного взаимодействия двух видов, приносящего обоюдный вред. Вредное влияние может проявляться в виде: прямого паразитизма (бактериофаги), конкуренции за питательный субстрат, изменения рН среды, образования простых токсических веществ или специализированных антибиотиков, бактериоцинов (пинов). Бактериоцины - белковые вещества с узким спектром подавляющей активности (как правило, по отношению к микробам того же вида).
Антибиотики - это вещества, в основном, природного происхождения и различной химической структуры, которые в малых концентрациях вызывают' задержку размножения или гибель микробов и опухолевых клеток.
Химическая природа антибиотиков различна: полипептиды, ациклические, ароматические, сложные гетероциклические соединения. В отличие от дезинфектантов, являющихся общепротоплазматическими ядами, антибиотики действуют избирательно, специфически нарушая процессы жизнедеятельности только у определенных групп микробов (их можно считать продуктами и инструментами антагонизма).
По источникам и методам получения различают антибиотики природные, синтетические и полусинтетические.
1. Антибиотики природного происхождения (получают путём биосинтеза)
1) микробного происхождения (их большинство) - образуются актиномицетами (тетрациклины, аминогликозиды, эритромицин, актиномицины), некоторыми бактериями (полимиксины), грибами (пенициллин, гризеофульвин) для их получения штаммы-продуценты выращивают в жидкой питательной среде, после чего клетки удаляют, а препарат в неизменённом виде выделяют из питательной среды и очищают;
2) растительного происхождения (фитонциды) получают физико-химическими методами из растений - листьев эвкалипта (хлорофиллипт), зверобоя (иманин), из лука и чеснока (летучие эфирные масла);
3) животного происхождения - из лейкоцитов (интерфероны, лизоцим), эритротроцитов (эритрин), молоки рыб (экмолин); их получают из соответствующих клеток и тканей, а интерфероны также путем биосинтеза (генно-инженерный препарат).
II. Синтетические - их полностью получают путём химического синтеза (в основном, как аналоги природных соединений) - левомицетин, циклосерин и другие.
III. Полусинтетические антибиотики получают на основе природных соединений, как правило, микробного происхождения, у которых путём химического синтеза изменяют структуру (например, радикалы); этот путь наиболее перспективен, поскольку позволяет повысить активность, растворимость антибиотиков, добиться снижения их токсичности. Например, полусинтетические пенициллины (ампициллин, карбенициллин и др.) получены путём химической модификации ядра пенициллина - беталактамного кольца.
Механизмы действия антибиотиков (точки приложения) различны: повреждение отдельных структур или ферментов их биосинтеза, компонентов систем репликации, трансляции и биосинтеза белка. Основными точками приложения являются:
1) синтез и функции клеточной стенки (циклосерин, беталактамные);
2) функции цитомембраны (полимиксины, полиеновые - нистатин, леворин);
3) синтез белка на различных стадиях, например, при действии на малую субъединицу рибосом (аминогликозиды - стрептомицин, канамицин, гентамицин и др.), на большую субъединицу рибосом (линкомицин, эритромицин, олеандомицин), при нарушении связи тРНК с рибосомальным комплексом (тетрациклины);
4) синтез нуклеиновых, кислот, например, блок РНК-полимеразы (рифампицин, актиномицины).
Биологическая (антимикробная) активность, антибиотиков выражается в ЕД/мл раствора препарата; I ЕД (единица действия) соответствует активности I мкг (10г) химически чистого антибиотика. Активность нового антибиотика устанавливают в стандартном опыте по задержке роста стандартного штамма микроба в сравнении с эталонным препаратом из данной группы.
Побочное действие антибиотиковможет проявляться в отношении микробов и макроорганизма. В отношении макроорганизма различают следующие виды побочного действия:
1) прямое токсическое, связанное с физико-химическими и фармакологическими свойствами препарата или продуктов его распада (аминогликозиды действуют на орган слуха, тетрациклины угнетают функции печени, левомицетин угнетает кроветворение и т.п.);
2) химиотерапевтическое в частности: реакции обострения (вторичная интоксикация продуктами распада микробов под действием антибиотика) и аллергические реакции (будучи аллергенами, антибиотики вызывают сыпи, дерматиты или более тяжелые осложнения по типу анафилаксии);
3) иммунодепрессивное (угнетение индуктивной фазы иммуногенеза приводит послаблению защитных реакций организма, снижению титра антител, что затрудняет диагностику и способствует нестойкости иммунитета);
4) угнетение аутомикрофлоры, сопровождающееся ослаблением её антагонистической (защитной), витаминообразующей и ферментативной функций. Комплекс побочных воздействий антибиотиков нередко приводит к ослаблению организма, развитию дисбактерибзов и суперинфекций (стафилококковых, кандидозных и др.).
Побочное действие антибиотиков на микроорганизмы включает:
1) формирование атипичных штаммов, которые затрудняют диагностику;
2) образование L-форм. не выявляемых обычными методами и малочувствительных к антимикробным воздействиям, способных к длительной персистенции в организме (происходит хронизация инфекции, возникают рецидивы);
3) формирование и распространение лекарственной устойчивости.
Лекарственная устойчивость микробовможет быть связана:
а) с наличием ферментов, разрушающих или инактивирущих антибиотики (например, микробные бета-лактамазы гидролизуют ядро пенициллинов);
б) с нарушение проницаемости оболочки для антибиотика, если точка приложения находится
внутри клетки, а молекула антибиотика достаточно велика (устойчивость к рифампицину);
в) с изменением самих точек приложения (устойчивостьк стрептомицину).
Генетическими механизмами появления и распространения лекарственной устойчивости являются возникновение мутаций и рекомбинации (особенно перенос R -плазмид и транспозонов от устойчивых бактерий к чувствительным). Широкое (и нередко бесконтрольное) применение антибиотиков, особенно в стационарах, создаёт условия для быстрой селекции и широкого распространения антибиотикоустойчивых клонов микробов, расширения спектра их устойчивости.
Для преодоления лекарственной устойчивости микробов необходимо:
1) назначение антибиотиков в соответствии с чувствительностью конкретного возбудителя, выделенного перед началом лечения;
2) применять антибиотики по схеме и в оптимальных дозах;
3) периодически менять препараты в ходе лечения, а на данной территории -1 раз в 3 года;
4) использовать комплекс из 2-3 препаратов с разным механизмом действия
5) использовать антибиотики резерва (второй очереди);
6) стимулировать защитные силы организма, нормализовать его аутофлору.
Чувствительность к антибиотикам и другим ХТП необходимо определять в каждом случае инфекции и периодически - в ходе лечения. Главным показателем является величина минимальной ингибирующей концентрации — МИК (мкг/мл ), т.е. минимальная концентрация антибиотика, задерживающая рост микроба-возбудителя в стандартном опыте. Величину МИК определяют методом серийных разведений или методом диффузии в агар (дисками). В первом случае МИК определяют по минимальной концентрации антибиотика, задерживающей видимый рост микроба в пробирках или чашках с питательной средой, содержащих возрастающие концентрации антибиотика. Во втором случае чистую культуру возбудителя засевают газоном на питательный агар в чашке, укладывают на неё бумажные диски, пропитанные антибиотиками, которые диффундируют в агар, создавая градиент концентрации. После инкубирования в термостате измеряют диаметры зон задержки роста вокруг дисков и по специальным таблицам определяют степень чувствительности к тому или иному антибиотику. В любом случае критерием чувствительности является величина терапевтического индекса:
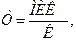 где К - концентрация данного антибиотика в очаге инфекции (или в крови) при введении терапевтических доз препарата (микроб чувствителен, а антибиотик обычно эффективен, если Т менее 0,3). Значения К можно найти в специальных таблицах.
где К - концентрация данного антибиотика в очаге инфекции (или в крови) при введении терапевтических доз препарата (микроб чувствителен, а антибиотик обычно эффективен, если Т менее 0,3). Значения К можно найти в специальных таблицах.
Выбор антибиотика для лечения зависит от чувствительности возбудителя, возможности достижения очага инфекции без снижения активности антибиотика и от его побочного действия.
МИКРОФЛОРА ТЕЛА ЧЕЛОВЕКА
Нормальная микрофлора тела человека - это эволюционно сложившаяся совокупность микробиоценозов всех биотопов тела человека (органов, полостей, участков). Ее количественный и качественный состав остается относительно постоянным в течение всей жизни, претерпевая незначительные изменения в зависимости от возраста, пола, питания, климата и физиологического состояния организма. Существенное влияние на состав микрофлоры оказывает: состояние защитных сил организма, взаимодействия внутри микробиоценозов, действие ряда факторов внешней и внутренней среды (антибиотиков, гормонов, токсических веществ и пр.)
Нередко сочетание неблагоприятных факторов приводит к развитию дисбактериоза (дисмикробиоза). Дисбактериоз - относительно стабильное количественное и качественное изменение состава микробиоценоза того или иного биотопа организма
Многие ткани и органы не сообщаются с внешней средой и в норме стерильны (кровь, лимфа, ликвор, печень, селезёнка, почки, мочевой пузырь, матка и плод, мозг). Наиболее обильна микрофлора толстого кишечника и ротовой полости, менее обильна - других отделов кишечного тракта, верхних дыхательных путей, кожи; скудную микрофлору имеют желудок и конъюктивальная полость. Практически отсутствует микрофлора в верхних отделах тонкого кишечника, трахее и бронхах, в уретре у женщин.
Основные функции нормальной микрофлоры:
- защитная (конкурентные отношения индигенной и случайной микрофлоры, в том числе патогенной);
- иммунологическая (способствует формированию и поддержанию иммунитета)
- ферментативная (способствует пищеварению, расщепляя целлюлозу и другие сложные органические соединения, усиливая перистальтику кишечника);
- витаминообразующая (например, эшерихии, бифидобактерии и другие представители индигенной микрофлоры синтезируют ряд витаминов, используемых организмом).
Различают микрофлору индигенную (постоянную, аутохтонную) и транзиторную (случайную, факультативную, аллохтонную). При ослаблении защитных сил организма представители нормальной микрофлоры (особенно факультативной) могут вызвать эндогенную инфекцию, которая в случае глубокого иммунодефицита может иметь детальный исход.
Микрофлора полости рта насчитывает более 160 видов и локализуется в слюне, зубных бляшках, десневых карманах, кариозных полостях, на спинке языка (в слюне - до 1 млрд. в 1 мл, в десневых карманах - в 100 раз больше). Обилие микрофлоры объясняется постоянным контактом с внешней средой, богатством питательных субстратов, влажностью, оптимальной температурой и рН. Это создает благоприятные условия для адгезии, колонизации и размножения микробов.
Бактерии ротовой полости - Гр- и Гр- аэробные и анаэробные кокки и палочки без спор, спирохеты, актиномицеты, микоплазмы. Большую часть Гр+ кокков составляют зеленящие стрептококки, Гр+ палочек - лактобактерии и актиномицеты коринеформные бактерии, Гр-палочек - строгие анаэробы - бактероиды, вейлонеллы, нитевидные лептотрихии и веретенообразные фузобактерии (из факультативных анаэробов - гемофилы). Спирохеты ротовой полости представлены непатогенными трепонемами,лептоспирами и боррелиями. Многие представители индигенной микрофлоры имеют морфологическое сходство с возбудителями заболеваний (сифилиса, дифтерии, менингококковой инфекции, пневмоний), что затрудняет их диагностику. Дисбактсриоз ротовой полости характеризуется повышением концентрации грибов Candida или повторным обнаружением энтеробактерий, псевдомонад, неферментирующих Гр-бактерий, а также клостридий и бацилл.
Микрофлора пищевода представлена немногочисленными транзиторными микробами, попадающими с пищей.
Микрофлора желудка скудна из-за антимикробного действия желудочного сока (его рН=1-2): преобладают аэробы - дрожжи, сардины, лактобактерии, энтерококки.
Микрофлора тонкого кишечника. Двенадцатиперстная кишка и верхние отделы тонкого кишечника практически стерильны из-за бактерицидного действия желчи, желудочного сока, секретов поджелудочной железы. В нижних отделах в небольшом количестве содержатся: лактобактерии, энтерококки, дрожжи, эшерихии.
Микрофлора толстого кишечника наиболее многочисленна и разнообразна, она составляет около 2,0 кг массы (в 1 г - до 40 млрд. микробов, относящихся к 450 видам). Соотношение анаэробов и аэробов - 10:1. Среди анаэробов преобладают бифидобактерии и бактероиды. Многочисленны также лактобактерии, энтерококки и эшерихии. В небольших количествах встречаются кокки, клостридии, другие энтеробактерии, грибы Candida.
Микрофлора конъюнктивы скудна из-за действия лизоцима и недостатка питательных веществ (стафилококки, дифтероиды, микоплазмы).
Микрофлора носа представлена немногочисленными стафилококками и дифтероидами; в носоглотке, кроме того, обнаруживаются стрептококки.
Микрофлора мочеполовых путей. В уретре мужчин обнаруживаются сапрофитные стафилококки и микобактерии, микоплазмы. Микрофлора влагалища представлена, в основном, лактобактериями, встречаются также стафилококки и дифтероиды.
Микрофлора кожи отличается стабильным составом, ее численность - 1 млн/кв. см. Облигатная микрофлора представлена стафилококками, дифтероидами и дрожжеподобными грибами. К факультативным видам относят стрептококки, энтеробактерии и другие Гр- бактерии. Наибольшее значение для здоровья человека имеет микрофлора кишечника, состояние которой можно считать индикатором благополучия организма. Дисбактериоз кишечника часто развивается в результате применения антибиотиков, цитостатиков, лучевой терапии, при различных соматических, эндокринных заболеваниях, при употреблении алкоголя, нарушении питания. В свою очередь, дисбактериоз является одной из причин аллергии, нарушения солевого и витаминного баланса, развития ряда заболеваний.
Дисбактериоз кишечника может характеризоваться: значительным снижением количества представителей постоянной микрофлоры (бифидобактерии, лактобактерии, эшерихии), повышением количества потенциально-патогенных представителей случайной микрофлоры (стафилококков, протеев, грибов Candida и др.). Микробиологическая диагностика дисбактериоза основана на изучении количественного и качественного состава микрофлоры. Для этого фекалии мерно засевают на ряд питательных сред и подсчитывают выросшие колонии, определяя, таким образом, количество основных представителей индигенной микрофлоры, % или абсолютное количество потенциально-патогенных микробов.
Для устранения дисбактериоза кишечника применяют препараты, состоящие из живых представителей нормальной микрофлоры, антагонистически активных штаммов (они заселяют кишечник и вытесняют из него потенциально-патогенные и патогенные микробы). Например, "Колибак-терин" содержит E.coli, "Бифидумбактерин" - Bifidobacterium bifidum, "Лактобактерии" - Lactobacillus аcidophilus.Для устранения потенциально-патогенной микрофлоры используют также и другие биологические препараты (например, "Коли-протейный бактериофаг", содержащий вирулентные бактериофаги, способные лизировать клетки протеев и патогенных вариантов эшерихий).