КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Вещества: простые и сложные (соединения).
Простые: металлы, неметаллы, амфотерные элементы;
Металлы: типичные, переходные, лантаноиды, актиноиды.
Типичные: главная|головная| подгруппа 1, II групп – s - металлы, кроме Ве.
Переходные: побочные подгруппы всех групп ( d – металлы).
Лантаноиды и актиноиды – нижняя часть периодической|периодичной| системы (f – металлы).
Неметаллы : Н, B, C, Si, главная подгруппа 5, 6, 7, 8 групп, кроме Ро.
Амфотерные: Be, A1, Ga, In, Ge, Sn, Pb, Sb, Zn.
Сложные: неорганические и органические.
Неорганические: оксиды|оксид|, гидроксиды|, соли – классы;
Оксиды– cолеобразующие: основные, кислотные, амфотерные; несолеобразующие (NO, N2O, CO, SiO) – виды.
Гидроксиды– основания, кислоты, амфотерные гидроксиды
Соли– основные, кислые, средние, двойные, комплексные.
ОКСИДЫ|оксид|
1. Определение: оксиды– это вещества, которые состоят из двух элементов, один из которых кислород в степени окисления (-2).
2. Состав: Е +n2 O-2n
3. Номенклатура: К2О - оксид калия
СО2 - оксид карбона (4)
4. Графическая формула: К – О – К ; О = С = О .
5. Типы связей: С – О – ковалентная| полярная, К – О – преимущественно ионная.
немет| немет| мет| немет|
6. Физические свойства в зависимости от типа связи.
7. Химические свойства.
Вещества, которые|какие| отличаются|разнятсядруг от друга по друг от друга по свойствам, реагируют тем активнее, чем больше разница|разность| в свойствах.
Вещества, близкие по свойствам друг с другом | практически|практично| не реагируют.
План
1. Отношение к|до| воде.
2. Взаимодействие с оксидами|оксидом|.
3. Взаимодействие с |с| гидроксидами|.
4. Взаимодействие с солями.
5. Взаимодействие с металлами.
6. Термическое разложение|расклад| ( термолиз).
ОСНОВНЫЕ ОКСИДЫ -
это оксиды|оксид|, образованные типичными|типовыми| металлами, или переходными металлами, в степенях| окисления +1, +2.
1. С водой реагируют только оксиды|оксид| типичных|типовых| металлов.
Ме2Оn + H2O à 2Me(OH)n
прямая гидратация|
Ме – подгруппы лития и магния. Все другие основные оксиды|оксид| с водой не реагируют.
2. С оксидами|оксидом|:
а) кислотными K2O + SiO2 à K2SiO3
основный кислотный
б) амфотерними MnO + A12O3 à Mn(A1O2)2
основный амфотерный|
3. С|с| гидроксидами|:
а) кислотами MgO + H2SO4 à MgSO4 + H2O
б) амфотерными 3Rb2O + 2Cr(OH)3 à 2Rb3CrO3 + 3H2O
4. С солями не реагируют.
5. С металлами высшей химической активности FеO| + Ca| → CаO| + Fe|
6. Термолиз не происходит.
КИСЛОТНЫЕ ОКСИДЫ -
это оксиды|оксид|, образованные неметаллами во всех степенях| окисления ( кроме +2 ), или переходными металлами в степенях| окисления +5, +6, +7, +8.
1. С водой реагируют все кроме: SiO2, WO3, Ta2O5, Nb2O5
SO3 + H2O à H2SO4
2. С оксидами: а) основными SiO2 + CaO à CaSiO3
кислотный основный
б) амфотерными N2O5 + ZnO à Zn(NO3)2
кислотный амфотерный|
3. С гидроксидами : а) основаниями SiO2 + 2 NaOH à Na2SiO3 + H2O
б) амфотерными SO2 + Zn(OH)2 à ZnSO3 + H2O
4. С солями не реагируют.
5. С металлами не реагируют.
6. Термическому разложению |раскладу| не подвергаются.
АМФОТЕРНЫЕ ОКСИДЫ–
это оксиды|оксид|, образованные амфотерными| элементами в любой степени |какому|| окисления, а также переходными металлами в степенях| окисления +3, +4.
1. С водой не реагируют и не растворяются.
2. С оксидами: а) основными A12O3 + MgO à Mg(A1O2)2
амфотерный| основный
б) кислотными Cr2O3 + N2O5 à 2Cr(NO3)3
амфотерный| кислотный
в) амфотерними A12O3 + ZnO à Zn(A1O2)2
амфотерный| амфотерный|
BeO + TiO2 à BeTiO3
3. С гидроксидами: а) основаниями Cr2O3 + 2NaOH à 2NaCrO2 + H2O
ZnO + 2NaOH + H2O à Na2 [Zn(OH)4]
б) кислотами In2O3 + 6HC1 à 2InC13 + 3H2O
в) амфотерными 2ZnO + Pb(OH)4 à Zn2PbO4 + 2H2O
4. С солями не реагируют.
5. С металлами – восстанавливаются|восстанавливают| более активными металлами
Fe2O3 + 3Ca à 3CaO + 2Fe
6. Термолизу не подлежат.
8. Способы получения оксидов|оксида|:
а) окисление простых веществ 2Mg + O2 à 2MgO
4P + 5O2 à 2P2O5
сложных веществ 2H2S + 3O2 à 2H2O + 2SO2
б) разложение солей (кроме солей щелочных металлов) CuSO4 à CuO + SO3
гидроксидов Са(ОН)2 à СаО + Н2О
2HNO3 à N2O5 + H2O
H2SO3 à SO2 + H2O
ГИДРОКСИДЫ
Гидроксиды:основания, кислоты, амфотерные гидроксиды.
Гидроксиды– это оксиды, которые вмещают воду.
ОСНОВАНИЯ|основание|
1.Основания– продукты прямой или непрямой гидратации основных оксидов.
2. Ме(ОН)n ( n = 1;2) Основания, в которых n = 1 называются однокислотными, при n = 2 - двухкислотными.
3. КОН – гидроксид калия; Ва(ОН)2 – гидроксид бария; Fe(ОН)2 – гидроксид железа (2).
4. Графическая формула К – О - Н
5. Типы связи: К – О – преимущественно ионная, О – Н –ковалентная| полярная.
6. Агрегатное состояние|стан|: твердые кристаллические, имеют высокие температуры плавления и кипения –гидроксиды| металлов 1 группы главной|головной| подгруппы; твердые аморфные – разлагаются|разлагают| при температуре . Хрупкие, нелетучие, не имеют запаха. Гидроксиды, образованные d – металлами могут быть окрашены. Теплопроводность средняя. Электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) в водных растворах диссоциируют с отщеплением ОН- :
гидроксиды металлов 1, II групп главных подгрупп диссоциируют по типу сильных оснований . Такие основания растворимые в воде, сильные электролиты – щелочи. Ме(ОН)n à Me+n + nOH-
все другие малорастворимые основания диссоциируют |основа| по типу слабых оснований|основания| :
Me(ОН)2 → MeOH+ + OH- 1 ступень
MeOH+ → Me2+ + OH- 2 ступень
Взаимодействие с|с| :
б) с оксидами : кислотными 2КОН + SiO2 à K2SiO3 + H2O амфотерными Sr(OH)2 + A12O3 à Sr(A1O2)2 + H2O
в) с гидроксидами: кислотами Mg(OH)2 + H2SO4 à MgSO4 + 2H2O
амфотерными| гидроксидами|
Cr(OH)2 + Pb(OH)2 à CrPbO2 + 2H2O
г) с солями реагируют в растворах только щелочи
2NaOH + CuSO4 à Cu(OH)2 + Na2SO4
д) с амфотерными| металлами реагируют только щелочи
2NaOH + Zn + 2H2O à Na2[Zn(OH)4] + H2
е) термолизу подлежат только аморфные основания|основание|
Ca(OH)2 à CaO + H2O
8. Получение:
а) прямая гидратация| металлов ( подгруппы Li|, Ca| )
Me + H2O à Me(ОН)n + H2
б) прямая гидратация| оксидов|оксида| металлов подгруппы Li|, Ca|
K2O + H2O à 2KOH
в) непрямая гидратация| в следствие ионного обмена
FeC12 + 2NaOH à Fe(ОН)2 + 2NaC1
КИСЛОТЫ
1. Кислоты –это продукты прямой или непрямой гидратации кислотных оксидов.
2. Бывают бескислородные (НС1 – хлороводородная кислота ) и кислородсодержащие (Н3РО4 – фосфорная кислота ).
Бескислородные – это продукт растворения в воде газообразных веществ типа: HCl, HBr, HI. H2S, H2Se..
Кислоты, которые имеют в составе|складе| один атом гидрогена| называются одноосновными, два или больше – двухосновными и больше.
3. Номенклатура:
а) кислородсодержащие | кислоты – латинское название кислотообразующего элемента с добавлением|додает| суффикса - ат-|, если элемент имеет максимальную степень окисления, или –ит| -, если элемент имеет промежуточную степень окисления и последующего добавления|додает| окончания – ная и слова кислота.
H2S+4 O3 - сульфитная кислота; H2S+6O4 - сульфатная кислота.
б) бескислородные кислоты – латинское название неметалла, суффикс –ид| -, окончание –ная|, и слово кислота.
H2S - сульфидная кислота; HBr – бромидна кислота.
- Графическая формула Н – С1
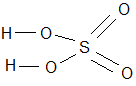
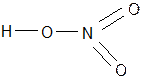
5. Типы связи: Н – С1 - ковалентная| полярная, Н – О – ковалентная| полярная
Р – О – ковалентная| полярная.
6. Агрегатное состояние: жидкие, твердые( H3PO3,H3PO4, H2WO4, HNbO3, HTaO3 , Н3ВО3 );; гелеобразная – H2SіO3, некоторые существуют только в растворах (H2SO3, H2CO3)
средние температуры плавления и кипения, не имеют| запаха и цвета, теплопроводность средняя, электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) растворы кислот диссоциируют с отщеплением Н+ . HNO3 → H+ + NO3-
Взаимодействие:
б) с оксидами: основными MgO + H2SO4 à MgSO4 + H2O
амфотерными In2O3 + 6HC1 à 2InC13 + 3H2O
в) с гидроксидами: основаниями Mg(OH)2 + H2SO4 à MgSO4 + 2H2O
амфотерными 3H2SO4 + 2Fe(OH)3 à Fe2(SO4)3 + 6H2O
гидроксидами
г) с солями: в растворах при условиях образования труднорастворимых | солей или летучих веществ
H2SO4 + BaC12 àBaSO4 ↓ + 2HC1
д) с металлами, которые|какие| стоят в ряду напряжения до водорода||д|
Zn + 2HC1 à ZnC12 + H2
е) при нагревании кислородсодержащие | кислоты разлагаются|разлагают|
H2SiO3 à H2O + SiO2
7. Способы получения:
а) прямая гидратация| соответствующих оксидов|оксида|, или газов типа HCl|, HBr|;
SO3 + H2O à H2SO4
б) непрямая гидратация| в результате|вследствие| ионного обмена:
Na2WO4 + 2HCl → 2NaCl + H2WO4↓
в) общий способ – реакция обмена между солью и менее| летучей кислотой :
NaC1 + H2SO4 à HC1 ↑+Na2SO4
АМФОТЕРНЫЕ ГИДРОКСИДЫ
1.Амфотерные гидроксиды- продукт исключительно непрямой гидратации в результате ионного обмена.
2. Ме(ОН)n n= 2,3,4
3. Ве(ОН)2 – гидроксид берилия, Fe(ОН)3 – гидроксид железа (3)
4. Графическая формула: Н – О – Ве – О – Н
5. Типы связи: Ве – О – преимущественно ионная, О – Н – ковалентная| полярная.
металл неметалл неметалл неметалл
6. Агрегатное состояние|стан|: твердые, аморфные, хрупкие, неустойчивые к|до| повышению температур, теплопроводность средняя, электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) отношение к|до| воде: слабо растворимые
Взаимодействие:
б) с оксидами: основными MnO + A1(OН)3 à Mn(A1O2)2 + Н2О
основный амфотерный
кислотными SO2 + Zn(OH)2 à ZnSO3 + H2O
кислотный амфотерный
амфотерными SnO2 + Pb(OH)2 → PbSnO3 + H2O
амфотерный амфотерный
в) з гидроксидами: щелочами 3NaOH + A1(OH)3 à Na 3 A1O3 + 6H2O
кислотами 3H2SO4 + 2Fe(OH)3 à Fe2(SO4)3 + 6H2O
амфотерными Be(OH)2 + Ge(OH)4 → BeGeO3 + 3H2O
амфотерный| амфотерный|
г) с солями не реагируют
д) с металлами не реагируют
е) при нагревании раскладываются на оксид и воду: 2Fe(OH)3 → Fe2O3 + 3H2O
8. Способы получения:
непрямая гидратация| в результате|вследствие| ионного обмена:
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
СОЛИ
Соли: средние, основные, кислые.
СРЕДНИЕ СОЛИ
1. Средние соли –продукт полного замещения катионов водорода катионами металлов в кислотах, или продукт полного замещения гидроксогрупп основания кислотными остатками.
Fe(OH)2 + 3HCl → FeCl3 + 3H2O
средняя соль
H3PO4 + 3NaOH → Na3PO4 + 3H2O
средняя соль
3. Номенклатура: называют кислотный остаток соответствующей кислоты ( смотри Номенклатуру кислот ), латинское название металла в родительном падеже и степень его окисления (кроме металлов главной|головной| подгруппы I и II групп).
III V II
4. Графические формулы: Al+3 (N+5 O-2 3)3 Al (N O3)3

5. Химические связи: Al| - O - преимущественно ионная
металл неметалл
O – N - ковалентная| полярная
неметалл неметалл
6. Физические свойства:
Агрегатное состояние|стан|: твердые, кристаллические, хрупкие, высокие температуры кипения и плавления ( кроме нитратов и карбонатов), не имеют запаха, соединения, которые|какие| содержат d – элементы могут иметь цвет. Теплопроводность средняя. Электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) Отношение к|до| воде : растворимые в воде соли ( см. Таблицу растворимости) диссоциируют | по типу сильных электролитов.
Na2SO4 → 2Na+ + SO42-
б) Взаимодействие с |гидроксидами| в растворах:
а) основаниями MgSO4 + 2NaOH à Mg(OH)2 ↓ + Na2SO4
б) кислотами Na2CO3 + 2HC1 à 2NaC1 + H2O + CO2
в) Взаимодействие с солями: в растворах при условиях образования труднорастворимых | соединений
BaC12 + Na2SO4 à BaSO4 + 2NaC1
г) Взаимодействие с металлами: в растворах реагируют с металлами, которые|какие| предшествуют в ряде|в ряду| напряжения | металлу, что входит в состав соли
Fe + CuSO4 à FeSO4 + Cu
д) Термолиз : подлежат соли летучих кислот
CaCO3 à CаO + CO2
Pb(NO3)2 à 2PbO + 4 NO2 + O2
8. Получение:
а) Взаимодействие металлов с неметаллами:
2Na + S → Na2S
б) Взаимодействие окислов|оксида|:
CaO + CO2 à CaCO3
в) Взаимодействие гидроксидов|:
3NaOH + H3PO4 → Na3PO4 + 3H2O
основание|основание| кислота соль
Fe(OH)3 + 3 HNO3 → Fe(NO3)3 + 3H2O
амфот. кислота соль
KOH + Zn(OH)2 → K2ZnO2 + H2O
основание|основание|ние амфот|. соль
г) Взаимодействие солей :
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
д) Взаимодействие солей с металлами:
FeSO4 + Mg > MgSO4 + Fe
Дополнительную информацию относительно|касательно| разнообразных|многообразных| способов получения солей можно найти в учебниках.
ОСНОВНЫЕ СОЛИ
1.Основные соли– это продукт неполного замещения гидроксогрупп многокислотных оснований кислотными остатками.
Fe(OH)3 + HNO3 → Fe(OH)2NO3 + H2O
основная соль
Fe(OH)3 +2 HNO3 → FeOH(NO3)2 +2 H2O
основная соль
3. Номенклатура: называют кислотный остаток, за ним справа налево читают основной остаток и называют степень окисления металла.
Fe(OH)2NO3 - нитрат дигидроксоферума (III)
FeOH(NO3)2 - нитрат гидроксоферума (III)
III II I V II
4. Графические формулы: Fe+3 (O-2 H+ )2N+5 O3-2 ; Fe (O H)2 N O3

5. Химические зв|язи|:
Fe| – O - преимущественно ионная
мет| немет|
O – H - ковалентная| полярная
немет| немет|
O – N - ковалентная| полярная
немет| немет
|
6. Физические свойства:
Агрегатное состояние|стан|: твердые, кристаллические, хрупкие, высокие температуры кипения и плавления. Теплопроводность средняя. Электропроводимость|электропроводность| отсутствует. Плотность|густота| большая|великая|.
Под действием воды диссоциируют| с образованием катионов основных остатков и анионов кислотных остатков.
H2O
Cr (OH)2Cl → Cr(OH)2+ + Cl-
основной кислотный
остаток остаток
КИСЛЫЕ СОЛИ
1.Кислые соли -это продукт неполного замещения катионов Гидрогена в молекулах многоосновных кислот катионами металла.
H3PO4 + LiOH → LiH2PO4 + H2O
кислая соль
H3PO4 + LiOH → Li2HPO4 + 2 H2O
кислая соль
3. Номенклатура: называют килотний| остаток и металл, в родительном падеже.
LiH2PO4 - дигидрофосфат лития
Li2HPO4 - гидрофосфат лития
I I V II
4. Графические формулы: : Li+ H2+ P+5 O4-2 ; Li H2 P O4

5. Химические зв|язи|:
Li| – O - преимущественно ионная
мет| немет|
H – O - ковалентная| полярная
немет| немет|
P – O - ковалентная| полярная
немет| немет|
6. Физические свойства:
Агрегатное состояние|стан|: твердые, кристаллические, хрупкие, высокие температуры кипения и плавления ( кроме гидрокарбонатов). Теплопроводность средняя. Электропроводимость|электропроводность| отсутствует. Под действием воды диссоциируют| с образованием катионов металлов и анионов кислых кислотных остатков.
H2O
Ca(HCO3)2 → Ca2+ + 2HCO32-