Предельные углеводороды, их химические свойства.
Типы химических связей в органических соединениях
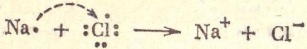
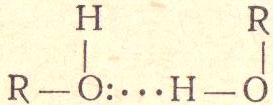 1)Ионная связь : прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF. П-ер :
1)Ионная связь : прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF. П-ер :
 2)А. Ковалентная связь -образована общей для двух атомом парой электронов.Делится на неполяную –образована атома ми с одинако вой электроотрицаемостью. Полярную - образо вана атомами с различной эле ктроотрицаемостью
2)А. Ковалентная связь -образована общей для двух атомом парой электронов.Делится на неполяную –образована атома ми с одинако вой электроотрицаемостью. Полярную - образо вана атомами с различной эле ктроотрицаемостью
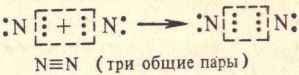
Б. Ковалентная : химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой. Наиболее распространена в органической химии. Обладает высокой прочностью. П-ер :

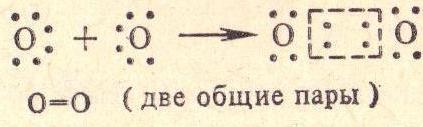
 3)Донорно – акцепторная связь : химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). П-ер :
3)Донорно – акцепторная связь : химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). П-ер :
 4)Водородная : форма объединения между электроотриц ательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F, реже Cl,Br,S. Водородные связи могут быть межмолекулярными или внутримолекулярными. П-ер :
4)Водородная : форма объединения между электроотриц ательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F, реже Cl,Br,S. Водородные связи могут быть межмолекулярными или внутримолекулярными. П-ер :
Характеристика соединений с поляризованной связью.
Это молекулы включающие ковалентные полярные связи .Хар-ся наличием полюсов (наз-ся ди полями. Чем выше разность электроотрицательных атомов тем более рекационно способна молекула.
Виды изомерии в органических соединениях
Изомерия-явление сущ-ия Изомеров.Изомер-вещ-ва имеющие одинаковый сост-в атомов, но различное в строе ние.
А)Структурная изомер-я 1)Изомерия углеродного скелета.
Различая во взаимном расположении атомов С.
2)Изомерия по положению кратной связи
(двойной).
3)Из положения функциональной группы Различия положения функциональной группы относительно углеродного скеле та.
В)Пространственная изомер-я
Связана с различным положе нием атомов или групп атомов относительно двойной связи.
Предельные углеводороды, их химические свойства.
Алканы (парафины) - это насы щенные (предельные) углево дороды с открытой цепью. Они имеют общую формулу СnН2n+2, В алканах атомы углерода связаны между собой только простыми (одинарными) связями, а остальные валент ности углероданасыщены ато мами водорода. Характерный суффикс для насыщенных углеводородов-ан.,
СН4 - метан; С2Н6 - этан; С3Н8 - пропан
С4Н10 - бутан (2 изомера)
СН3-СН2-СН2-СН3 - н-бутан изобутан (2-метилпропан)
С5Н12 - пентан (3 изомера)
С6Н14 - гексан , С7Н16 - гептан
С8Н18 - октан С9Н20 - нонан С10Н22 – декан
Химические св-ва:
1)Замещение: CH4+Cl2→CH3Cl+HCl (хлористый метил)
CH3Cl+HCl→CH2Cl2+HCl (хлористый метилен) CH2Cl2+Cl2→CHCl3+HCl (хлороформ)
2)При воздействие света наCl образуется радикал Cl·
CH4+Cl·→CH3·+HCl CH3·+Cl2→CH3Cl+Cl·
3) Нитрование: характерно для имеющим вторичный или третичный атом углерода. 


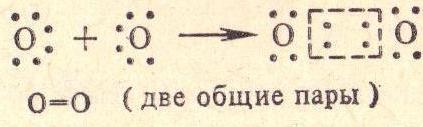

Р-я КОНОВАЛОВА
4)При температуре 100-500ºС и доступе кислорода образуются жирные кислоты, а при температуре 500-600ºС наблюдается крекинговый процесс
- р-я горения CH4+2O2
→CO2+H20
-Каталитическое окисление
2СН3-СН2-СН2-СН3 + 5О2 →4СН3СООН (уксусная кислота),
Получение алканов.
Получение метана
в промышленности:
1. Фракционированием природного газа и перегонкой нефти.
2. Синтез из элементов при высокой температуре (вольтова дуга),
C + 2H2 →CH4
Химические способы получения: 1)Из солей органических кислот. Cплавление ацета та натрия со щелочью: СН3СOONa + NaOH →CH4 + Na2CO3
2)Синтез Вюрца: CH3-CHI+Na+ICH3→2NaI+CH3-CH2-CH3
3)Из магний органических соединений: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4)Синтез Бертло: C2H5I+HI→C2H6+I2
5)Из алкенов 
6) Восстановление галогенпроизводных алканов.
CH3-CH2I + H2 →CH3-CH3 + HI