Загальні відомості про будову речовини
ДЕРЖАВНИЙ УНІВЕРСИТЕТ ТЕЛЕКОМУНІКАЦІЙ
 |
ЛЬВІВСЬКИЙ КОЛЕДЖ ДЕРЖАВНОГО УНІВЕРСИТЕТУ ІНФОРМАЦІЙНО-КОМУНІКАЦІЙНИХ ТЕХНОЛОГІЙ
| Розглянуто та схвалено на засіданні циклової комісії ________________________________ Протокол №__ від ___ _______ 2010 р. Голова циклової комісії ______ _____________ | Затверджую Заступник директора з НВР ______________ Плешівський Я.М. «____» _____________ 2010 р. |

КОНСПЕКТ ЛЕКЦІЙ
«Електроматеріали»
Склав викладач:
К.ф.-м.н. Трач І.Б.
м. Львів 2015р.
До основних понять, термінів, визначень хімії належать:
1. Атом – це складна мікроструктура, що складається з позитивно зарядженого ядра і негативно заряджених електронів, які перебувають у постійному русі і їх рух описується законами квантової механіки.
В ядрі атомів містяться частинки, які називаються нуклонами і які перебувають в двох станах – протона і нейтрона. Зважаючи на це, в хімію введенні поняття нуклонне і протонне число.
2. Нуклонне число – це загальне число нуклонів в ядрі атома, тобто сума протонів (Z) і нейтронів (N). Нуклонне число позначають арабськими числами зверху ліворуч від символу елемента, наприклад 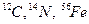
3. Протонне число – це кількість протонів в ядрі атома. Позначають протонне число арабськими числами знизу ліворуч від символу елемента, наприклад : 
4. Хімічний елемент – це тип атомів із строго певним протонним числом. Хімічні елементи позначають відповідними символами, які є міжнародними.
Атоми деяких елементів можуть містити в ядрі різну кількість нейтронів за однієї і тієї самої кількості протонів. У зв’язку з цим введено поняття: ізотопи.
5. Ізотопи – це атоми хімічного елемента, що відрізняються між собою числом нейтронів в ядрі, а відтак і нуклонним числом. Наприклад:  - Протій,
- Протій,  - Дейтерій,
- Дейтерій,  - Тритій. В ядрі Протію нейтронів немає; в ядрі Дейтерію – 1; в ядрі Тритію – 2 нейтрони. Для кальцію відомі три ізотопи:
- Тритій. В ядрі Протію нейтронів немає; в ядрі Дейтерію – 1; в ядрі Тритію – 2 нейтрони. Для кальцію відомі три ізотопи:  ,
,  ,
,  .
.
Хімічні властивості елементів визначаються, в основному, протонним числом, тому хімічні властивості ізотопів незначно відрізняються між собою.
6. Молекула – це найменша частинка речовини, яка є носієм основних її властивостей. Отже, молекула – складова частина всіх речовин навколишнього світу. Залежно від типу атомів, які, сполучаючись, утворюють молекули, розрізняють речовини: прості і складні.
7. Проста речовина – це така, молекули якої утворені атомами одного елемента. Назву простої речовини записують з малої букви, наприклад натрій (Na), калій (К), хлор (Сl2)
8. Складна речовина – це така, молекули якої утворені атомами різних елементів. Назву складної речовини також записують з малої букви, наприклад: вода (Н2О), сульфатна кислота (H2SO4).
Деякі хімічні елементи можуть сполучатись між собою, утворювати декілька простих речовин. У зв’язку з чим у хімію введено поняття: алотропія та алотропи.
9. Алотропія – це властивість хімічних елементів утворювати декілька простих речовин, які відрізняються кількістю атомів у молекулі, а утворені прості речовини називаються алотропами. Наприклад: O2, O3; S8, S6, S4, S2.
Алотропи, маючи різну кількість атомів у молекулі, відрізняються між собою будовою молекули, а значить, і властивостями.
Під час хімічних реакцій відбуваються складні, різнопланові процеси, які, з метою спрощення, можна звести до приймання і віддачі електронів. У зв’язку з цим введено поняття: іон.
10. Іон – електронодефіцитний або електрононадлишковий атом або група атомів. Отже, іон – це заряджена частинка. Якщо атом або група атомів віддає електрони, то іон має заряд (+), якщо приймає – (-). Заряд іона позначають зверху праворуч від його символу арабськими числами із знаком (+) або (-) після числа, наприклад: 
Заряд 1 прийнято не писати, а лише його знак (+) або (-)
Атоми елементів мають певну масу, яка дуже мала, виражається у межах 1,67*10-27-3,4*10-25кг. Оперувати такими надзвичайно малими числами незручно. Тому замість абсолютної маси атомів прийнято користуватись відносними величинами. За відносну одиницю маси атомів прийнята атомарна одиниця маси (а.о.м.)
11. Атомарна одиниця маси – це 1/12 частина маси ізотопу атома елемента Вуглецю  . Абсолютна маса атома ізотопу Вуглецю
. Абсолютна маса атома ізотопу Вуглецю  становить 1,9926786*10-26 кг. Тобто абсолютна маса а.о.м. становитиме 1,9926786:12=1,6605655*10-27 кг. Цю масу прийняли за одиницю, еталон, з яким порівнюють маси атомів всіх інших елементів. Маючи одиницю відліку, можна визначити атомні і молекулярні маси всіх елементів.
становить 1,9926786*10-26 кг. Тобто абсолютна маса а.о.м. становитиме 1,9926786:12=1,6605655*10-27 кг. Цю масу прийняли за одиницю, еталон, з яким порівнюють маси атомів всіх інших елементів. Маючи одиницю відліку, можна визначити атомні і молекулярні маси всіх елементів.
12. Атомна маса елемента – це маса атома елемента, виражена в а.о.м. Так, атомна маса атома Кисню 15,9994. це означає, що атом елемента Кисню важчий від 1/12 маси атома Вуглецю  в 15,9994 раза.
в 15,9994 раза.
13. Молекулярна маса речовини – це маса молекули цієї речовини, виражена в а.о.м., дорівнює сумі атомних мас елементів, що входять до складу молекули. Відтак молекулярна маса речовини є також величиною відносною, безрозмірною. Так, молекулярна маса води дорівнює 15,99994+2*1,0079=31,0148
Наступною, дуже важливою одиницею, яку широко використовують в хімічних розрахунках, є моль.
14. Моль – це одиниця кількості речовини, являє собою таку кількість цієї речовини, яка містить стільки структурних одиниць (молекул, атомів, іонів, електронів), скільки атомів міститься в 12 г ізотопу Вуглецю 
Видатний італійський фізик і хімік Авогадро експериментально визначив, що 2 г ізотопу Вуглецю  містить 6,023*1023 атомів. Отже, моль молекул містить 6,023*1023 молекул, моль атомів – 6,023*1023 атомів, моль електронів – 6,023*1023електронів. Число 6,023*1023 називають числом Авогадро.
містить 6,023*1023 атомів. Отже, моль молекул містить 6,023*1023 молекул, моль атомів – 6,023*1023 атомів, моль електронів – 6,023*1023електронів. Число 6,023*1023 називають числом Авогадро.
Для практичних розрахунків необхідно знати, яку масу має моль молекул, атомів. Тому введене поняття мольна (молярна) маса.
15. Мольна (молярна) маса – це маса одного моля, виражена в масових одиницях. Позначають буквою М,виражають у г/моль, кг/моль. Наприклад: МО=15,9994 г/моль, МО2=31,9988 г/моль, МН=1,0079 г/моль, МН2= 2,0158 г/моль.
Речовини реагують між собою не довільно, а в строго певних (еквівалентних) відношеннях. У зв’язку з цим у хімію введенні поняття: хімічний еквівалент елемента і речовини. За еталон прийнято 1 моль атомів Водню.
16. Хімічний еквівалент елемента – це така його кількість, яка реагує (взаємодіє) з 1 молем атомів елемента Водню або заміщає 1 моль його атомів у хімічній реакції. Розмірність – частики моля елемента.
Приклади
1. 2Н2+О2=2Н2О
2. Н2+О2=Н2О2
3. Zn+2HCl=ZnCl2+H2
У першій реакції хімічний еквівалент елемента Кисню дорівнює 0,5 моля елемента Кисню, у другій – 1,0 моль елемента Кисню. Хімічний еквівалент елемента Цинку дорівнює 0,5 моля елемента Цинку.
17. Хімічний еквівалент речовини – це така її кількість, яка взаємодіє в хімічній реакції з одним молем атомів елемента Водню або одним еквівалентом іншої речовини. Приклади:
1. H2+Cl2 =2HCl
2. NaOH+H2SO4=NaHSO4+H2O
3. 2NaOH+H2SO4=Na2SO4+2H2O
У реакції (1) хімічний еквівалент речовини хлору дорівнює 0,5 моля речовини хлору; в реакції (2) хімічний еквівалент речовини H2SO4 дорівнює 1,0 моль речовини H2SO4, в реакції (3) – 0,5 моля речовини H2SO4. отже розмірність хімічного еквівалента – частки моля. Таким чином поняття хімічний еквівалент елемента чи речовини прямо зв’язаний з реакцією, в якій бере участь цей елемент чи речовина. Тому говорити про хімічний еквівалент без вказівки, в якій реакції бере участь цей елемент чи речовина, не можна.
Хімічний еквівалент визначає мольні співвідношення між реагуючими речовинами. В інженерних розрахунках здебільшого оперують (користуються) масовими величинами. У зв’язку з тим введені поняття еквівалентна маса елемента і сполуки.
18. Еквівалентна маса елемента в речовині – це маса одного хімічного еквівалента елемента в речовині. Позначають Е, виражають в г/екв, кг/екв.
Еквівалентну масу елемента в речовині (Еел) визначають за формулою

Де М – мольна маса елемента, г\моль
В – ступінь окиснення елемента (без знака).
19. Еквівалентна маса речовини – це маса одного хімічного еквівалента сполуки. Визначають еквівалентну масу сполуки (Есп) за формулою

Де М – мольна маса елемента, г\моль
В, n – коефіцієнти, які залежать від природи речовини і реакції, в якій речовина бере участь.
Як відомо, є чотири класи неорганічних сполук: оксиди, гідроксиди, кислоти і солі. Отже, для кожного класу сполук значення величини В і n буде інше.
Загальні відомості про будову речовини
Види хімічного зв'язку
Хімічний зв'язок– це сукупність сил, що діють між атомами чи групою атомів. Внаслідок дії цих сил утворюються молекули. При обговоренні хімічного зв'язку зазвичай користуються терміном “валентність”. Дане поняття означає міру здатності елемента до утворення хімічного зв'язку. Хімічний зв'язок здійснюється в основному за рахунок так званих валентних електронів. Описати хімічний зв'язок – це означає з'ясувати, як розподіляється електронна щільність у молекулі.
Розглянемо основні види зв'язків, за рахунок яких відбувається об'єднання атомів у молекули.
Ковалентний зв'язокхарактеризується утворенням стійких електронних пар з електронів, які раніше належали до окремих атомів, котрі входять до складу молекул. Електрони, рухаючись молекулярними орбітами, найбільш часто розташовуються між ядрами, де створюється начебто надлишок негативного заряду, що сприяє зближенню атомів (рис. 1.1).
 Якщо двоатомна молекула складається з атомів одного елемента (H2, N2, Cl2), то електронна пара однаковою мірою належить до обох атомів. У подібному випадку молекулу та існуючий в ній ковалентний зв'язок називають неполярним чи нейтральним (рис. 1.1,а). У неполярних молекулах центри позитивних та негативних зарядів збігаються.
Якщо двоатомна молекула складається з атомів одного елемента (H2, N2, Cl2), то електронна пара однаковою мірою належить до обох атомів. У подібному випадку молекулу та існуючий в ній ковалентний зв'язок називають неполярним чи нейтральним (рис. 1.1,а). У неполярних молекулах центри позитивних та негативних зарядів збігаються.
Якщо ж двоатомна молекула складається з атомів різних елементів, то електронна пара може бути зміщена до одного з атомів. У таких випадках ковалентний зв'язок називають полярним, а молекули з полярним зв'язком, у яких центри позитивних і негативних зарядів не збігаються, - полярними чи дипольними (рис.1.1,б). Дипольна молекула характеризується величиною електричного дипольного момента m, вимірюваного в Кл×м
 m = ql, (1.1)
m = ql, (1.1)
де q - абсолютне значення заряду; l - відстань між центрами позитивного і негативного зарядів.
Багатоатомні молекули також можуть бути неполярними – при симетричному розташуванні зарядів або полярними – при асиметричному. Приклади нейтральних (неполярних) і дипольних (полярних) молекул наведені на рис. 1.2 (а, б) відповідно. Як приклад речовин з полярним ковалентним зв'язком, можна навести молекули типу H2O, H2S, N2O5 і всіх кислот.
Речовини, утворені молекулами з ковалентним зв'язком, характеризуються високою твердістю. Вони є тугоплавкі й хімічно інертні, що пояснюється міцністю ковалентного зв'язку і його спрямованістю.
 Донорно-акцепторнийзв'язок є різновидом ковалентного зв'язку. Виникає він між атомами елементів, один з яких є здатен віддати електрони (донор), а інший – здатен прийняти ці електрони (акцептор). Прикладом таких сполук можуть слугувати сполуки, утворені елементами третьої і п'ятої груп Періодичної системи Д. І. Менделєєва, наприклад арсенід галію GaAs.
Донорно-акцепторнийзв'язок є різновидом ковалентного зв'язку. Виникає він між атомами елементів, один з яких є здатен віддати електрони (донор), а інший – здатен прийняти ці електрони (акцептор). Прикладом таких сполук можуть слугувати сполуки, утворені елементами третьої і п'ятої груп Періодичної системи Д. І. Менделєєва, наприклад арсенід галію GaAs.
Іонний зв'язокспричинюється силами електростатичного притягання між позитивними і негативними іонами. Як приклади іонних сполук можна навести елементи, що дуже відрізняються за властивостями, наприклад типові метали і типові неметали. На рис. 1.3 показано іонний зв'язок на прикладі іонних кристалів хлористого цезію CsCl і титанату барію BaTiО3. Молекули речовини з іонним зв'язком є полярні.
До речовин з іонним зв'язком належать більшість солей і деякі оксиди (Cu2O, ZnО, CdО, Fe2O3, NiО і ін.). Іонні сполуки за механічною міцністю і хімічною стійкістю поступаються речовинам, утвореним за допомогою ковалентного зв'язку, тому що іонний зв’язок є менш міцний, ніж ковалентний.
 Металевий зв'язок. Для металів характерний є хімічний зв'язок, який ґрунтується на колективізації валентних електронів, що належать не двом, а практично всім атомам у кристалі. Атоми металів здатні віддавати зовнішні електрони, перетворюючись на позитивні іони, чи знову їх приєднувати, перетворюючись на нейтральні атоми. Таким чином, метал можна розглядати як систему, побудовану з позитивних іонів, що вони перебувають в середовищі вільних, колективізованих електронів (рис. 1.4, а).
Металевий зв'язок. Для металів характерний є хімічний зв'язок, який ґрунтується на колективізації валентних електронів, що належать не двом, а практично всім атомам у кристалі. Атоми металів здатні віддавати зовнішні електрони, перетворюючись на позитивні іони, чи знову їх приєднувати, перетворюючись на нейтральні атоми. Таким чином, метал можна розглядати як систему, побудовану з позитивних іонів, що вони перебувають в середовищі вільних, колективізованих електронів (рис. 1.4, а).
Отже, металевий зв'язок визначається водночас наявністю ковалентного зв'язку між нейтральними молекулами та електростатичним притяганням між іонами і вільними електронами, що в підсумку забезпечує монолітність і міцність металу. Завдяки наявності вільних електронів метали мають високу електро- і теплопровідність. Висока пластичність металів пояснюється відсутністю спрямова-ності металевого зв'язку.
Міжмолекулярний зв'язок, чи зв'язок Ван-дер-Ваальса, спостерігається у низці речовин між молекулами з ковалентним характером усередині молекулярної взаємодії. Наявність міжмолекулярного притягання в цьому разі є можлива при погодженому русі валентних електронів у сусідніх молекулах (рис. 1.4, б). Тоді сили притягання валентних електронів ядром сусідньої молекули стають сильніше за сили взаємного відштовхування електронних оболонок цих молекул. Речовини з молекулярним характером зв'язку мають низькі температури плавлення (наприклад, у парафіна tпл = 50 – 52 оС). Це свідчить про те, що зв'язок Ван-дер-Ваальса є дуже слабкий.