Для ответов на задания этой части используйте специальный бланк. Запишите сначала номер задания (С1 и т.д.), а затем запишите полный ответ.
Инструкция по выполнению работы
На выполнение экзаменационной работы по химии дается 3 часа (180 минут). Работа состоит из 3 частей, включающих 60 заданий.
Часть 1 включает 45 заданий. К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 10 заданий (В1–В10) для которых необходимо сформулировать краткий ответ (назвать вещество, тип реакции, окислитель или восстановитель, указать направление реакции и т.д.).
Часть 3 содержит 5 самых сложных заданий по общей, неорганической и органической химии. Задания C1 – C5 требуют полного (развернутого) ответа на отдельных листах. Все необходимые черновые записи вы можете делать также на этих листах. Ответы записывайте четко и разборчиво.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа, если они имеются. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
Выполняйте задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
Для получения отметки «3» достаточно выполнить верно любые 16 заданий из всей работы.
Для получения отметки «4» или «5» необходимо выполнять задания из частей 1, 2 и 3. При этом не требуется выполнить все задания работы, но для получения отметки «5» среди верно выполненных должно быть хотя бы одно задание из Части 3.
Приступайте к выполнению работы.
Желаем успеха!
Часть 1
При выполнении заданий этой части укажите в бланке ответов цифру, которая обозначает выбранный Вами ответ, поставив знак « х » в соответствующей клеточке бланка для каждого задания (А1-А45).
A1. Вещество SO3 –
1) кислотный оксид
2) основный оксид
3) амфотерный оксид
4) несолеобразующий оксид
A2. В каком ряду записаны формулы только тех веществ, которые взаимодействуют с соляной кислотой?
1) Na2CO3; Cu; Na2O; Zn(OH)2
2) CO2; Al(OH)3; Ba(OH)2; Fe
3) Zn; CaO; KOH; AgNO3
4) Pb(NO3)2; Ca(OH)2; SO3; HNO3
A3. Свойства веществ зависят не только от состава, но и от
1) условий получения вещества
2) порядка связи атомов в соединении
3) валентности химических элементов
4) агрегатного состояния вещества
A4. Вещество CH2—CH—CH2 относится к классу
| | |
OH OH OH
1) спиртов
2) многоатомных спиртов
3) альдегидов
4) карбоновых кислот
A5. В веществе CH3—CH2—OH связь между атомами углерода
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) водородная
A6. Степень окисления атома серы в веществе (NH4)2SO4 равна
1) –2
2) 0
3) +4
4) +6
A7. Какое из перечисленных веществ образует атомную кристаллическую решетку?
1) кислород
2) бром
3) азот
4) бор
A8. На скорость химической реакции не оказывает влияние
1) концентрация вещества в растворе или концентрация газа
2) площадь поверхности твердого вещества
3) условия хранения реактивов
4) температура проведения реакции
A9. Окислительно-восстановительной реакции соответствует уравнение
1) KOH + HCl = KCl + H2O
2) CH2=CH2 + HCl ® CH3—CH2Cl
3) CuO + 2HCl = CuCl2 + H2O
4) CH3—CH2OH + HCl ® CH3—CH2Cl + H2O
A10. В каком ряду знаки химических элементов расположены в порядке увеличения атомных радиусов?
1) C ® N ® O ® F
2) Sr ® Ca ® Mg ® Be
3) Na ® Al ® P ® Cl
4) Si ® Al ® Mg ® Na
A11. Термин «молекула» нельзяупотреблять при характеристике строения
1) сероводорода
2) азотной кислоты
3) озона
4) фторида кальция
A12. Простым веществом является
1) H2S
2) S8
3) SO2
4) H2SO4
A13. Вещество состава C4H10O имеет
1) 7 изомеров
2) 6 изомеров
3) 4 изомера
4) 2 изомера
A14. Если оксид растворяется в воде, то
1) это основный оксид
2) это кислотный оксид
3) это амфотерный оксид
4) на основании этих данных нельзя сделать вывод о кислотно-основных свойствах оксида
A15. В результате реакции пропена с водой образуется
1) пропаналь
2) пропанол-1
3) пропанол-2
4) ацетон
A16. Атом углерода карбоксильной группы находится в гибридном состоянии
1) sp
2) sp2
3) sp3
4) sp3d2
A17. Степень диссоциации не зависит от
1) объема раствора
2) природы электролита
3) растворителя
4) концентрации
A18. Веществом, вступившим в реакцию, сокращенное ионное уравнение которой
… + 2H+ = Cu2+ + 2H2O, является
1) нитрат меди(II)
2) карбонат меди(II)
3) гидроксид меди(II)
4) хлорид меди(II)
A19. В уравнении реакции горения ацетилена коэффициент перед формулой окислителя равен
1) 5
2) 2
3) 3
4) 4
A20. Молекулы какого из перечисленных веществ имеют наименьшую энергию связи?
1) HI
2) HCl
3) HF
4) HBr
A21. Электроны атома фосфора, находящегося в основном состоянии, расположены на орбиталях так:
1) 5s25p5
2) 3s23p5
3) 3s23p3
4) 5s25p3
A22. Различие в значении температур плавления CO2 (– 56,6оС) и SiO2 (1728оС) объясняется
1) различиями в строении атомов углерода и кремния
2) различием в значениях масс молекул
3) разным видом химической связи
4) разным типом кристаллической решетки
A23. Изомерами не являются
1) циклобутан и 2-метилпропан
2) пентен-1 и метилциклобутан
3) бутадиен-1,3 и бутин-1
4) гексан и 2,3-диметилбутан
A24. Сокращенное ионное уравнение реакции между водными растворами хлорида кальция и карбоната натрия
1) CaCl2 + 2Na+ = 2NaCl + Ca2+
2) Ca2+ + Na2CO3 = CaCO3¯ + 2Na+
3) Ca2+ + CO32– = CaCO3¯
4) Ca2+ + 2Cl– + 2Na+ + CO32– = 2NaCl + CaCO3
A25. Жиры состоят из фрагментов молекул
1) этиленгликоля и высших карбоновых кислот
2) глицерина и высших карбоновых кислот
3) глицерина и альдегидов
4) этиленгликоля и альдегидов
A26. Какой из перечисленных химических элементов образует только одно простое вещество?
1) водород
2) углерод
3) кислород
4) фосфор
A27. Вещество HCl
1) может быть только окислителем
2) может быть только восстановителем
3) может быть и окислителем, и восстановителем
4) не вступает в окислительно-восстановительные реакции
A28. Амфотерными свойствами обладает оксид элемента, расположенного в
1) IV периоде и побочной подгруппе II группы
2) V периоде и побочной подгруппе I группы
3) III периоде и главной подгруппе II группы
4) II периоде и главной подгруппе I группы
A29. Максимальная валентность азота равна
1) II
2) III
3) IV
4) V
A30. Согласно современным представлениям, периодическое изменение свойств химических элементов зависит от
1) массы ядра атома
2) массы атома
3) заряда атома
4) заряда ядра атома
A31. В основном состоянии наибольшее число неспаренных электронов – в атоме
1) серы
2) кремния
3) хлора
4) фосфора
A32. Закон постоянства состава веществ
1) справедлив для всех веществ
2) справедлив для веществ молекулярного строения
3) справедлив для веществ немолекулярного строения
4) оказался ошибочным
A33. В ряду углеводородов этан — этен — этин длина связи С–С
1) увеличивается
2) уменьшается
3) не изменяется
4) от этана к этену увеличивается, от этена к этину уменьшается
A34. Если к толуолу добавить бром, то
1) образуется вещество 3,5-дибромтолуол
2) образуется вещество бромфенилметан
3) образуется вещество строения 2,4,6-трибромтолуол
4) реакция между веществами не пойдет
A35. Общая формула вторичных аминов
| 1) R—C—NH2 | R |
| 2) R—N—R | H |
| 3) H2N—R—NH2 |
| 4) R—N=N—R |
A36. Пептидная связь есть в веществе
| 1) R—C—O—CH—R¢ || | O NH2 |
| 2) R—CH2—N—R¢ | H |
| 3) R—C—O—NH2 || O |
| 4) R—C—N—R¢ || | O H |
A37. Многоатомными называют спирты, в молекуле которых
1) много атомов кислорода
2) много атомов углерода
3) две и более гидроксильных группы
4) две и более карбоксильных группы
A38. Тепловой эффект химической реакции не зависит от
1) природы исходных веществ
2) промежуточных стадий получения веществ
3) агрегатного состояния исходных веществ
4) агрегатного состояния продуктов реакции
A39. Закон, выражающий зависимость скорости химической реакции от концентрации веществ, называется законом
1) действующих масс
2) постоянства состава
3) кратных отношений
4) Вант-Гоффа
A40. Коэффициент перед восстановителем в уравнении
AsH3 + AgNO3 + H2O ® H3AsO4 + Ag ¯ + HNO3 равен
1) 1
2) 2
3) 3
4) 4
A41. Не подвергаются гидролизу соли, образованные
1) сильным основанием и слабой кислотой
2) слабым основанием и сильной кислотой
3) сильным основанием и сильной кислотой
4) слабым основанием и слабой кислотой
A42. Процесс электролиза расплава хлорида натрия правильно описывает уравнение
| 1) 2NaCl = 2Na + Cl2 катод анод |
2) 2NaCl 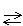 2Na + Cl2
катод анод 2Na + Cl2
катод анод
|
| 3) 2NaCl = 2Na + Cl2 анод катод |
4) 2NaCl 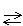 2Na + Cl2
анод катод 2Na + Cl2
анод катод
|
A43. Нейтральная среда в растворе аминокислоты, имеющей формулу
| 1) CH3—CH—COOH | NH2 |
| 2) CH2—CH2—CH—COOH | | NH2 NH2 |
| 3) HOOC—CH2—CH—COOH | NH2 |
| 4) CH3—CH—CH—COOH | | NH2 NH2 |
A44. Укажите формулу негорючего вещества.
1) CH4
2) CHCH
3) CH3—CH2OH
4) CCl2F2
A45. Состояние химического равновесия характеризуется
1) полным прекращением протекания реакций
2) равенством скоростей прямой и обратной реакций
3) поочередным протеканием прямой и обратной реакций
4) равенством числа молекул, участвующих в реакции
Часть 2
Ответом на задания этой части будет некоторое слово или число. Его надо записать в бланк ответов рядом с номером задания (В1-В10), начиная с первой левой клеточки. Каждую букву или цифру пишите в отдельной клеточке.
B1. Разновидности атомов одного и того же химического элемента, отличающиеся массовыми числами, называются … .
B2. Напишите абсолютное значение (без знака) заряда аниона в веществе, формула которого (NH4)2HPO4.
B3. В сокращенном ионном уравнении 2H+ + ? = CO2 + H2O пропущена формула иона, название которого … .
B4. Укажите число двойных связей в молекуле бензола.
B5. Процесс ароматизации продуктов переработки нефти называют … .
B6. В образовании единого р-электронного облака в молекуле фенола принимают участие электроны в количестве … .
B7. Изопропиловый эфир масляной кислоты образуется в результате реакции … .
B8. В результате реакции между пропаном и хлором образуется органическое вещество, которое называется… .
B9. Как называется продукт полимеризации 2-метилбутадиена-1,3?
B10. Укажите номер атома углерода, у которого происходит замещение атомов водорода при бромировании гексановой кислоты.
Часть 3
Для ответов на задания этой части используйте специальный бланк. Запишите сначала номер задания (С1 и т.д.), а затем запишите полный ответ.
C1. Рассчитайте количество теплоты, которое выделится при сжигании 29,1 г сульфида цинка в 33,6 л воздуха (н.у.), если термохимическое уравнение реакции
2ZnS + 3O2 = 2ZnO + 2SO2 + 890 кДж.
При расчете объемную долю кислорода в воздухе примите равной 20 %.
C2. С помощью молекулярных и ионных уравнений реакций объясните, почему при сливании растворов хлорида алюминия и карбоната натрия выпадает студенистый неокрашенный осадок и выделяется газ.
C3. Во сколько раз возрастет скорость химической реакции при повышении температуры на 40о, если температурный коэффициент равен 2?
C4. Напишите уравнения реакций, с помощью которых можно получить этанол из ацетата натрия. Укажите условия проведения каждой реакции.
C5. Напишите уравнение реакции между углеродом и концентрированной азотной кислотой, если известно, что образуются три оксида. Коэффициенты в уравнении расставьте методом электронного баланса.