М е ж м о л е к у л я р н а я внутримолекулярная
Взаимодействия между молекулами
Силы Ван-дер-Ваальса
– силы межмолекулярного взаимодействия (взаимодействия между молекулами), проявляющиеся на расстояниях, превосходящих размеры частиц.
(Ван-дер-Ваальс - голландский ученый, 1873 г.)

1. ОРИЕНТАЦИОННАЯ СОСТАВЛЯЮЩАЯ ИЛИ ДИПОЛЬ-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ – электростатическое взаимодействие полярных молекул при сближении (рис.а)
Еор увеличивается с увеличением mмол и уменьшением расстояния между молекулами.
|
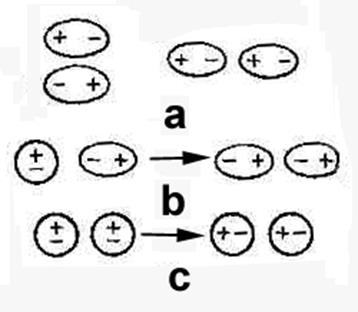 |
Чем выше температура, тем Еор –меньше.
3. дисперсионная составляющая(эффект Лондона)
-электростатическое взаимодействие мгновенных диполей, возникающих за счет флуктуации электрической плотности (рис.с). В результате согласованного (синхронного) движения мгновенных диполей энергия системы понижается.
Едис – энергия взаимодействия мгновенных диполей пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Длянеполярныхмолекул - дисперсионная –единственная из составляющих вандерваальсовых сил.
Влияние энергии межмолекулярного взаимодействия на свойства (Ткип ) веществ
Таблица 1
| вещество | mдиполя | Поляризуемость, М3×1030 | Энергия взаимодействия, кДж/моль | Ткип,К | |||
| ориентационная | Индукционная | Дисперсионная | Суммарная Ев | ||||
| H2 Ar Xe HCl HBr HI NH3 | 1,03 0,78 0,38 1,52 | 0,8 1,64 4,16 2,64 3,62 5,42 2,23 | 3,3 1,1 0,6 13,3 | 1,0 0,70 0,3 1,5 | 0,17 8,5 18,4 16,8 28,5 60,6 14,7 | 0,17 8,5 18,4 21,1 30,3 61,5 29,5 | 20,2 239,6 |
Максимальная энергия межмолекулярного взаимодействия åЕв проявляется на расстояниях 0,4 – 0,5 нм между центрами молекул, т. е. существенно больше длины химической связи.
åЕв –на 1-2 порядка ниже Е химической связи → таблица 1.
С увеличением размера молекул в ряду Аr – Хе и НСl – НI растет их поляризуемость и дисперсионное взаимодействие Едисперс →Таблица 1.
С увеличением молекулярной массы растет Едисперс→Таблица 1.
Еориентиц вносит значительный вклад в åЕв для молекул с большим mдип. → Таблица 1.
С увеличением åЕв возрастет Ткип жидкостей, а также теплота их парообразования. → Таблица 1.
Водородная связь -
|


м е ж м о л е к у л я р н а я внутримолекулярная
■ Межмолекулярная Н-связь
А – Н + В – R ® А – Н…В – R
Поляризованный водород способен внедряться в электронную оболочку соседнего отрицательно поляризованного атомаВ.
Атомы А и В могут быть одинаковыми:
Нd+-Fd- + Нd+-Fd- ® H-F…H-F
 |
имогут быть разными:
■ Внутримолекулярная Н-связь
 |
о-нитрофенол (а) салициловый альдегид (б)
 |
Изменение температуры кипения в ряду водородных соединений
Е(н-связи) возрастает с увеличением ЭО и уменьшением размеров атомов В:
►
 |
Несмотря на высокую ЭО хлора, водородная связь -Н…Сl- слабая из-за большого размера атома хлора.
► Энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовых сил.
►У воды длина связи О–Н – 0,096 нм, а связи О…Н – 0,177 нм.
► Возникновение водородных связей приводит к образованию димеров, тримеров и других полимерных структур, например, зигзагообразных структур (НF)n,
► Межмолекулярные Н-связи изменяют свойства веществ: повышают вязкость, диэлектрическую постоянную, температуру кипения и плавления, теплоту плавления и парообразования (см. рисунок выше):
Н2О, НF и NН3 имеют аномально высокие Ткип и Тпл.
3. ДОНОРНО–АКЦЕПТОРНОЕ ВЗАИМОДЕЙСТВИЕ
МЕЖДУ МОЛЕКУЛАМИ
- осуществляется, если одна из молекул имеет атом со свободными орбиталями, а другая – атом с внешней парой неподеленных электронов.
Пример:
- между различными молекулами
:NH3 + BF3 = NH3.BF3
(здесь: суммарные валентности азота и бора равны 4)
- между одинаковыми молекулами
AlCl3 + AlCl3 = Al2Cl6

Донорно-акцепторный механизм образования связей в димере Аl2Cl6.
ВЫВОД: Таким образом между молекулами существуют неспецифические - силы Ван дер Вальса и
специфические - водородные связи, донорно-акцепторные взаимодействия.