Опиоидные анальгетики
Международная ассоциация по изучению боли дает определение боли как "неприятного физического и эмоционального ощущения, вызванного реальным или потенциальным повреждением тканей". Восприятие раздражений, способных вызвать повреждение тканей, называется ноцицептивной чувствительностью (ноцицепцией). Это первая ступень в формировании боли. Ноцицептор – это нервный рецептор, способный различать повреждающие и неповреждающие раздражения. У человека ноцицепторами являются недифференцированные окончания А-дельта- и С-волокон (или, соответственно, тончайших миелинизированных и немиелинизированных волокон). А-дельта-волокна называют также механорецепторами высокого порога чувствительности. Они реагируют прежде всего на механические раздражения опасной интенсивности. А-дельта-волокна являются проводящими волокнами небольшого диаметра (от 1 до 6 мкм); С-волокна – это немиелинизированные проводящие волокна очень малого диаметра (< 1 мкм). Проводимость по А-дельта-волокнам осуществляется со скоростью 5–25 м/с, по С-волокнам – со скоростью 2 м/с. Основным компонентом С-волокон являются многофункциональные ноцицепторы, которые реагируют на термические, механические и химические повреждающие раздражения. Другие первичные афферентные ноцицепторы реагируют на эти стимулы более избирательно.
Тела нейронов первичных ноцицептивных афферентных волокон (чувствительных) располагаются в ганглиях задних (дорсальных) корешков спинного мозга. Центральные отростки этих нейронов поднимаются или опускаются на несколько сегментов спинного мозга по тракту Лиссауэра. Центральные отростки чувствительных нейронов заканчиваются в поверхностном слое заднего (дорсального) рога спинного мозга, в том числе в слое I (краевая зона) и слое II (желатинозная субстанция). Нейронами второго порядка называются все нейроны спинного мозга, которые получают импульсы от первичных афферентов. Нейроны широкого радиуса действия – нейроны спинного мозга, которые реагируют на раздражения различной интенсивности; например нейроны слоя V реагируют как на безвредное расчесывание волос в зоне их рецепторов, так и на сильное механическое раздражение и опасное нагревание. На рис. 4.22 отмечены слои серого вещества спинного мозга.
Рис. 4.22. Слои серого вещества спинного мозга I–VI
Размышляем самостоятельно
Подумайте, с какими рецепторами, помимо опиатных, связано болевое восприятие? Глютамат, высвобождаясь из первичных афферентных волокон, воздействует на рецепторы NMDA. Примерами ΝΜDA-опосредованных стойких функциональных изменений нейронов дорсального рога после травмы являются аллодиния (болевая реакция на неповреждающие раздражения) и гиперальгезия (обостренное восприятие повреждающих раздражений).
Два отдела таламуса участвуют в восприятии ноцицептивной информации: латеральный таламус и медиальный таламус. Выходящие из латерального таламуса импульсы в основном попадают в соматосенсорную кору. Медиальный таламус принимает участие в формировании эмоционального компонента восприятия боли. Пути болевых раздражений представлены на рис. 4.23.
Принято считать, что, для того чтобы испытывать боль, участие коры не обязательно. Но некоторые зоны коры активируются, когда человек испытывает боль (в основном в экспериментальных условиях). В числе этих зон – соматосенсорная кора, передняя поясная извилина и островковая зона коры. Такое распределение процессов в коре, вероятно, отражает сложную природу болевых ощущений, которая включает сенсорные дискриминационные, эмоциональные и когнитивные аспекты. Таким образом, разрушения какой-либо одной зоны коры может оказаться недостаточным для устранения боли.
Наряду с системой, воспринимающей боль (ноницептивной системой), существует система, подавляющая болевое восприятие (антиноцицептивная система). Строение аптиноцицептивной системы представлено на рис. 4.24. Благодаря этой системе человек не чувствует боли в решающие моменты жизни. Основу этой системы составляют опиатные рецепторы.

Рис 4.23. Пути болевых раздражений (по Гийому, Сеза и Мазарсэ):
1 – симпатический ствол; 2 – межпозвоночный узел; 3 – поперечное сечение спинного мозга на уровне девятого грудного позвонка; 4 – поперечное сечение спинного мозга на уровне первого шейного позвонка; 5 – поперечное сечение на уровне Варолиева моста; 6 – спинно-бугровый тракт; 7 – его шейная часть; 8 – его грудная часть; 9 – его пояснично-крестцовая часть; 10 – его крестцовая часть; 11, 12 – ядра зрительных бугров; 13 – лобная доля мозга; 14 – задняя центральная извилина; 15 – тройничный нерв; 16 – путь от тройничного нерва к зрительному бугру; 17 – путь от болевого рецептора в спинной мозг
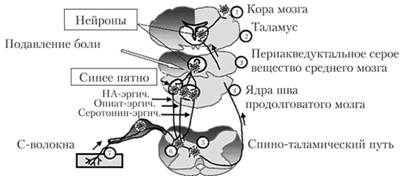
Рис. 4.24. Антиноцицептивная система
Анальгезия – это отсутствие боли в ответ на обычно болезненное раздражение. Анестезия означает утрату многих видов чувствительности с образованием зоны "нечувствительности". Анальгезия снижает только болевую чувствительность. Гиперпатия дословно означает очень сильную боль. Термин используется для обозначения патологически сильной болевой реакции на повторные раздражения. Альгогенные вещества, высвобождающиеся в поврежденных тканях или введенные подкожно, активируют или сенсибилизируют ноцицепторы (algos – боль). К альгогенам относятся гистамин и гистаминоподобные вещества, субстанция Р, калий и простагландины. Сенситизация – это состояние, при котором периферический рецептор или центральный нейрон вызывают более сильную (по сравнению с исходным уровнем) реакцию на раздражение или реагируют на стимулы, к которым в норме нечувствительны. Сенситизация возникает как на уровне периферических ноцицепторов, так и на уровне нейронов второго порядка спинного мозга.
Понятия первичной и вторичной боли вытекают из немедленных и замедленных болевых реакций на повреждающее раздражение. Используются также термины быстрая/медленная, острая/тупая и колющая/ жгучая боль. Раздражения, которые генерируют первичную (относительно локализованную, отчетливую) боль, передаются по основному болевому проводящему пути от рецепторов в ЦНС (неоспиноталамическому тракту) А-дельта-волокнами. Вторичная (более диффузная и плохо локализованная) боль преимущественно проводится по запасному болевому проводящему пути от рецепторов в ЦНС (палеоспиноталамическому тракту) при активации С-волокон, которые передают импульсы намного медленнее, чем и объясняется разница во времени.
При первичном болевом синдроме боль сама по себе является заболеванием. Примерами служат мигрень, невралгия тройничного нерва и кластерная головная боль. Вторичный болевой синдром является следствием структурных изменений; например, невралгия тройничного нерва может быть вызвана опухолью головного мозга. Одной из важнейших задач при любом первичном болевом синдроме является исключение органической патологии (опухоли или инфекции). Боль – это субъективное понятие, которое не подлежит обычной классификации.
Практически боль классифицируется:
• по предполагаемым патофизиологическим механизмам (ноцицептивные и неноцицептивные);
• факторам времени (острая или хроническая);
• локализации (зона болезненности);
• причинам (этиологии) (например, рак, артрит).
Нейрофизиологическая классификация боли основывается на предполагаемых механизмах боли. Выделяют два типа механизмов боли: ноцицептивный (в результате повреждения структур, чувствительных к боли) и неноцицептивный (нейропатический и психогенный). Ноцицептивная боль делится на соматическую и висцеральную (в зависимости от того, где активируются ноцицепторы). Нейропатическая боль делится на периферическую и центральную. Периферическая нейропатическая боль связана с повреждением нервов, ответственных за поддержание боли. Ноцицептивпая боль возникает при активации ноцицепторов (А-дельта- и С-волокон) повреждающими раздражителями, которые могут быть механическими, термическими или химическими. Ноцицепторы могут сенсибилизироваться эндогенными химическими раздражителями (альгогенными веществами), такими как серотонин, субстанция Р, брадикинин, простагландины, гистамин. Соматическая боль передается чувствительными нервами, а висцеральная боль – вегетативными.
Боль может часто ноющей (примером может служить зубная боль). Она может усиливаться при движении (эпизодическая боль) и уменьшаться в покос. Боль обычно соответствует вызвавшему ее поражению. Примерами соматической ноцицептивной боли являются боль при костных метастазах, послеоперационная боль, мышечно-скелетная боль и боль при артрите. Такие боли обычно купируются основными анальгетиками, такими как нестероидные противовоспалительные средства и опиоиды.
Висцеральная ноцицептивная боль возникает в результате растяжения полых органов и обычно воспринимается как диффузная, глубокая, сжимающая, схваткообразная. Она часто сочетается с вегетативными симптомами (тошнота, рвота и потоотделение). Характерны типичные зоны распространения или иррадиации (при ИБС – в плечо или нижнюю челюсть, при желчекаменной болезни – в лопатку, при панкреатите – в спину). Примерами висцеральной ноцицептивной боли являются боли при раке поджелудочной железы, кишечной непроходимости и внутрибрюшинных метастазах.
Нейропатическую боль больным часто трудно описать из-за незнакомых ощущений. Чаще всего используются слова "жжение", "электрический ток" и "онемение". Неповреждающие раздражения могут восприниматься как болезненные (аллодипия). Больные часто жалуются на приступообразные боли, напоминающие удар электрическим током (пронзающие). Примерами нейропатической боли являются невралгия тройничного нерва, постгерпетическая и периферическая нейропатия.
Боль носит психогенный характер, когда не удается выявить ни ноцицептивного, ни нейропатического механизма боли, но имеются выраженные психологические симптомы, соответствующие критериям депрессии или других психических заболеваний, для которых характерны жалобы на боль. Психогенная боль в чистом виде встречается редко. Чаще психологические факторы усугубляют хронический болевой синдром или наоборот.
Острая боль возникает одновременно с травмой и стихает по ходу заживления. От самого больного обычно ничего не зависит, хотя социальные, культурные и личностные факторы могут иметь некоторое значение. Острая боль часто купируется анальгетиками и стихает на фоне лечения первичного заболевания. Задержка лечения или его неадекватность может привести к развитию хронической боли. Хроническая боль часто определяется продолжительностью более трех месяцев или после завершения обычного процесса заживления. Хроническая боль не играет полезной биологической роли.
К опиоидным (наркотическим) анальгетикам относятся некоторые препараты алкалоидов опия – морфин, омнопон, кодеин, этшшорфин и синтетические заменители морфина – производные пиперидина тримеперидин ("Промедол"), фентанил, просидол, ремифентанил, пиритрамид ("Дипидолор"), тилидин ("Валорон"), трамадол и метадоны – декстропропоксифен ("Дарвон") (последние два препарата назначают внутрь).
Классификация опиатных рецепторов представлена в табл. 4.10. Активируя МЮ-, дельта-, каппа-рецепторы на пре- и постсинаптических мембранах афферентных волокон антиноцицептивной системы головного мозга, препараты угнетают кашлевой и дыхательный центры, возбуждают рвотный центр, вызывают спазм гладких мышц, суживают зрачок.
Таблица 4.10
Классификация опиатных рецепторов, рекомендуемая Международным союзом фармакологов (IUPHAR)
|
Опиоидные лиганды |
Опиоидные рецепторы |
||
|
Фармакологическая номенклатура |
Номенклатура молекулярно-биологическая |
Номенклатура IUPHAR* |
|
|
Энкефалины |
дельта |
ДОР |
ОР1 |
|
Динорфины |
каппа |
КОР |
ОР2 |
|
6-эндорфины |
мю |
МОР |
ОР3 |
Примечание. * – номер класса отражает динамику исследований по клонированию рецепторов: ОР1 клонированы раньше, чем ОР2 и ОР3.
Дельта-рецепторы (ОР1). Доказано существование минимум двух подтипов ОР1: дельта1- и дельта2-рецепторы (ОР1А и ОР1В). Эндогенными лигандами ОР1 являются лей- и мегэнкефалины. ΟΡ,-рецепторы участвуют в регуляции многих физиологических процессов: болевой чувствительности (в том числе и на спинальном уровне), когнитивных функций, настроения, зрения, дыхания, двигательной активности. Показано вовлечение ОР1-рецепторов в ингибирование эвакуаторной функции кишечника.
Каппа-реценторы (ОР2). Существует не менее трех подтипов каппарецепторов: каппа1-, каппа2- и каппа3-рецепторы. Наиболее изученными считаются каппа1-рецепторы. ОР2-рецепторы вовлечены в регуляцию нейроэндокринной секреции, диуреза, ноцицепции, потребления пищи. Они обнаружены также на иммунокомпетентных клетках. Каппа-рецепторы тормозят выделение дофамина. Подавление выброса дофамина сопровождается развитием синдрома отмены (дисфория, тревожность и др.).
Мю-рецепторы (ОР3). Наиболее изученный тип. В ткани мозга обнаружен эндогенный морфин, являющийся частичным агонистом мю-рецепторов. Кроме морфина, агонистами этих рецепторов являются фентанил. К антагонистам относят налоксон, налтрексон.
Возбуждая опиатные морфинорецепторы опиоидные анальгетики влияют на передачу (трансмиссия), усиление (модуляция), восприятие (перцепция) боли. Механизм действия обезболивающих средств представлен на рис. 4.25.
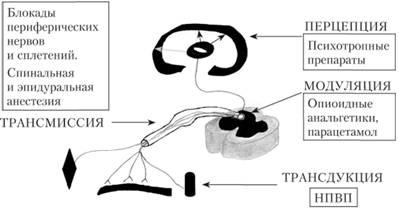
Рис 4.25. Механизм действия обезболивающих средств
Опий – застывший млечный сок, получаемый из надрезов незрелых головок снотворного мака. Морфин – основной алкалоид опия, составляющий 10% его массы. "Омнопон" – смесь пяти алкалоидов опия. Синтетические препараты отличаются от морфина по химическому строению, но близки по фармакологическому действию. Наркотические анальгетики являются миметиками эндогенных энкефалиновых и эндорфинных рецепторов, уменьшают за счет этого боль и повышают толерантность (переносимость) боли. Они уменьшают вегетативные реакции на боль, связанные с альфа-адренергической стимуляцией. Препараты показаны при сильных болевых ощущениях (острый инфаркт миокарда, боли у онкологических больных), в качестве премедикации, редко применяются в качестве противокашлевых (кодеин) и антидиарейных средств.
Побочные эффекты связаны с действием на ЦНС (депрессия, сонливость, миоз, угнетение, судороги, дезориентация, кома). Со стороны желудочно-кишечного тракта возможны тошнота, рвота, спазм желчевыводящих путей, сердечно-сосудистой системы – ортостатическая гипотензия, коллапс, аритмия, остановка сердца.
Наркотические анальгетики вызывают угнетение дыхания, бронхоспазм, эйфорию (необоснованно повышенное настроение), галлюцинации, лекарственную зависимость, синдром отмены.
В последнее время препараты морфина под названием "МСТ континус" выпускают в виде таблеток но 10, 30, 60, 100 и 200 мг пролонгированного действия (в течение 12 ч).
Антагонист наркотических анальгетиков налоксон применяется при их передозировке и блокирует опиатные рецепторы.
Другой антагонист налтрексон имеет наибольшее сродство к мю- и каппа-рецепторам. Он снижает эффект анальгетиков (анальгетический, противодиарейный, противокашлевой), устраняет побочные эффекты. В сравнении с налоксоном он действует более сильно и длительно. У пациентов с опиоидной зависимостью он вызывает приступ абстиненции. Используется при опиоидной наркомании (в качестве вспомогательного лекарственного средства после отмены опиоидных анальгетиков), при алкоголизме.
Сравнительная характеристика опиоидных анальгетиков представлена в табл. 4.11.
Таблица 4.11
Сравнительная характеристика опиоидных анальгетиков
|
Показатели |
Морфин |
Промедол |
Фентанил |
Буторфанол |
Бупренорфин |
Трамадол |
|
Средние анальгетические дозы, мг (парентерально) |
10 |
20-40 |
0,1 |
2-3 |
0,3 |
50-100 |
|
Длительность действия,ч |
4–5 |
3-4 |
0,5 |
3-4 |
5-6 |
3-5 |
|
Активность при пероральном приеме |
Низкая |
Низкая |
Не используется |
Низкая |
Высокая |
Высокая |
|
Эйфория, противотревожное действие |
+ + + |
+ + |
+ |
+ |
+ + |
+ |
|
Угнетение дыхания |
+ + + |
++ |
++++ |
+ |
+ + + |
+ |
|
Гемодинамика |
Брадикардия |
Мало изменяется |
Брадикардия, гипотензия |
Гипертензия |
Не изменяется |
Редко тахикардия, гипотензия |
|
Спазмогенное действие |
+++ |
++ |
+++ |
+ |
++ |
+ |
|
Тошнота, рвота, % |
35-46 |
2-35 |
Редко |
6 |
5-10 |
5 |
|
Явления абстиненции (выраженность) |
+ + + |
+ + + |
+ + |
+ |
+ + |
+ |